Актуальность. В настоящее время в мире нет единой тактики ведения пациентов с аномалиями мочевого протока. Исторически сложилось мнение о том, что мочевой проток облитерируется на 4–5-м месяце внутриутробного развития, к рождению ребенка превращаясь в фиброзно-мышечный тяж, располагающийся внутри ligamentum medianum [1–5], а нарушения его инволюции в связи с редкостью клинических проявлений долгое время считались редкой патологией, сопряженной с высоким риском развития инфекционно-воспалительных осложнений, а с возрастом – малигнизации. В связи с этим традиционный подход к лечению пациентов с дериватами урахуса в случае их обнаружения предусматривает хирургическое вмешательство [6–8], зачастую с полным их иссечением [10–12].
Цель исследования: пересмотр и возможная оптимизация лечебно-диагностического алгоритма, в первую очередь для детей с бессимптомными дериватами мочевого протока.
Материалы и методы. Проведено скрининговое ультразвуковое обследование 159 детей, ранее подробно нами описанное [9]. Всем детям выполнялось сканирование передней брюшной стенки от верхушки мочевого пузыря до пупка в горизонтальной и сагиттальной плоскостях. Оценивали наличие структуры мочевого протока, признаков дифференцировки ее стенки (на основании сопоставления эхографической картины с результатами патогистологического исследования оперированных детей; рис. 1) и просвета.
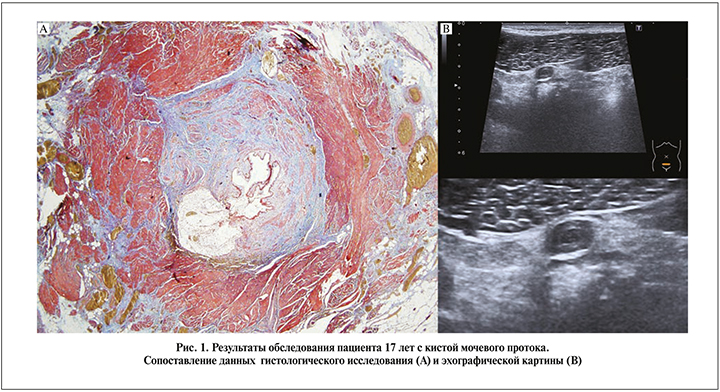
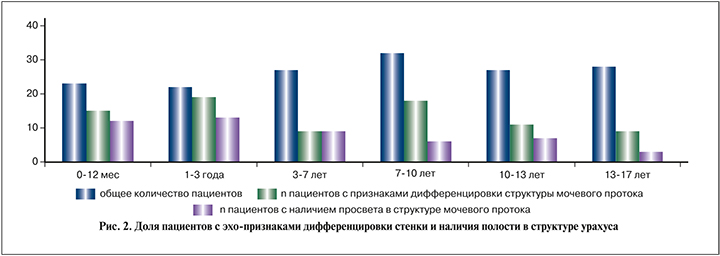
Структура мочевого протока, чаще в нижней и средней третях, была выявлена у 150 (94,34%) детей. Признаки дифференцировки структуры мочевого протока выявлены у 66 (41,5%) пациентов (44% от общего числа пациентов с наличием структуры урахуса). Полость обнаружена в 50 (31,44%) случаях (33,3% от общего числа пациентов с выявленной структурой урахуса), чаще всего в нижней (47 пациентов), реже – в средней и верхней третях (15 и 3 случая соответственно).
Как видно на рис. 2, полости в структуре урахуса выявили во всех возрастных группах, однако с возрастом доля пациентов с такими изменениями неуклонно снижается.
Результаты и обсуждение. В литературе на сегодняшний день наиболее часто указывается низкая частота встречаемости аномалий мочевого протока (зачастую доли процента), хотя данные об этом значительно разнятся. В то же время частота возникновения злокачественных опухолей уракального происхождения (более 90% имеют гистологическую структуру аденокарциномы) известна. Среди аденокарцином мочевого пузыря они составляют около 30% (по данным различных авторов, от 10 до 35%) [13–16]. Кроме того, группой исследователей из клиники Mayo в 2007 г. было убедительно продемонстрировано, что риск малигнизации значительно увеличивается с возрастом [16]. Эти данные послужили основанием для активной хирургической тактики в случае выявления дериватов урахуса. Данные, полученные в нашем исследовании, свидетельствуют о том, что аномалии мочевого протока встречаются значительно чаще, чем принято было считать. При этом они коррелируют с результатами некоторых проведенных ранее патологоанатомических и скрининговых ультразвуковых исследований, направленных непосредственно на выявление дериватов урахуса (в отличие от многих предшествовавших публикаций, основанных на ретроспективном анализе медицинской документации) [17–21]. Вместе с тем нельзя не учитывать факта, согласно которому доля уракальных аденокарцином в структуре злокачественных опухолей мочевого пузыря (риск возникновения которых в течение жизни оценивается в 3%) варьируется от 0,07 до 10% (большинство авторов называют цифру 1–2%) [13, 23–28]. То есть вероятность возникновения аденокарциномы уракального происхождения можно оценить в сотые доли процента (примерно в 0,03–0,06%). Так как аденокарцинома является опухолью, происходящей из железистого эпителия, мы исходим из предположения, что риск ее минимален в случае обнаружения при УЗИ эхо-структуры фиброзного тяжа и значительно выше, если определяется четкая дифференцировка слоев стенки мочевого протока с эпителиальным компонентом. Из этого следует, что риск возникновения злокачественной опухоли выше в группе пациентов, доля которых в нашем исследовании составила 41,5%.
Подытоживая сказанное, считаем, что вероятность малигнизации в течение жизни при обнаружении хорошо дифференцированной структуры мочевого протока на сегодняшний день значительно ниже 1%, вероятнее всего, находится в диапазоне 1–2‰ (без учета возможности постнатальной инволюции).
Эти данные заставили нас пересмотреть свою позицию в отношении целесообразности полного иссечения структур урахуса из-за риска злокачественного перерождения.
Также нельзя не отметить значительное количество публикаций последних лет, в которых авторы рекомендуют придерживаться консервативной тактики в лечении аномалий мочевого протока. Так, например, в одной из недавних публикаций P. Aylward et al. [29] приходят к выводу, cогласно которому оперативное лечение связано с бόльшим количеством осложнений, риском повторной операции, а также последующих госпитализаций и более продолжительным пребыванием в стационаре [29]. Их выводы созвучны результатам более ранних работ. J. K. Stopak et al. [30] также указывают на относительно высокий уровень послеоперационных осложнений и рекомендуют консервативное лечение неинфицированных дериватов. К аналогичным выводам пришли и C. R. Dethlefs et al., сравнив две группы пациентов, пролеченных в разные временные периоды [31].
Руководствуясь представленными выше данными литературы, а также собственными результатами, мы разработали следующий лечебно-диагностический алгоритм.
Тактика при выявлении бессимптомной аномалии урахуса. На наш взгляд, сам факт наличия деривата мочевого протока не должен служить показанием к операции. Дети с необлитерированными участками мочевого протока, выявленными при УЗИ или лапароскопии, должны быть обследованы с целью определения дальнейшей тактики лечения. Всем детям с дериватами урахуса должно быть проведено УЗИ органов брюшной полости и структур передней брюшной стенки для верификации типа аномалии, ее локализации и размеров. Считаем, данные УЗИ, проведенного по описанной нами методике [9], позволяют формировать достаточно полное представление о характере аномалии в подавляющем большинстве случаев.
По нашему мнению, при бессимптомном необлитерированном участке мочевого протока небольших размеров хирургическое лечение не показано. Ребенок может быть отпущен под наблюдение уролога с проведением контрольного УЗИ 1 раз в год, позднее – с бόльшими временными интервалами. В случае спонтанной инволюции мочевого протока дальнейшего наблюдения не требуется.
Показания к оперативному лечению бессимптомных аномалий мочевого протока:
1. Наличие признаков опухолевого роста при проведении инструментального обследования. Известно, что появление злокачественных новообразований дериватов мочевого протока – казуистически редкое явление в детской практике. Тем не менее имеются свидетельства роста метастазов других опухолей внутри структур мочевого протока, что, безусловно, требует верификации диагноза.
2. Наличие в полости урахуса конкремента. В этом случае имеется риск формирования пролежня и перфорации стенки, хотя оценить риск развития подобного осложнения крайне затруднительно в связи с малым количеством наблюдений.
3. Тенденция к росту кисты и ее значительные размеры, превышающие 2 см в диаметре. Киста больших размеров может приводить к сдавлению окружающих органов (петель кишки, мочевого пузыря), что служит показанием к ее удалению. Приведенный критерий (размер кисты 2 см) относительный и в каждом конкретном случае должен быть рассмотрен индивидуально.
Если неизмененная аномалия мочевого протока выявлена при лапароскопии по поводу другого заболевания, показанием к ее удалению (в том случае, если состояние ребенка и характер основной операции позволяют проведение симультанного вмешательства) служит большой размер деривата (чаще – кисты урахуса). Признаки же опухолевого роста, напротив, служат основанием для интраоперационной биопсии с последующим комплексным обследованием (staging) и решением вопроса о тактике. Объем резекции, на наш взгляд, может ограничиваться патологически измененным участком и не должен включать иссечение всех тканей мочевого протока и резекцию дна мочевого пузыря в подавляющем большинстве случаев.
Тактика при наличии деривата мочевого протока, сопровождающегося клиническими проявлениями. Боль в животе. Аномалии мочевого протока могут проявляться абдоминальным болевым синдромом при достижении ими значительных размеров, однако намного чаще жалобы на боли в животе в детском возрасте свидетельствуют о развитии инфекционно-воспалительного процесса. Боли обычно локализуются в проекции воспаленного деривата. При этом определяется локальная болезненность при перкуссии брюшной стенки. При УЗ-сканировании отмечается подчеркнутая слоистость стенок, просвет приобретает «правильные» очертания в связи с повышением давления внутри полости. Общий анализ крови и уровень С-реактивного белка могут подтвердить подозрения на наличие инфекционного процесса.
Опираясь на данные литературы, мы склонны рекомендовать в таких случаях консервативную тактику. Ребенку назначается антибактериальная терапия (антибиотики широкого спектра действия: пенициллины, цефалоспорины I–III поколений) до полного купирования воспалительного процесса с контролем лабораторных показателей и УЗИ. Рецидив болевого синдрома служит показанием к плановому оперативному лечению после проведения повторного курса антибактериальной терапии и предоперационного обследования.
В ряде случаев боли в животе настолько интенсивные, что исключить острую хирургическую патологию органов брюшной полости не представляется возможным. Такие пациенты с клинической картиной «острого живота» требуют проведения диагностической лапароскопии в экстренном порядке. В случае если при проведении ревизии органов брюшной полости удается установить, что причиной болевого синдрома служит воспаленная киста мочевого протока, безусловными показаниями к ее удалению является наличие перфорации либо некротических изменений стенки. Несмотря на то что среди наших пациентов одномоментное удаление воспаленной кисты урахуса не сопровождалось гнойно-воспалительными осложнениями, нами отмечено увеличение частоты возникновения макрогематурии в конце первых – начале вторых послеоперационных суток (даже в тех случаях, когда область мочевого пузыря в процессе хирургического вмешательства оставалась интактной). Кроме того, в нескольких исследованиях убедительно продемонстрировано, что двухэтапная методика более безопасна [6, 12, 32].
При значительных размерах воспаленной кисты рекомендуем проведение дренирования кисты через переднюю брюшную стенку под контролем лапароскопии.
Омфалит. Гиперемия, инфильтрация мягких тканей, болезненность при пальпации в области пупка и наличие гноевидного отделяемого у детей старшего возраста практически всегда служат свидетельством наличия пупочного синуса (неполного свища пупка). Если при помощи УЗИ удается подтвердить наличие аномалии мочевого протока, дальнейшее лечение направлено на купирование воспалительного процесса (антибактериальная терапия, перевязки). После этого выполняют фистулографию, чтобы оценить протяженность необлитерированного участка и провести дифференциальную диагностику с дериватом омфаломезентериального протока. Считаем, что при наличии пупочного синуса небольшого размера целесообразна попытка консервативной терапии. Рецидивирующий омфалит после неудачной попытки склерозирования служит показанием к плановому оперативному лечению.
Выделение мочи через пупок является симптомом, проявляющимся с рождения и свидетельствующим о наличии полного пупочного свища. В большинстве случаев таким детям рекомендуется плановое оперативное лечение.
Однако, если выделение мочи происходит незначительными порциями только при сильном натуживании и плаче, допустима выжидательная тактика до достижения ребенком возраста 6 мес. Описанные B. Zieger et al. [18] закономерности постнатальной инволюции дериватов мочевого протока показывают, что вероятность спонтанной облитерации пупочного свища в таких случаях достаточно высока.
«Мокнущий пупок» проявляется наличием отделяемого серозного или серозно-слизистого характера. Следует отметить, что, согласно нашим наблюдениям, подобные симптомы нередко встречаются у детей старшей возрастной группы. После подтверждения диагноза и при неэффективной попытке склерозирования рекомендуем лапароскопическое удаление пупочного синуса.
Заключение. Полученные нами данные о том, что неполная облитерация мочевого протока встречается в различных возрастных группах более чем в 30% случаев, коррелируют с рядом более ранних публикаций, авторы которых ставили перед собой задачу определения закономерностей его постнатальной инволюции и ее нарушений. Основываясь на предположении, будто опасность злокачественного перерождения в прошлом была значительно переоценена, мы склонны рекомендовать наблюдение и по возможности консервативное ведение этой группы пациентов в детском возрасте, считая выраженность клинических проявлений основным показанием к хирургическому лечению.



