В 2017 г. в России было зарегистрировано 24,8 тыс. новых случаев заболевания раком паренхимы почки (РП) (3% среди всех злокачественных новообразований и 7-е ранговое место). В период с 2012 по 2017 г. отмечен рост заболеваемости РП на 13,8% у мужчин (с 12,3 до 14,0 на 100 тыс. населения) и на 16,4% у женщин (6,7 и 7,8 на 100 тыс. населения) [1].
Этот рост напрямую связан с совершенствованием и доступностью таких визуализирующих технологий, как ультразвуковая диагностика, мультиспиральная компьютерная (МСКТ) и магнитно-резонансная томография [2, 3]. За последние десятилетия частота случайного обнаружения образований почки значительно выросла: если в 1960 г. такие случаи составляли только 10% от общего числа пациентов, то в настоящее время – более 70% [4]. Также стоит отметить постепенное уменьшение среднего размера первично диагностированных образований паренхимы почки. Так, в 1989 г. этот размер составлял 7,8 см, в 1998 г. – 5,3 см, а сегодня – не превышает 4 см [5].
После публикации в 1969 г. результатов работы C. Robson et al. в мире признанным «золотым» стандартом радикального лечения РП независимо от размеров образования паренхимы почки стала радикальная нефрэктомия из открытого доступа [6]. Выполнение органосохраняющих операций (ОСО) при РП с этого момента на протяжении около 20 лет было регламентировано только абсолютными и относительными показаниями.
В настоящее время в лечении РП все шире применяются органосохраняющие и аблативные методы хирургических вмешательств, выполняемые как из открытого, так и из малоинвазивного доступа.
Причиной столь значимых перемен в хирургическом лечении РП стало проведение ряда научных исследований, доказавших онкологическую безопасность и выявивших лучшие показатели выживаемости больных после ОСО [7–9].
При определении хирургической тактики лечения пациентов РП на этапе предоперационного планирования принимают во внимание две основные группы факторов. Первые связаны с патологической анатомией образований почки: размером, расположением в паренхиме почки, соотношением с сосудами почки и чашечно-лоханочной системой. Вторая, не менее важная группа факторов непосредственно связана с пациентом, его возрастом, коморбидным фоном, индексом массы тела, функциональным состоянием почки и другими факторами.
В организме человека жировая клетчатка в основном локализуется в двух областях: в подкожном слое – подкожно-жировая клетчатка (ПЖК) и в брюшной полости – висцеральная клетчатка (ВК). Согласно [10], в норме ВК у мужчин составляет 10–20%, у женщин – 6–8% от общего объема всей жировой клетчатки организма, при этом с возрастом ее объем увеличивается.
Структурная единица жировой клетчатки, адипоцит, на 95% состоит из жировой капли, в которой содержатся триглицериды, а оставшиеся 5% цитоплазмы клетки наполнены биологически активными веществами [11]. Кроме того, в состав жировой клетчатки входят макрофаги, клетки иммунной системы, соединительная ткань, сосуды и нервные окончания. По сравнению с ПЖК в ВК содержится больше сосудов и нервных окончаний, что подтверждает ее особое функциональное значение для организма человека. Одна из основных функций ВК – поддержание гормонального гомеостаза, обеспечивается благодаря способности адипоцитов вырабатывать адипокины: биологически активные вещества, наиболее изученные из которых лептин, адипонектин, резистин и др. [12, 13].
До 60% ВК находятся в паранефральном пространстве, остальные 40% – в сальнике и брыжейке кишечника [14].
При увеличении объема ВК наступает липидная дисрегуляция с вторичными изменениями в работе инсулиносигнального каскада и последующим развитием метаболического синдрома [15, 16]. В его основе лежат хронические воспалительные процессы, обусловленные нарушением работы адипоцитов. Гипертрофированные адипоциты усиленно секретируют цитокины, приводя к макрофагальной инфильтрации и активации хронических воспалительных путей [17].
К основным клиническим проявлениям метаболического синдрома относятся дислипидемия, нарушение толерантности к глюкозе и артериальная гипертензия; эти изменения повышают риски развития заболеваний сердечно-сосудистой системы, сахарного диабета 2 типа, что в конечном счете увеличивает общую летальность [18]. Кроме перечисленных нарушений у пациентов с метаболическим синдромом в паранефрии формируются плотные фиброзные сращения между почечной капсулой и жировой клетчаткой.
В клинической практике такую «сложную» паранефральную клетчатку (ПК) называют по-разному: «Adherent Perinephric Fat» (APF), «sticky fat», «липкий», или «hostile fat», «неблагоприятный» жир. На данный момент в медицине нет четкого определения APF. Для описания APF очень подходят слова W. White и Derweesh: «You know it when you see it» («Узнаешь, когда увидишь») [19].
По мнению ведущих исследователей, системное хроническое воспаление, развивающееся при метаболическом синдроме, служит основным этиологическим фактором развития АПФ [20, 21]. Накоплено немало доказательств того, что фиброзные изменения – это результат хронического неспецифического воспалительного процесса в ПК у пациентов c метаболическим синдромом [22].
Кроме того, опухоль паренхимы почки тесно взаимодействует с адипоцитами и другими клетками, входящими в состав ПК. Вокруг опухоли формируются хронические воспалительные изменения, на фоне которых происходит стимуляция пролиферации клеток с индукцией неоангиогенеза и фиброзных изменений окружающей жировой клетчатки [22]. Патологические изменения при опухолевом процессе, по мнению H. Dvorak, можно охарактеризовать как незаживающие раны (wounds that do not heal) [23].
Урологи отмечают присутствие APF при выполнении ОСО на этапе мобилизации почки из ПК. Сложность операции в этом случае повышается за счет ограниченной подвижности почки и трудности выделения почечных ворот.
В конечном итоге увеличивается продолжительность пособия и возрастает риск периоперационных осложнений.
Частота выявления APF варьируется в довольно широких пределах – от 10,6 до 55,2% [20, 24, 25]. Такой разброс зачастую связан с субъективной оценкой, которая строится на мнении хирурга, выполняющего операцию. Между тем операторы имеют разный уровень хирургических навыков, да и степень выраженности APF бывает различной.
Для любого хирурга весьма важен прогноз наличия APF на этапе предоперационного планирования. В настоящее время был проведен ряд исследований, в которых анализировались клинические факторы и данные лучевых методов диагностики, достоверно указывающие на присутствие APF [21, 26–29]. Среди клинических факторов риска APF наибольшее значение имеют пол и возраст пациента. Было доказано, что риск формирования APF намного выше у мужчин пожилого возраста [26, 28, 30, 31]. Это может быть связано с тем, что процент висцерального ожирения у мужчин фиксируется чаще, а его частота с возрастом увеличивается. Также обнаружено, что большой объем ПК характерен скорее для мужчин, чем для женщин [32].
Другой клинический фактор – индекс массы тела (ИМТ). По сути ИМТ не отражает разницы в расположении жировой ткани между ПЖК и ВК, а просто констатирует соотношение массы тела к росту. Необходимо отметить, что повышенный ИМТ является одним из факторов риска развития РП [4, 33]. Так, согласно мета-анализу А. Renehan et al. [33], увеличение ИМТ на 5 кг/м2 увеличивает риск развития РП на 24% у мужчин и на 34% у женщин.
Высокий ИМТ также повышает вероятность развития интраоперационных осложнений, кроме того, влияет на выживаемость пациентов с РП [34, 35]. Однако прямой зависимости между присутствием APF и увеличенным ИМТ в исследованиях обнаружено не было.
В работе Bylund et al. [20] впервые был проведен сравнительный анализ 16 пациентов с APF и контрольной группы, в ходе которого было установлено, что кроме клинических характеристик (возраст, пол, ИМТ) пациенты статистически значимо отличались по толщине ПК на сагиттальных сканах МСКТ, измеряемой на уровне ворот почки в месте вхождения почечной вены. При этом показатель плотности ПК, измеряемой в данной области, не был достоверным признаком наличия AПФ [20].
К подобному заключению пришли L. Martin et al. [36], которые при проведении однофакторного анализа обнаружили, что плотность жировой клетчатки при пороговом значении 80 HU является прогностическим фактором, а при многофакторном анализе подтвердить это не смогли. Однако плотность определяли только в области ворот почки на уровне почечной вены, а эта небольшая зона не может дать полноценную информацию о состоянии почечной APF.
При измерении плотности ПК в работе [26] был использован другой подход: авторы оценивали плотность поверхности ПК (PNfsd). Для этого в исследуемой области подсчитывали пиксели, находящиеся в пределах от -190 до -30 HU. Данный показатель был больше у пациентов с APF и показал достоверность при многофакторном анализе в прогнозировании сложности диссекции (p<0,0001) [26].
Для более прецизионной оценки ПК с целью прогноза APF Khene et al. использовали текстурный анализ МСКТ с контрастированием и без у 70 пациентов, при этом определяли 15 признаков текстуры. В пределах ROI (зоны интереса) выделены три статистически значимые характеристики текстуры: асимметрия (р=0,02), энтропия (р=0,01) и суммарная энтропия (р=0,04). В заключение авторы отметили, что текстурный анализ можно использовать в качестве дополнения к обычной визуализации для выявления новых визуализирующих биомаркеров путем извлечения данных, которые могут быть не видны невооруженным глазом [37].
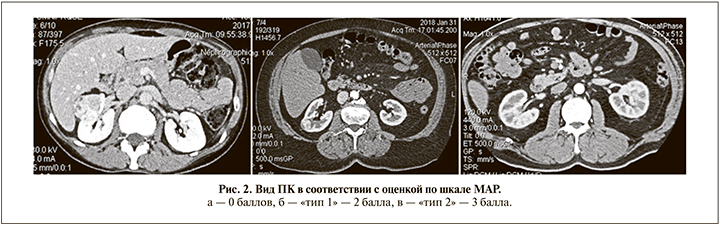
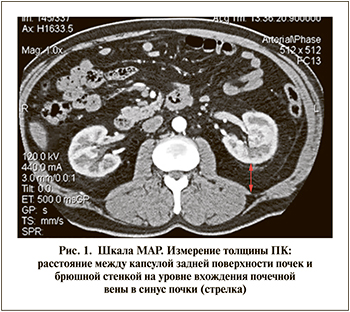 Первая прогностическая шкала на основании данных методов лучевой диагностики МАР («Mayo Adhesive Probability») с целью прогнозирования присутствия APF была разработана Davidiuk et al. [21]. При многофакторном анализе в состав шкалы была включена сумма из двух показателей на основании анализа поперечных сканов МСКТ. Первый показатель, толщина ПК, – это расстояние между капсулой задней поверхности почки и брюшной стенкой на уровне вхождения почечной вены в синус почки (рис. 1) [38]. Расстояние <1 см не оценивалось, 1 балл присваивался при толщине от 1 до 1,9 см, 2 балла – при размере ≥2 см. Второй показатель – это оценка вида ПК, окружающей почку [39]. Данным видам ПК присваивается балльная оценка, которая может варьироваться в диапазоне от 0 до 3 баллов (рис. 2). Согласно работе Davidiuk et al. [21], APF был отмечен при следующих баллах шкалы MAP (%): 0–6, 1–16, 2–31, 3–50, 4–86, 5–100 [21].
Первая прогностическая шкала на основании данных методов лучевой диагностики МАР («Mayo Adhesive Probability») с целью прогнозирования присутствия APF была разработана Davidiuk et al. [21]. При многофакторном анализе в состав шкалы была включена сумма из двух показателей на основании анализа поперечных сканов МСКТ. Первый показатель, толщина ПК, – это расстояние между капсулой задней поверхности почки и брюшной стенкой на уровне вхождения почечной вены в синус почки (рис. 1) [38]. Расстояние <1 см не оценивалось, 1 балл присваивался при толщине от 1 до 1,9 см, 2 балла – при размере ≥2 см. Второй показатель – это оценка вида ПК, окружающей почку [39]. Данным видам ПК присваивается балльная оценка, которая может варьироваться в диапазоне от 0 до 3 баллов (рис. 2). Согласно работе Davidiuk et al. [21], APF был отмечен при следующих баллах шкалы MAP (%): 0–6, 1–16, 2–31, 3–50, 4–86, 5–100 [21].
За последние годы был проведен ряд проспективных и ретроспективных исследований, подтвердивших прогностическую значимость шкалы MAP в отношении APF, в которых был проведен анализ ОСО, выполненный из разных оперативных доступов [28–31, 36].
Так, в работе [31], при проведении многофакторного анализа 311 ОСО из робот-ассистированного доступа было установлено, что консольное время диссекции и резекции почки пациентов с APF превышало 90 мин (OR=6,20; p<0,0001), но показатели объема кровопотери и частоты возникновения периоперационных осложнений не были статистически значимыми вне зависимости от наличия и отсутствия APF [31].
Противоположные данные в отношении объема кровопотери получены в работах [28, 30]: 202 и 125 ОСО, средняя величина кровопотери в группах больных с APF составила 330 (p<0,0001) и 200 мл (p<0,0008) соответственно. Кроме того, в исследовании [28] в группе пациентов с APF чаще требовалась конверсия в открытый доступ и/или выполнение орагноуносящего пособия. Несмотря на эти различия, ни в одном из исследований не было получено данных об изменении продолжительности тепловой ишемии в зависимости от наличия APF. Это вполне объяснимо, так как APF создает сложности на этапе выделения опухоли и сосудов почечной ножки до наложения сосудистого зажима, что увеличивает время оперативного вмешательства, но не влияет на длительность тепловой ишемии.
Разницу в результатах можно объяснить следующим. Во-первых, в работах анализируется результат пособий, выполненных из разных оперативных доступов разными хирургами с различным опытом. Хотя необходимо отметить, что опытные хирурги могут легко справляться с трудностями, возникающими в ходе ОСО при наличии APF, практически не влияя на периоперационные результаты.
Во-вторых, авторы по-разному формировали группы наблюдений в зависимости от количества баллов по шкале МАР. Так, если в работе Dariane et al. в группу включались пациенты с APF ≥2 баллов, в работе Khene et al. с APF ≥ 3 баллов, то в работе Martin et al. с APF ≥4 балов [28, 30, 36]. С учетом этого факта оправданным представляется предложение L. Martin et al. принимать для присутствия APF значения по шкале МАР ≥4 баллов. Учитывая такие разночтения по шкале МАР, особого внимания заслуживает исследование [40], в котором были определены интраоперационные критерии оценки сложности иссечения APF: D1 – если APF прирастает к капсуле слабо и для мобилизации необходимо менее 10 мин, D2 – на мобилизацию уходит от 10 до 20 мин, D3 – «липкий жир», мобилизация почки занимает больше 20 мин; однако в итоге авторы изменили первоначально предложенную классификацию, оставив только две категории: «простая диссекция» и «сложная диссекция».
Немного другой подход к оценке присутствия APF был использован в работе [30], где исследователи предложили периоперативную хирургическую шкалу от 0 до 3 баллов: 0 баллов – ПК отсутствует, 1 балл – отсутствует APF (т.е. ПК есть, но она не спаяна с капсулой), 2 балла – APF есть, но не приводит к декапсуляции во время диссекции почки, 3 балла – наличие APF приводит к декапсуляции [30].
Несколькими авторами была проведена оценка влияния APF на функциональные и онкологические результаты ОСО [20, 30, 40, 41]. В работе [30] были отмечены статистически значимое снижение уровня СКФ и изменение стадии хронической болезни почки в послеоперационном периоде у пациентов с APF. Противоположные данные получили J. Bylund et al. [20]: при сравнительном анализе результатов ОСО 16 пациентов с APF с 13 пациентам контрольной группы значимых различий по функциональным результатам обнаружено не было.
Оценка онкологических результатов больных APF была выполнена D. Thiel et al. [40]. По результатам анализа 456 ОСО худшие показатели безрецидивной выживаемости наблюдались у пациентов с оценкой 4–5 баллов по шкале МАР (95% CI – 1,15–4,06, p=0.017). В какой-то степени эти данные согласуются с результатами работы [41], согласно которым толщина ПК служит фактором риска рецидивирования светлоклеточного РП. В вопросе применения шкалы МАР для прогнозирования онкологических результатов представляет интерес работа A. Bernstein et al., в которой, по данным многофакторного анализа, установлено, что шкала МАР обладает большей достоверностью в прогнозе злокачественности РП на стадии Т1 (OR=1,374, 95% CI – 1,007–1,873; p=0.045). При этом ни шкала МАР, ни толщина ПК не являются достоверным показателем прогноза ядерной дифференцировки по шкале Фурман [42].
Подводя итог, можно сказать, что прогноз присутствия APF на этапе планирования оперативного вмешательства является важной опцией в арсенале врача-уролога. Наиболее известной оценкой качества ПК считается шкала МАР. Балльная оценка проста в использовании и доступна любому специалисту. Это позволяет хирургу не только получить прогноз периоперационных результатов (продолжительность операции, объем кровопотери и риск развития осложнений), но и спрогнозировать природу новообразования почки и вероятность риска развития рецидива заболевания.



