Введение. Активное внедрение в практику методов таргетной химиотерапии, основанное на антиангиогенном механизме воздействия, ознаменовало открытие новой эпохи в лечении злокачественных заболеваний почечной паренхимы. Однако результативность таргетной терапии в отношении почечно-клеточного рака оказалась не столь впечатляющей, как хотелось бы, что, возможно, связано с наличием метастатических поражений. Примерно у трети впервые выявленных больных злокачественной опухолью почки на момент установления диагноза уже имеются метастазы вследствие повышенного метастатического потенциала рака почки [1–3 ]. На это также указывает тот факт, что прогрессирование заболевания в виде роста метастазов наблюдается после радикальной операции в 20–40% наблюдений [4, 5], что вынуждает почти в половине случаев назначать системную терапию [6]. У 30% пациентов после парциальной нефрэктомии выявляется рецидив [7].
Особенность таргетной терапии, основанной на антиангиогенном эффекте, заключается в хронизации активного онкопроцесса и достижении определенного контроля за ростом опухоли, что подразумевает длительное курсовое лечение, как следствие – неминуемые побочные эффекты проводимой системной терапии. [8]. Нежелательные побочные действия таргетных препаратов, обусловленные механизмом действия, разнообразны и затрагивают множество систем организма, в некоторых случаях могут быть фатальными [9].
Все вышесказанное подводит к мысли о создании нового метода хирургического лечения опухолей почки, направленного на ликвидацию даже малейшей возможности послеоперационного рецидивирования или прогрессирования метастатического распространения рака почки. Этот способ основан на механизме действия ингибитора эндотелиального фактора роста сосудов: ишемия опухолевой ткани в момент операции, сопровождающая резекцию почки, вызывает выработку эндотелиального фактора роста (Vascular endothelial growth factor – VEGF), который, поступая в магистральный кровоток по почечной вене, активизирует ангиогенез в предполагаемых метастатических узлах. Введение в артериальное русло почки в момент острой ишемии таргетного препарата бевацизумаб, известного своей антиангиогенной активностью путем необратимого связывания с рецепторами VEGF, обеспечит своевременную и целенаправленную защиту организма от патологической активации метастатических очагов. Выделяемый в процессе ишемии опухоли эндотелиальный фактор роста попадет в локальную ловушку таргетного препарата, вводимого в процессе ишемии, что предотвращает пусковой механизм метастатического прогрессирования. По существу предлагаемого способа получен патент Российиской Федерации на изобретение [10].
Материалы и методы. Исследование основано на прямом измерении концентрации эндотелиального фактора роста в ткани опухоли, в паренхиме почки перитуморозной зоны и в крови почечной вены в нативном состоянии, в процессе острой ишемии опухолевой ткани путем пережатия почечной артерии и после интраартериального введения препарата бевацизумаб в почечную артерию. Для достижения поставленной задачи отобрали 8 пациентов с опухолевидными образованиями почечной паренхимы по данным мультиспиральной компьютерной томографии, у которых выявлены солидные опухоли, активно накапливающие контрастное вещество размером от 24 до 48 мм, расположенные кортикально, без определяемого инструментальными методами диагностики метастатического распространения. Обращали внимание на отсутствие аберрантных сосудов почки для удобства создания ишемии почки и введения лекарственного препарата. Все пациенты дали письменное согласие на участие в научном исследовании, что подтверждено протоколом заседания Этического комитета федерального государственного автономного образовательного учреждения высшего профессионального образования «Северо-восточный федеральный университет им. М. К. Аммосова».

Дизайн исследования представлен на рис. 1. Всем больным выполнена открытая резекция опухоли почки люмботомным доступом: после выделения почки и ее сосудов из паранефрия и прилежащих тканей выполнялся отбор материала остроконечным скальпелем в обьеме 0,5 см3 путем клиновидного иссечения ткани в центре опухолевого образования, аналогичного иссечения паренхимы из перитуморозной зоны, прилежащей к псевдокапсуле опухоли, а также выполнялась пункционная аспирация венозной крови из почечной вены в шприц обьемом 10 мл. После получения нативного материала на почечную артерию и почечную вену раздельно накладывали сосудистые зажимы Сатинского. Спустя 5 мин после прекращения кровотока повторяли отбор лабораторного материала из опухоли, перитуморозной области и венозной крови путем пункции почечной вены, дистальнее уровня пережатия. Сразу после второй процедуры в просвет почечной артерии, дистальнее сосудистого зажима, через канюлю вводили раствор таргетного препарата бевацизумаб в количестве 2,5 мг, разведенного в 10 мл физиологического раствора, заполнив таким образом сосудистое русло почки раствором препарата. Спустя 5 мин. после введения раствора таргетного препарата приступали к основному этапу операции – резекции опухоли почки холодными ножницами в пределах здоровой ткани, отступя от края опухоли на 5 мм. Лабораторный материал получали из операционного материала – резецированной и удаленной опухоли, путем иссечения фрагмента опухоли и перитуморозной паренхимы почки в объеме 0,5 см3. Кровь из почечной вены забирали путем пункции и аспирации последней дистальнее уровня перекрытия кровотока. После ушивания почечной раны восстанавливали кровоснабжение почки снятием зажимов, время ишемии во всех случаях не превышало 20 мин. Полученные лабораторные материалы помещали в маркированные пробирки и отправляли в лабораторию без какой-либо фиксации для гистологического исследования. Операция завершалась ушиванием операционной раны стандартным способом.
Определение уровня VEGF производили методом иммуноферментного анализа набором HEA143Hu (Cloud-Clone Corp., США). Полученные образцы немедленно подвергали пробоподготовке. Сепарацию сыворотки производили в центрифуге с охлаждением при следующих условиях: ускорение – 1000G, длительность центрифугирования – 20 мин, температура – 4°С. Полученную сыворотку подвергали анализу немедленно либо хранили при температуре -20°С не более 7 сут.
Образцы тканей предварительно промывали в охлажденном фосфатно-солевом буфере (Invitrogen, США), помещали в лизис-буфер IS007 (Cloud-Clone Corp., США) и измельчали в стеклянном гомогенизаторе на льду. Полученная суспензия подвергалась обработке ультразвуковым гомогенизатором Qsonica Q125 (Qsonica, США) с амплитудой 50% длительностью импульса 5 мин, паузой 5 мин и длительностью обработки 10 мин. Во избежание перегрева образец держали на льду. После ультразвуковой обработки гомогенизат центрифугировали в течение 5 мин с ускорением 1000 G при температуре 4°С. Супернатант подвергали анализу немедленно или хранили при -20 °С не более 7 сут.
Иммуноферментный анализ проводился в соответствии с инструкцией производителя. Регистрацию результатов выполняли на планшетном фотометре SLT Spectra II (Tecan, США), экспериментальные данные обрабатывали при помощи программного обеспечения MultiCalc (Wallac, Финляндия).
Полученные в результате проведенных исследований данные анализировали с помощью программ статистических пакетов SPSS (Windows, версия 7.5.2). Достоверность различий между количественными показателями оценивали по критерию Стьюдента t для нормально распределенных величин. Различия признавали значимыми при p<0,03. Результаты и обсуждение. Во всех случаях гистологическое исследование выявило светлоклеточный вид почечноклеточного рака с отрицательным хирургическим краем резекции.

Концентрация эндотелиального фактора роста в изъятых образцах тканей представлена в табл. 1. Динамика изменения концентрации VEGF в исследуемых препаратах в процессе эксперимента наглядно продемонстрирована на рис. 2. Концентрация фактора роста в нативном состоянии находится примерно на одном уровне в ткани самой опухоли, в ткани почки, прилежащей к опухоли, и в венозной крови, полученной из почечной вены. Внезапное прекращение артериального кровотока в органе в результате пережатия почечной артерии вызывает резкий выброс VEGF опухолевыми клетками, при этом регистрируется неравномерный подъем уровня ростового фактора: наиболее значимо изменение концентрации в венозной крови более чем в 3,5 раза (255,35%), в ткани опухоли повышение VEGF почти в 3 раза (на 182,08%) и в паренхиме перитуморозной зоны зарегистрирован наименьший подъем – на 66,97%, что связано с прекращением кровотока в почке и диффузией выделяющегося опухолевой массой вещества в прилежащую паренхиму. Введение в артериальное русло обескровленной почки таргетного препарата бевацизумаб приводит к связыванию эндотелиального фактора роста сосудов, что проявляется резким снижением концентрации VEGF в исследуемых тканях и средах: самое активное связывание происходит в почечной вене – снижение концентрации почти в 7 раз (85,35%), в ткани опухоли отмечается понижение на 24,67% и самый незначительный спад зафиксирован в ткани, прилежащей к опухоли, – на 6,08%.
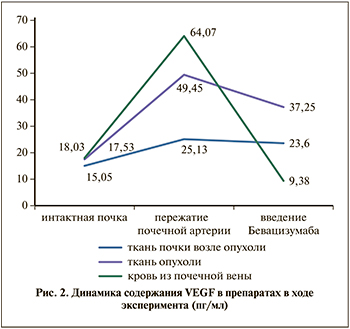
Полученные данные достоверно отражают триггерные явления процесса онконеоангиогенеза – внезапное прекращение питания опухолевой массы тотчас же запускает механизм образования новых опухолевых сосудов, спустя 5 мин после начала гипоксии опухоль выделяет вещества, направленные на восстановление кровоснабжения в количестве, в 3–3,5 раза превышающем первоначальные цифры. Различные состояния, сопровождающиеся гипоксией раковой опухоли (фиброз в исходе хронического воспаления, атеросклероз сосудов, гипертоническая болезнь, сахарный диабет, травматические повреждения и пр.), приводят к незамедлительному выбросу активаторов неоангиогенеза, как следствие – к росту опухоли. В трети случаев органосохраняющих операций эта лавина ростового фактора, выброшенная опухолью в процессе операции, расходится по организму и запускает рост метастазов. Возможно, этим объясняется активный рост метастазов в послеоперационном периоде.
Локальное и прицельное введение таргетного препарата, нейтрализующего эндотелиальный фактор роста сосудов в артериальное русло в момент прекращения кровотока, служит ловушкой для VEGF, попадая в который, фактор роста не сможет реализовать свой вредоносный эффект. Технически это возможно осуществить следующим приемом. В условиях гибридной рентген-операционной выполняется селективная почечная ангиография, при которой определяется сегментарная артерия, питающая участок почки с злокачественной опухолью. В указанную ветвь почечной артерии устанавливается баллон для коронарной ангиопластики соответствующего диаметра, достаточного для надежного внутрипросветного перекрытия артериального кровотока с центральным каналом для введения растворов в ишемизированный сегмент (рис. 3). Тотчас же после раздувания баллона установленного катетера через центральный канал в артерию почечного сегмента вводится таргетный препарат бевацизумаб в количестве, необходимом для надежного связывания выделяющегося ростового фактора (рис. 4). Сразу после введения таргетного препарата выполняется резекция почки лапароскопическим, роботическим или иным доступом, принятым в клинике (рис. 5). По завершении основного хирургического приема – резекции почки и ушивания раны паренхимы, коронарный баллон сдувается и запускается кровоток в ишемизированный сегмент почки (рис. 6).
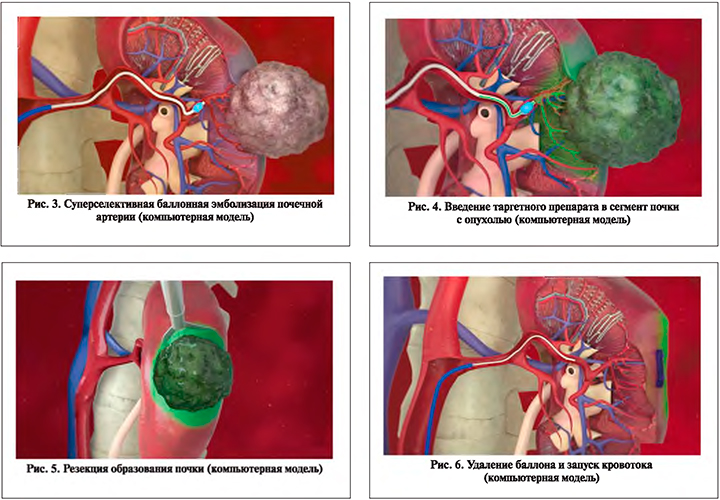
Применение суперселективной баллонной эмболизации почечной артерии, дополненной прицельной таргетной химиоэмболизацией, обеспечивает надежный интраоперационный гемостаз с нулевой ишемией почки. Локальное и прицельное введение небольшого количества таргетного препарата в ишемизированный сегмент почки с опухолью связывает и инактивирует выделяющийся в результате гипоксии эндотелиальный фактор роста сосудов и не оказывает токсического действия на весь организм ввиду небольшого количества введенного препарата.
Послеоперационное состояние всех пациентов не внушало опасений, в связи с чем все были выписаны домой в установленные сроки. Контрольные исследования анализов крови, мочи и биохимических параметров сыворотки крови, ультразвуковое сканирование оперированного органа не показали каких либо значимых отклонений от нормы.
Заключение. Острая гипоксия опухолевой ткани немедленно запускает процесс образования эндотелиального фактора роста, что проявляется кратным повышением уровня последнего в тканях опухоли и в венозной крови. Этот факт может служить триггером для ускоренного роста метастазов в послеоперационном периоде, ухудшая прогноз. Своевременное и локально-прицельное введение таргетного препарата – ингибитора ростового фактора, заблокирует взведенный курок и не даст взорваться метастазам рака почки. Таким образом, дополнение органосохраняющей операции при раке почки интраоперационной таргетной химиоэмболизацией ингибиторами ангиогенеза может создать дополнительную противорецидивную и противометастатическую защиту путем инактивации эндотелиального фактора роста сосудов, массивный выброс которого происходит при острой ишемии опухолевой ткани в момент операции.



