Актуальность исследования
Распространенность рака мочевого пузыря в России за последние 10 лет выросла с 49,6 до 74,1 больного на 100 тыс. населения. По росту первичной заболеваемости среди онкоурологических заболеваний рак мочевого пузыря занимает 3-е место после рака простаты и рака почки [1]. Согласно данным мировой статистики по первичной заболеваемости и смертности среди онкоурологических заболеваний, рак мочевого пузыря занимает 2-е место после рака простаты [2].
Одним из тяжелых осложнений и частой причиной летальности при поздних стадиях рака мочевого пузыря служит тотальная макрогематурия. Некупируемая макрогематурия встречается примерно у 10% пациентов [3–6]. Консервативные методы гемостаза не всегда позволяют достигать стойкого эффекта. При некупируемом кровотечении пациенту показано оперативное лечение. Наиболее широкое распространение в данном случае имеют эндоскопические коагуляционные методики, лигирование внутренних подвздошных артерий, а также открытые хирургические вмешательства вплоть до цистэктомии [7, 8].
Между тем стандартные трансуретральные методы гемостаза не лишены недостатков. Трансуретральная электрохирургическая резекция мочевого пузыря и коагуляция кровоточащих сосудов в условиях плохой визуализации из-за продолжающегося кровотечения могут быть причиной массы осложнений вплоть до перфорации мочевого пузыря и в обязательном порядке требует анестезиологического пособия. Лапароскопическое или открытое лигирование внутренней подвздошной артерии и ее ветвей также требует общего наркоза, не всегда бывает достаточно эффективным и делает невозможным выполнение в последующем эндоваскулярного гемостаза. Ретгеноэндоваскулярная эмболизация передней порции внутренней подвздошной артерии не имеет противопоказаний по анестезиологическому риску, однако ввиду недостаточной селективности зачастую неэффективна и связана с ишемией органов малого таза. Предпочтительным минимально-инвазивным хирургическим методом гемостаза для пациентов группы высокого анестезиологического риска с продолжающимся кровотечением из опухоли мочевого пузыря считается суперселективная эмболизация артерий [9].
Обзор литературы
Технологический прогресс позволил существенно расширить возможности рентгеноэндоваскулярной хирургии, которую стали использовать как метод не только диагностики, но и лечения, одним из вариантов которого служит рентгеноэндоваскулярная эмболизация артерий. Впервые в мире эту методику применил R. H. M. Dawbarn в 1904 г. [10] при злокачественной опухоли наружной сонной артерии.
В качестве эмболизационного материала была использована смесь парафина и вазелина. Родоначальниками применения рентгеноэндоваскулярной эмболизации в урологии стали А. F. Lalli et al. [11], в 1969 г. впервые экспериментально выполнившие эмболизацию почечной артерии. В 1973 г. L. E. Almgard et al. [12] впервые применили данную методику в клинической практике. Эмболизационным материалом послужила гомогенизированная аутомыщца. В 1979 г. E. K. Lang et al. [13] сообщили об успешном выполнении билатеральной эмболизации передней порции внутренней подвздошной артерии 14 пациентам с тотальной макрогематурией. В России первопроходцами в области эндоваскулярной эмболизации в урологии стали А. М. Гранов (1979) [14], Н. А. Лопаткин (1982) [15], В. С. Рябинский (1985) [16], применившие данную технику для эндоваскулярной окклюзии почечной артерии. Эмболизация для остановки кровотечения из артерий мочевого пузыря впервые была применена T. D. Schuhrke et al. в 1976 г. [17]. В нашей стране подобный опыт в 1985 г. впервые представили А. М. Гранов и соавт. [18], успешно выполнившие эмболизацию передней порции внутренней подвздошной артерии 30 пациентам с продолжающимся кровотечением из опухоли мочевого пузыря. Опыт успешного выполнения рентгеноэндоваскулярной суперселективной эмболизации артерий мочевого пузыря (ССЭАМП) 80 пациентам с некупируемой макрогематурией в 2013 г. представили А. М. Тибилов и соавт. [19]. Стойкий гемостаз в отсутствие повторных эпизодов макрогематурии был достигнут 95% пациентов.
Для выполнения эффективной окклюзии сосудистого русла принципиальное значение имеют пред- и интраоперационная ангиографии, при которых определяются ангиоархитектоника малого таза, последовательность выполнения процедуры.
Кровоснабжение мочевого пузыря осуществляется из нескольких источников. Нижняя пузырная артерия – ветвь внутренней подвздошной артерии, обычно отходит от переднего ее отдела вместе со средней ректальной артерией и питает большую часть мочевого пузыря, кроме верхушки. Она как может отходить общим стволом с верхней ягодичной и внутренней срамной артериями, так и быть ветвью внутренней срамной артерии. Верхняя ягодичная артерия посредством многочисленных ответвлений кровоснабжает верхушку мочевого пузыря и служит продолжением пупочной артерии (рис. 1) [20–23].

Процедуру обычно выполняют под местной анестезией с применением цифровой субтракционной ангиографии. Доступ осуществляют по Сельдингеру через бедренную артерию с одной или двух сторон с использованием катетера 5 или 6 Fr. Затем с помощью микрокатетера 5 Fr «Кобра» или катетера Симмонса выполняют селективную ангиографию внутренних подвздошных артерий для визуализации сосудистого рисунка малого таза. Пузырные артерии могут отходить в виде как отдельных ответвлений переднего отдела внутренней подвздошной артерии, так и ветвей из срамных артерий у мужчин и маточных артерий у женщин. Руководствуясь ангиографическими данными, полученными с помощью коаксиального микрокатетера 3 Fr, выполняют селективную катетеризацию пузырных ветвей. Для эмболизации дистальных отделов артерий применяют микроэмболы диаметром 300–500 мкм, для эмболизации проксимальных частей конечных артерий – эмболы 500–700 мкм. В случае выявления ангиографических признаков контрастной экстравазации дистальная эмболизация может быть выполнена с применением N-бутил-2-цианоакрилатного клея, который смешивают с ультражидким липиодолом в соотношении 1:3 для придания ему рентгеноконтрастных свойств. При невозможности селективной катетеризации пузырных артерий используют петлевую блокаду. Этот метод заключается во временной петлевой окклюзии дистальных ветвей переднего отдела внутренней подвздошной артерии с сохранением кровотока в пузырной артерии для выполнения селективной эмболизации, в то время как петля предохраняет пациента от нежелательной эмболизации дистальных ветвей внутренней подвздошной артерии. В данном случае используют спирали 0,018” или «сэндвич-терапию» платиновыми микроспиралями с эмболизационными частицами. Если основные ветви переднего отдела внутренней подвздошной артерии катетеризировать селективно нельзя, кончик катетера оставляют в переднем отделе внутренней подвздошной артерии, эмболизацию выполняют с применением 0,035” стальных спиралей типа Gianturco или абсорбируемой желатиновой губки, которые имплантируют в передний отдел внутренней подвздошной артерии вне зависимости от того, была ли обнаружена экстравазация контрастного препарата. При необходимости проводят эмболизацию сосудов противоположной стороны через ипсилатеральный или контралатеральный доступ.
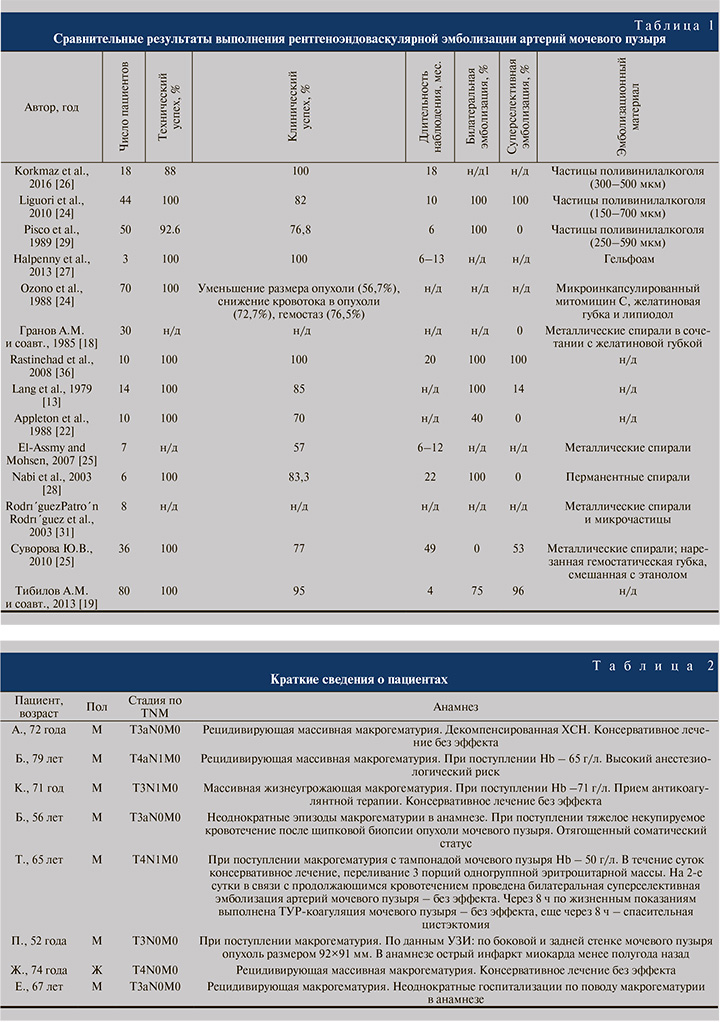
Единых объективных критериев успеха выполнения данного вида лечения не выработано, в связи с чем сравнительный анализ международной литературы затруднен. Некоторые авторы в качестве основных показателей эффективности гемостаза рассматривали отсутствие рецидива макрогематурии, констатируя результативность от 43 [24, 25] до 100% [26–28]. M. Korkmaz et al. [26] выделяют технический, краткосрочный клинический и долгосрочный клинический успех. Технический успех был достигнут в 88% случаев, в то время как краткосрочный клинический успех – в 100%, а долгосрочный – в 83% наблюдений.
J. M. Pisco et al. [29] разделили результат на «Полный ответ», «Частичный ответ» и «Отсутствие ответа» в зависимости от потребности в повторном переливании крови. S. Ozono et al. [30] классифицировали эффективность процедуры в соответствии с уменьшением размера опухоли (56,7%), снижением кровотока в опухоли (72,7%) и достижением гемостатического эффекта (76,5%). В одних исследованиях основное внимание уделялось необходимости переливания крови как основному показателю успешности выполнения процедуры [16], в то время как другие были ориентированы на уровень гемоглобина и гематокрита [26]. В работе D. Halpenny et al. [27] средняя потребность в переливании составила 8,6 единицы донорской эритроцитарной массы до эмболизации и 0,3 – после выполнения процедуры.
В исследовании [24] из 44 пациентов с выполненной эмболизацией артерий мочевого пузыря полный гемостаз был достигнут 36 (82%). В ходе дальнейшего наблюдения 5 (11%) пациентам потребовалась повторная эмболизация.
Несмотря на отсутствие единого мнения по поводу объективных критериев, при анализе литературы можно увидеть большую эффективность ССЭАМП по сравнению с эмболизацией передней порции внутренней подвздошной артерии (табл. 1).
Наиболее частым осложнением ССЭАМП считается постэмболизационный синдром, который включает субфебрильную температуру и боль в тазовой области; данное осложнение полностью купируется консервативно [24, 25]. Кроме того, встречаются острый тубулярный некроз, ассоциированный с нефротоксическим действием контрастного препарата [26], а также синдром Броун–Секара – поражение половины поперечника спинного мозга, проявляющееся параличом, утратой суставно-мышечной, вибрационной чувствительности на противоположной стороне.
Причиной развития синдрома Броун–Секара служит непреднамеренная эмболизация коллатералей между пузырными артериями и боковыми крестцовыми артериями [27].
В большинстве исследований не сообщалось о смертности пациентов в период наблюдения. G. Liguori et al. [24] сообщили о смертности в 6- и 12-месячный срок, которая составила 66 (29 пациентов) и 18% (8 пациентов) соответственно. В исследовании [31] умерли четыре из восьми пациентов: один из-за обострения интеркуррентного заболевания, остальные вследствие прогрессирования рака мочевого пузыря, при этом у трех пациентов на момент смерти макрогематурия была полностью купирована.
В настоящее время в связи с увеличением опыта, усовершенствованием техники выполнения и улучшением материально-технической базы частота рецидивов и осложнений значительно снизилась. В частности, A. El-Assmy et al. [25] успешно выполнили ССЭАМП семерым пациентам с рецидивом макрогематурии у троих из них в течение 6–12 мес., одному из них была проведена повторная эмболизация. А. М. Тибилов и соавт. [19] достигли стойкого гемостаза в результате ССЭАМП у 95% пациентов. В работе [28] одному из шести пациентов, перенесших билатеральную ССЭАМП, потребовалась повторная эмболизация. При последующем наблюдении в течение 22 мес. рецидива макрогематурии не было. C. Palma Ceppi et al. [32] выполнили ССЭАМП 6 пациентам с массивной макрогематурией, двоим из которых в течение недели потребовалась реэмболизация.
Выполнение ССЭАМП предпочтительно во всех случаях, когда это технически выполнимо, так как позволяет минимизировать возможные ишемические осложнения в бассейне внутренней подвздошной артерии. Частота осложнений при данной процедуре составляет в среднем 10% [33–35].
Собственный опыт
С 2016 г. в ГКБ № 31 восьмерым пациентам с диагнозом «рак мочевого пузыря» в стадии T3N0M0–T4аN1M0, осложнившимся рецидивирующим жизнеугрожающим кровотечением в связи с неэффективностью консервативного лечения и отягощенным соматическим статусом выполнена экстренная ССЭАМП (табл. 2). Средний возраст проперированных составил 67 лет. Все пациенты были госпитализированы по экстренным показаниям в связи с макрогематурией. Эмболизацию артерий мочевого пузыря выполняли на рентгеноскопической установке Toshiba MS INFINIX VC-i. Во всех случаях вмешательства проводили из трансфеморального доступа, для эмболизации использовали интродьюсеры диаметром 5 и 6 Fr. В качестве эмболизационного материала применяли желатиновую губку, микрочастицы 500–710 мкм, спирали Gianturco, а также их комбинацию по типу «сэндвич-терапия».
Экстренная билатеральная ССЭАМП проведена всем восьми пациентам. Семерыми достигнуты полный гемостаз, стабилизация показателей гемоглобина и гематокрита, необходимости в гемотрансфузии не было. Это позволило избежать нежелательной наркозной нагрузки и экстренных операций соматически отягощенным пациентам. Одному пациенту ввиду отсутствия эффекта от консервативного лечения и ССЭАМП, а также безуспешной попытки выполнения эндоскопического гемостаза по жизненным показаниям выполнена спасительная цистэктомия.
В послеоперационном периоде у одного из пациентов были отмечены явления постэмболизационного синдрома: гипертермия, дизурия, боль при дефекации и наличие прожилков крови в каловых массах. Вышеуказанная клиническая картина была полностью купирована на фоне терапии.
Приводим клиническое наблюдение успешного выполнения билатеральной ССЭАМП пациенту с рецидивирующей макрогематурией.
Пациент Б. 56 лет поступил экстренно с жалобами на обильную примесь крови в моче с бесформенными сгустками.
Из анамнеза известно, что первый эпизод макрогематурии пациент отметил 4 мес. назад. При амбулаторном обследовании выявлена опухоль мочевого пузыря. В день экстренного поступления пациент выписан из другого ЛПУ, где 2 сут. ранее была выполнена цистоскопия с щипковой биопсией опухоли мочевого пузыря.
Сопутствующие заболевания: ИБС; постинфарктный кардиосклероз; гипертоническая болезнь 3-й ст., III ст., риск сердечно-сосудистых осложнений – 4. По данным ЭхоКГ: фракция выброса левого желудочка, 28%.
При поступлении: Hb – 73 г/л, эритроциты – 2,83x1012/л.
В отделении урологии выполнено переливание двух порций свежезамороженной плазмы, двух порций эритроцитарной массы. Начата гемостатическая терапия препаратами транексамовой кислоты – без эффекта. В связи с отсутствием эффекта от консервативного лечения пациенту выполнена билатеральная ССЭАМП с применением частиц PVA диаметром 500–700 нм в сочетании со спиралями Gianturco (рис. 2).
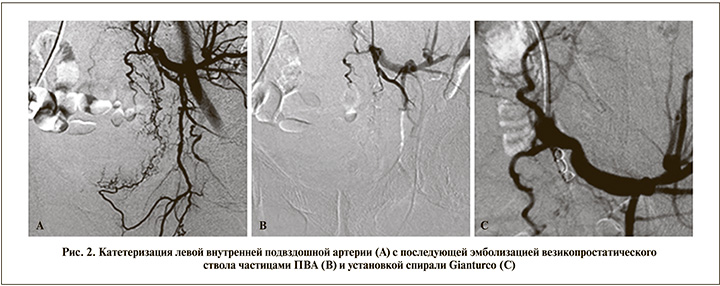
На фоне проведенного лечения макрогематурия была стойко купирована. Через 7 сут. после билатеральной ССЭАМП: гемоглобин – 120 г/л; эритроциты – 3,9x1012/л.
Выписан в удовлетворительном состоянии.
Данная тактика ведения позволила избежать экстренной органоуносящей операции и подготовить пациента к оперативному лечению. Пациент был переведен из группы ASA IV в группу ASA III, согласно шкале оценки физического статуса пациентов ASA (Американского общества анестезиологов).
Через 2 мес. в плановом порядке выполнено оперативное лечение в объеме цистпростатвезикулэктомии с реконструкцией ортотопического мочевого резервуара по Штудеру.
Одно из главных преимуществ ССЭАМП – отсутствие необходимости выполнения анестезиологического пособия. Применение данной методики гемостаза позволяет избежать экстренных операций соматически отягощенным пациентам, но при этом более эффективно и связано с меньшим числом осложнений, чем неселективные техники рентгеноэндоваскулярного гемостаза. Суперселективная эмболизация артерий мочевого пузыря – эффективный и безопасный малоинвазивный метод купирования макрогематурии при опухолях мочевого пузыря и должна рассматриваться как метод выбора для соматически отягощенных пациентов с некупируемой макрогематурией.



