Введение. В настоящее время радикальная цистэктомия (РЦ) с расширенной тазовой лимфодиссекцией и различными методами отведения мочи является основным методом оперативного лечения больных неметастатическим мышечно-инвазивным, рефрактерным к БЦЖ-терапии и высокого риска неинвазивным раком мочевого пузыря (РМП) [1]. До эры малоинвазивной хирургии РЦ выполнялась открытым доступом, была ассоциирована с высокой морбидностью и кровопотерей, значительным риском периоперационной смертности [2, 3]. За последние два десятилетия шло активное внедрение сначала лапароскопической РЦ, а затем и РАРЦ [4-7]. В связи преимуществами роботических систем перед стандартной лапароскопией, их широким распространением и использованием в хирургии органов малого таза РАРЦ в клиниках высокого объема РЦ постепенно становится альтернативой ОРЦ. Внедрение РАРЦ первоначально происходило медленно из-за высокой стоимости и длительности операции, отсутствия отдаленных функциональных и онкологических результатов. Однако со временем количество выполняемых РАРЦ в клиниках США и Европы постепенно росло [4–6, 8, 9]. По данным мультиинститутского исследования [8], в которое были включены результаты из 12 центров, за 2015–2018 гг. доля выполняемых РАРЦ стала превалировать над долей ОРЦ (54 и 46% соответственно). При внедрении РАРЦ наблюдались ее преимущества перед ОРЦ в виде меньшего числа периоперативных осложнений и кровопотери, коротких сроков пребывания в стационаре [9–12].
Роботические системы Да Винчи несомненно обеспечивают преимущества хирургу с точки зрения 10-кратного увеличения визуализации, получения 3D-изображений и улучшенной эргономики инструментов, что позволяет снижать объем кровопотери и сроки восстановления функции кишечника, сокращать сроки госпитализации. В последней публикации Международного концорциума по роботической хирургии (МКРХ) РМП сообщалось о результатах РАРЦ более чем у 3000 больных [13]. Вначале деривация мочи при РАРЦ в основном проводилась экстракорпоральным доступом, но последние 15 лет шло постепенное внедрение интракорпоральной методики [6, 13–17]. По данным A. A. Hussein et al. [13], доля интракорпоральных дериваций мочи (ИКДМ) в 2005 г. составила 9%, а через 10 лет – уже 97%. Однако увеличение показателя было обусловлено более частым выполнением илеокондуитов, тогда как число ортотопических резервуаров увеличилось лишь с 5 до 17%. В настоящее время ИКДМ внедряется во многих специализированных центрах, постепенно меняется отношение к отбору пациентов для РАРЦ. Так, за последние годы РАРЦ стали применять в отношении пожилых пациентов и при местнораспространенном РМП, что является причиной снижения числа пациентов, которым выполняется ортотопическая деривация мочи. Однако количество хирургов, использующих этот метод деривации мочи, постепенно увеличивается [5, 6, 14–17]. В связи с этим требуется проведение исследований, сравнивающих функциональные и онкологические результаты РЦ с ортотопической деривацией мочи, выполненных открытым и робот-ассистированным способами.
Цель исследования: сравнение периоперационных, функциональных и онкологических результатов ОРЦ и РАРЦ.
Материалы и методы. В Центре урологии Мариинской больницы с февраля 2019 по октябрь 2020 г. РАРЦ выполнена 25 больным. В контрольную группу были включены 30 пациентов, которым проводилась ОРЦ. Демографические данные пациентов обеих групп представлены в табл. 1. Показаниями к РЦ были мышечноинвазивный РМП без отдаленных метастазов (клиническая стадия – Т2–3N0M0). Критериями исключения для РАРЦ были наличие в анамнезе лучевой терапии и противопоказания к длительной операции в положении Тренделенбурга (тяжелая сердечно-легочная недостаточность, глаукома, аневризма головного мозга и тяжелая гипертензия). Предоперационное обследование включило лабораторные анализы, мультиспиральную компьютерную томографию легких и брюшной полости, магнитнорезонансную томографию малого таза с внутривенным контрастированием и остеосцинтиграфию. Также всем пациентам выполняли уретроцистоскопию для уточнения размеров и локализации опухоли, исключения поражения шейки МП и простатического отдела уретры, гистологической верификации образования. Всем больным проводилась ортотопическая илеоцистопластика, что позволило сделать сравниваемые группы более гомогенными. Неоадъювантная химиотерапия проводилась 12 (48,0%) и 14 (46,7%) пациентам в группах РАРЦ и ОРЦ соответственно. Не было значимых различий между группами по возрасту, ИМТ, частоте неоадъювантной химиотерапии и клиническим стадиям опухоли (во всех случаях p>0,05).

В обеих группах оценивали такие пред- и послеоперационные показатели, как время операции, объем кровопотери, количество интра- и послеоперационных осложнений, сроки госпитализации, количество пациентов с дневной и ночной континенцией. Отдельно определяли объем кровопотери при РЦ с тазовой лимфодиссекцией и кишечной деривацией мочи, а также продолжительность этих этапов операции. Осложнения оценивали по классификации Clavien–Dindo. В послеоперационном периоде проводилась инфузионная и антибактериальная терапия, профилактика тромбоэмболических осложнений. На 7-е сутки выполняли ретроградную цистограмму, при герметичности резервуара удаляли стенты и выписывали больных на амбулаторное лечение. После выписки пациенты находились под динамическим наблюдением, каждые 3, 6 и 12 мес. им проводились лабораторные анализы, ультразвуковое исследование органов брюшной полости и малого таза. Через 6 и 12 мес. после операции выполняли компьютерную томографию органов брюшной полости и малого таза для исключения местных рецидивов и отдаленных метастазов. При каждом посещении проводили опрос больных по поводу дневной и ночной континенции, количества используемых прокладок в день. Дневная континенция расценивалась как полное удержание мочи. Степень недержания мочи оценивали по следующей классификации: умеренной степени – при использовании 1–2 мужских прокладок в день, средней – 2–3 прокладок и тяжелой степени – более 3 прокладок. Ночная континенция расценивалась как полная (полностью сухой пациент, без использования прокладок), удовлетворительная (сухой пациент, но с 1 пробуждением ночью) и плохая (« влажный» пациент, подтекание мочи во время сна). В данном исследовании мы не изучали качество жизни больных и уродинамические показатели резервуара после РАРЦ и ОРЦ.
Хирургическая техника. В нашей клинике РАРЦ проводилась с использованием роботической системы Da Vinci Si. Все операции были выполнены одним хирургом, имевшим значительный опыт участия в операции в качестве ассистента и самостоятельного выполнения более 400 OРЦ. Кроме того, перед внедрением РАРЦ выполнено более 80 робот-ассистированных радикальных простатэктомий и 55 парциальных нефрэктомий. Все этапы РАРЦ выполнялись интракорпоральным доступом. Экстирпацию МП начинали с мобилизации мочеточников на протяжении нижней трети и пересечения их после клипирования. Далее с обеих сторон выделяли сосуды МП, клипировали их или пересекали с помощью Лигашу. Мобилизацию с боковых сторон МП продолжали до простаты и выделяли ее после вскрытия тазовой фасции. Затем МП с семенными пузырьками мобилизовали кпереди от прямой кишки, выделяли по передней поверхности, дорзальное сплетение прошивали и пересекали уретру после предварительного клипирования. Удаленный препарат помещали в эндомешок. Тазовую лимфодиссекцию начинали с выделения лимфоузлов по ходу запирательного нерва и подвздошных сосудов до бифуркации аорты. При РАРЦ и ОРЦ резецировали около 50 см подвздошной кишки, межкишечный анастомоз выполняли аппаратным швом. Интракорпоральную деривацию мочи осуществляли путем формирования модифицированного ортотопического илеорезервуара по Studer, мочеточники имплантировали в резервуар по Nesbit, дренировали их стентами. При ОРЦ нижнесрединным разрезом выполняли стандартную РЦ с тазовой лимфодиссекцией, далее ортотопическую илеоцистопластику по Studer.
Для оценки статистической значимости различий сравниваемых параметров использовали t-критерий Стьюдента для параметрических данных и критерий Манна–Уитни для непараметрических данных.
Результаты. Все операции в группе РАРЦ с интракорпоральной ортотопической илеоцистопластикой завершены без конверсии. Среднее время операции при РАРЦ составило 380, при ОРЦ – 260 мин. Объем кровопотери во время РАРЦ был достоверно больше, чем при ОРЦ (150/520 мл, р<0,05). При РАРЦ интраоперационная гемотрансфузия не проводилась, тогда как в группе OРЦ средний объем перелитой эритроцитарной массы составил 480 мл. Периоперативные показатели приведены табл. 2.

Ближайшие 30-дневные осложнения после РАРЦ наблюдались у 8 (32,0%) и при ОРЦ – у 12 (40,0%) пациентов (табл. 3). В связи с негерметичностью мочеточниковокишечного соустья двум больным выполнена пункционная нефростомия, третьему с несостоятельностью уретрорезервуарного анастомоза – перкутанное дренирование обеих почек. Эти осложнения наблюдались в числе первых пяти больных, подвергнутых РАРЦ с интракорпоральной илеоцистопластикой. Одному пациенту с желудочнокишечным кровотечением и снижением уровня гемоглобина потребовалась гемотрансфузия.
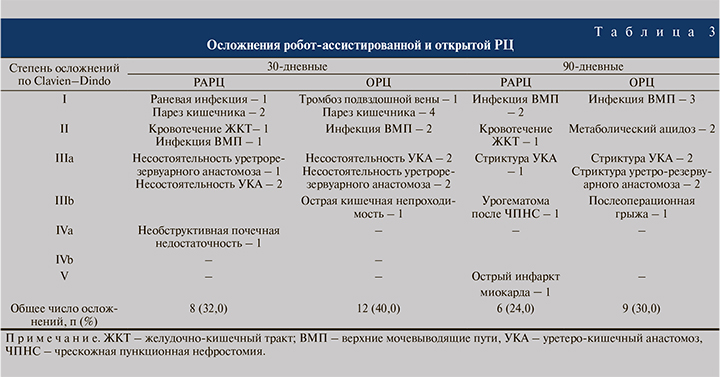
Поздние 90-дневные осложнения при РАРЦ имели место у 6 (24,0%), при ОРЦ – у 9 (30,0%) больных (табл. 3). В группе РАРЦ пациент 76 лет умер от острого инфаркта миокарда (Клавьен 5-й ст.), но при патогистологическом исследовании состояние резервуара и ВМП было удовлетворительным. После ОРЦ у 3 пациентов наблюдалась инфекция ВМП (2–1-й ст.), у 2 – метаболический ацидоз (2-й ст.), у 2 – гемотрансфузия, у 2 – стриктура уретерокишечного анастомоза (3а-степени). У 1 больного развилась послеоперационная грыжа, выполнена герниопластика.
Как видно из представленных в табл. 2 данных, большинству пациентов обеих групп по результатам патоморфологического исследования установлена стадия pT3. Ни в одном наблюдении не было отмечено положительного хирургического края (ПХК). Все пациенты перенесли расширенную тазовую лимфодиссекцию, только у одного пациента выявлены метастазы в лимфоузлы. Впоследствии у него выявлены метастазы в легкие. Случаев местного рецидива после РАРЦ за период наблюдения не было. При ОРЦ опухолевое поражение запирательных лимфоузлов имело место у двух больных. У одного из них в дальнейшем диагностирован местный рецидив. Средние сроки наблюдения после РАРЦ и ОРЦ составили 17,5 и 26 мес. За этот период безрецидивная и общая выживаемость составили 95,8/93,3% и 92,0/90,0% соответственно (p>0,05).
У 20 (80,0%) пациентов, перенесших РАРЦ, наблюдалось полное удержание мочи, остальные 5 (20,0%) использовали 1–2 прокладки в день. Ночная континенция установлена у 15 (60,0%) больных. После ОРЦ полная континенция была выявлена у 23 (76,7%) больных, 5 (20,0%) прооперированных использовали 1–2, 2 (6,7%) – 2–3 прокладки в день. Ночная континенция при ОРЦ констатирована у 17 (56,7%) человек.
Обсуждение. В настоящее время РАРЦ постепенно занимает свое место среди методов радикальной хирургии мышечно-инвазивного РМП. Среди преимуществ РАРЦ перед ОРЦ можно отметить низкую частоту периоперационных осложнений, меньшую кровопотерю и короткие сроки госпитализации. Однако в литературе встречаются противоречивые данные о количестве послеоперационных осложнений после РАРЦ и ОРЦ, в особенности высокой степени по Clavien–Dindo. Мультивариантный анализ показал, что возраст больных, их физический статус по классификации Американского общества анестезиологов, предоперационный гематокрит и продолжительность операции были независимым предиктором осложнений любой степени после РАРЦ [10, 11, 18–20]. На первые три из вышеперечисленных факторов можно влиять путем тщательного отбора пациентов, однако время операции при РАРЦ остается достаточно длительным по сравнению с ОРЦ, особенно для хирургов, находящихся на этапе освоения техники РАРЦ. По данным всех авторов, сравнивающих результаты РЦ, выполненной двумя доступами, время операции при РАРЦ всегда было достоверно больше, чем при ОРЦ [11, 12, 19, 20].
Перед выполнением РАРЦ мы имели опыт более 80 робот-ассистированных радикальных простатэктомий и достаточный опыт проведения ОРЦ [21]. Несмотря на это, продолжительность первых РАРЦ была существенной из-за непоследовательного выполнения основных этапов РЦ и кишечной деривации мочи. С накоплением опыта и усовершенствованием хирургической техники время операции постепенно снизилось с 560 до 320 мин, а количество осложнений – с 32 до 24%. Следовательно, укорочение времени операции в дальнейшем будет иметь решающее значение для снижения числа послеоперационных осложнений. Это определяет важность кривой обучения при роботизированной хирургии РМП [6, 14, 22, 23]. Так, 21 хирург из 14 различных институтов проанализировал время операции, объем кровопотери, количество удаленных лимфоузлов и частоту положительного хирургического края (ПХК) у 496 оперированных пациентов [22]. Результаты работы показали, что среднее время РАРЦ составило 441, 368 и 307 мин для тех хирургов, которые выполнили менее 30, 30–50 и более 50 РАРЦ соответственно (р<0,0001). В 2014 г. M. M. Desai et al. [6] сообщали о значимых улучшениях изучаемых параметров после первых 15 вмешательств. Так, среднее время операции уменьшилось с 527 до 375 мин (p<0,001), объем кровопотери – с 550 до 200 мл (p<0,001), сроки госпитализации – от 10 до 7 дней (p=0,028), частота осложнений – с 60 до 36% (p=0,057).
M. Honore et al. [23] сравнили результаты первых 50 РАРЦ с последующими 50 вмешательствами и отметили уменьшение времени операции с 420 до 330 мин (p<0,001). Одним из преимуществ РАРЦ является снижение общего объема кровопотери и необходимости в переливании крови. Так, по данным МКРХ, эти показатели составили 401 мл и 16% соответственно [13]. В систематическом обзоре результатов 668 операций [11] показано, что объем кровопотери (p<0,001), послеоперационная смертность и процент осложнений были значительно ниже в группе РАРЦ, чем при ОРЦ. В нашей работе средний объем кровопотери после РАРЦ и ОРЦ составил 150,0 и 520 мл соответственно (p<0,05), что показывает на ее снижение при РАРЦ. В рандомизированном исследовании по сравнению РАРЦ и ОРЦ установлено, что РАРЦ характеризуется достоверно меньшей кровопотерей (р<0,001) и частотой переливаний крови, короткими сроками пребывания в стационаре (р=0,02) и длительным временем операции (р<0,01) [9]. В обеих группах частота осложнений была одинаковой, однако деривация мочи после РАРЦ проводилась экстракорпоральным доступом. Частота 90-дневных осложнений при использовании экстраи интракорпорального доступов значимо не различалась, но при последнем наблюдается тенденция к снижению их количества (41 против 49%, р=0,059), в том числе желудочно-кишечных (10 против 23%, р<0,001), и гемотрансфузий (7 против 16%, р=0,02) [24]. Исследование МКРХ показало, что 48% пациентов имели осложнения через 90 дней после РАРЦ, из них 29% – низкой степени тяжести, 19% – высокой. Наиболее частыми среди них были осложнения со стороны желудочнокишечного тракта и мочеполовой системы [10]. В том же исследовании сообщалось о повторных госпитализациях, потребовавшихся в 13 и 20% случаев через 30 и 90 дней соответственно. В другом исследовании, сравнивававшем результаты ОРЦ и РАРЦ у 935 пациентов, не установлено достоверной разницы в частоте повторных госпитализаций в течение 30 дней после операции (24% при ОРЦ, 29% при РАРЦ, р=0,26) [25].
Онкологические результаты РЦ включает опухолевое поражение лимфатических узлов, наличие ПХК, безрецидивную, раковоспецифическую и общую выживаемость. Лимфодиссекция является важной частью РЦ, поскольку она позволяет точно определить стадию заболевания и обеспечить преимущества в выживаемости у пациентов с микрометастатическим процессом. Предыдущие исследования предполагали, что РАРЦ обеспечивает условия для удаления большего числа лимфатических узлов [25], что может быть объяснено хорошей визуализацией и широким маневрированием в глубоком малом тазу. Исследование RAZOR установило большее среднее количество лимфоузлов (23,3/25,7, р=0,13) соответственно [9]. Однако, по данным мультиинститутского исследования МКРХ, среднее число удаленных лимфоузлов при РАРЦ составило 16,37, тогда как, по данным Hautmann et al. [27], при 1100 ОРЦ оно было выше (до 1835). Положительный хирургический край связан с худшими результатами после РЦ. Z.
A. Dotan et al. [28] показали, что ПХК является независимым предиктором метастатического прогрессирования и указывает на повышенную вероятность смерти от РМП. Проспективные исследования D. J. Parekh et al. [9] продемонстрировали, что частота ПХК после РАРЦ и ОРЦ составила 3,6 и 4,8% (р=0,7), а по данным B. H. Bochner et al. [29], – 6 и 5% (р=0,59). Кроме того, у исследователей были опасения по поводу повышения числа местных рецидивов после РАРЦ из-за отсутствия тактильной обратной связи и, возможно, пневмоперитонеума [30, 31].
D. P. Nguyen et al. [31] предположили более высокую частоту поражения экстрапельвикальных лимфатических узлов и брюшинного карциноматоза после РАРЦ в ретроспективном сравнительном анализе 120 OРЦ и 263 РАРЦ. Однако наблюдаемые в этом исследовании различия не были статистически значимыми и РАРЦ была незначимым предиктором рецидива. Более позднее исследование показало, что местные рецидивы после РАРЦ обусловлены уже существующими микрометастатическими опухолевыми клонами, а не распространением опухоли после РАРЦ [32].
Радикальная цистэктомия является сложным вмешательством с определенной частотой смертностью. По данным исследования МКРХ, 30- и 90-дневная летальность составила 1 и 4% соответственно [10]. J. P. Stein et al. [2] сообщили о периоперационной смертности 3% при OРЦ, R. E. Hautmann et al. [27] о 3 и 5% смертности в течение 30 и 90 дней после ОРЦ. В рандомизированном исследовании по сравнению РАРЦ и ОРЦ 2-летняя общая выживаемость без прогрессирования составила 72,3 и 71,6% (р=0,001) для РАРЦ и OРЦ соответственно [9]. В другом подобном исследовании сообщалось о 5-летней безрецидивной выживаемости в 36 и 41% случаев после РАРЦ и OРЦ соответственно [29]. Многонациональное исследование МКРХ показало, что 10-летняя безрецидивная, раковоспецифическая и общая выживаемость после РАРЦ составила 59, 65 и 35% соответственно [33] и они были сопоставимы с аналогичными показателями ОРЦ [2, 27].
Функциональные результаты РАРЦ в некоторой степени занижены из-за отсутствия стандартизированного определения понятий континенции или потенции [19]. Они являются наиболее значимыми показателями качества жизни больных после РАРЦ с ортотопической деривацией мочи. В нескольких ретроспективных исследованиях сообщалось о высокой частоте континенции после РАРЦ и формирования необладера [15]. Так, после РАРЦ с интракорпоральной ортотопической цистопластикой по Studer дневное удержание мочи через 12 мес. колебалось от 66 до 88%, ночное – от 65 до 73%. При этом наблюдалась более высокая частота континенции у мужчин, перенесших нервосберегающую РАРЦ.
Радикальная цистэктомия с различными методами деривации мочи также активно выполняется отечественными урологами, которые указывают на ее высокую морбидность [21, 34–36]. При данной операции большинство хирургов продолжают использовать открытый доступ. В литературе встречаются публикации о результатах лапароскопической РЦ и сравнительном анализе ее результатов с открытой РЦ [36 – 38]. Активное внедрение лапароскопической РЦ можно объяснить с повсеместной доступностью оборудований для эндовидеохирургических вмешательств и накоплением опыта малоинвазивных урологических операций. За последнее десятилетие в отечественной литературе стали появляться публикации о результатах РЦ с использованием роботической системы Да Винчи [16, 17, 38–42]. Однако авторами нередко описаны единичные клинические наблюдения [39, 41]. Д. А. Лахно и соавт. [40] в 2018 г. опубликовали результаты РАРЦ у 20 пациентов, пятерым из которых выполняли интракорпоральную цистопластику по Studer, 13 формировали илеокондуит, двоим – билатеральную уретерокутанеостомию. Тридцатидневные осложнения наблюдались у 7 (35%) больных, у 4 из которых развились осложнения по Клавьену-IIIb, потребовавших проведения лапаротомии. В отечественной литературе мы не обнаружили других публикаций о результатах РАРЦ с ортотопической цистопластикой, хотя некоторые известные роботические хирурги выполняют подобные операции. В настоящее время в России функционируют более 30 роботических систем Да Винчи, в том числе современные Xi-модификации. Всеми клиниками накоплен достаточный опыт в робот-ассистированной радикальной простатэктомии и резекции опухоли почки. Однако количества выполненных РАРЦ в нашей стране, в особенности с интракорпоральной цистопластикой, недостаточно на такое число роботов Да Винчи. На наш взгляд, это связано с несколькими объективными причинами. РЦ любым доступом остается сложной операцией с высокой морбидностью, она требует определенного опыта в радикальном лечении рака мочевого пузыря, слаженной работы хирургической бригады, тщательного ведения больных в послеоперационном периоде, своевременной диагностики развившихся осложнений и их ликвидации. Наличие опыта в открытой РЦ позволяет урологу, начавшему оперировать роботом Да Винчи, быстрее преодолевать психологический барьер и раньше начинать выполнение РАРЦ. В нашей клинике до внедрения РАРЦ уже был опыт более 350 РЦ с ортотопической цистопластикой [21]. Поэтому с появлением в Мариинской больнице робота Да Винчи и быстрым освоением его за счет выполняемых радикальных простатэктомий мы начали использовать роботический доступ при РЦ. Лимитированное число произведенных РАРЦ, в том числе в нашем Центре урологии, может быть связано со сложившейся маршрутизацией онкоурологических больных, которые в основном направляются в онкологические стационары. Поэтому больные, которым показана РАРЦ, в ограниченном количестве поступают в неонкологические клиники, в которых чаще имеются роботические системы Да Винчи. Несмотря на существующие проблемы, отечественным роботическим хирургам необходимо активно выполнять РАРЦ с различными методами деривации, проводить межклинические и сравнительные исследования.
Заключение. РАРЦ с интракорпоральной деривацией мочи является малоинвазивным методом хирургического лечения больных мышечно-инвазивным РМП. Для данного хирургического вмешательства по сравнению с ОРЦ характерно достоверно меньшее число периоперационных осложнений и гемотрансфузий, но длительное время операции. Оба вида вмешательства обеспечивают идентичные онкологические и функциональные результаты, сопоставимые с данными литературы. Для улучшения функциональных и онкологических результатов РАРЦ необходимо регулярное выполнение данного вмешательства и проведение дальнейших сравнительных исследований с ОРЦ.



