В 2017 г. в России зарегистрировано 23 764 случая злокачественных новообразований почки. В 84,8% диагноз подтвержден морфологически. Первая стадия заболевания выявлена у 47,9% вновь зарегистрированных пациентов. Наибольшее количество выявленных злокачественных новообразований почки пришлось на Центральный, Приволжский федеральные округа (5980 и 5219 случаев соответственно). Удельный вес злокачественных новообразований почки, лечение которых выполнено радикально только хирургическим методом, составил 93,1% [1].
В настоящее время резекция почки как органосохраняющий метод служит стандартом лечения злокачественного новообразования почки стадии T1 [2].
Противопоказания к резекции почки:
- недостаточный для адекватного выполнения функции объем оставшейся паренхимы почки;
- тромбоз почечной вены;
- неблагоприятная локализация опухоли, включая спаянность с почечными сосудами;
- прием антикоагулянтов.
В отсутствие противопоказаний выбор минимально инвазивной техники операции обусловлен теми преимуществами, которые дает стандартная или робот-ассистированная лапароскопическая операция. К ним относятся уменьшение объема кровопотери, продолжительности госпитализации; быстрое восстановление после операции; хорошие косметические результаты; отсутствие осложнений, характерных для люмботомии.
Роботическая хирургическая система – интуитивно удобная платформа для выполнения минимально инвазивной резекции почки. Данная хирургическая техника продолжает динамически развиваться и становится все более популярной среди хирургов-урологов, выполняющих роботические операции. Так, в 2008 г. робот-ассистированная лапароскопическая резекция почки стала наиболее быстро набирающей популярность роботизированной операцией среди всех хирургических специальностей [3].
К одним из преимуществ робот-ассистированной нефронсберегающей операции, позволяющим ей занять определенную нишу, относится более короткая кривая обучаемости, измеряемая примерно 25 случаями, тогда как для лапароскопической резекции почки данный объем существенно больше и составляет минимум 200 операций [4–6]. Урологи могут также отдавать предпочтение роботизированным операциям в связи с рядом относительных технических преимуществ [4] и меньшим по сравнению с лапароскопической резекцией количеством осложнений [7].
Результаты первой серии робот-ассистированных резекций почки, выполненных в клинике Мэйо, были опубликованы в 2004 г. группой авторов во главе с M. T. Gettman [8]. За период с 2002 по 2003 г. исследователями было выполнено 13 подобных оперативных вмешательств. Технические аспекты проведенных 15 лет назад операций все же значительно отличаются от современной рутинной практики центров роботической хирургии. Так, например, 8 из 13 пациентам был установлен артериальный катетер с целью создания условий холодовой ишемии почки.
В современной практике данный метод не получил распространения.
В настоящее время в литературе описано три основных, различающихся по доступу вида робот-ассистированных лапароскопических резекций почки:
- трансперитонеальная робот-ассистированная лапароскопическая резекция почки;
- ретроперитонеальная робот-ассистированная лапароскопическая резекция почки [9];
- робот-ассистированная лапароскопическая однопортовая резекция почки [10];
Остановимся на технических аспектах выполнения традиционной роботизированной операции трансперитонеальным доступом.
Хирургическая техника
Инструменты и оборудование
В настоящее время в мире используют несколько поколений хирургических роботических систем DaVinci: daVinciXi, daVinciSi, daVinciS и daVinci Standard Surgical System. Публикаций, касающихся выполнения серий резекций почки с использованием новейшей хирургической системы последнего поколения, крайне мало. По умолчанию мы будем описывать технические аспекты операции, выполненной с помощью роботической хирургической системы DaVinciSi, выпущенной в 2009 г.
Основные хирургические инструменты, необходимые для выполнения оперативного вмешательства: монополярные ножницы 8 мм EndoWrist, биполярный зажим Maryland 8 мм EndoWrist, иглодержатель 8 мм EndoWrist.
К главным особенностям роботических инструментов, обеспечивающих ряд преимуществ роботизированных операций, относятся 7 степеней свободы движения, угол движений рабочей части инструмента 90 градусов, интуитивное управление, контроль движений кончиками пальцев, редукция тремора.
Положение пациента на операционном столе – в модифицированной позиции на боку с углом наклона приблизительно 60°. Руку со стороны оперируемой почки располагают вдоль тела и мягко фиксируют, вторая рука отводится перпендикулярно операционному столу и фиксируется на специальной подставке для рук. Далее производится наклон ножной секции операционного стола для формирования наиболее оптимального хирургического доступа к почке, как при люмботомической позиции. Завершающим этапом укладки на операционном столе является фиксация пациента с помощью специальных ремней. В роботической хирургии важен также порядок расположения основных рабочих элементов, таких как наркозный аппарат, операционный стол, три составляющие части хирургической системы DaVinci относительно друг друга в зависимости от оперируемой стороны (рис. 1).
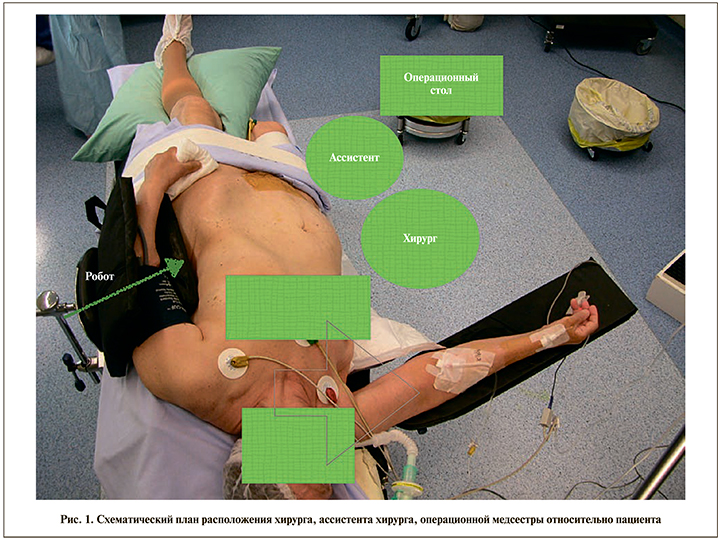
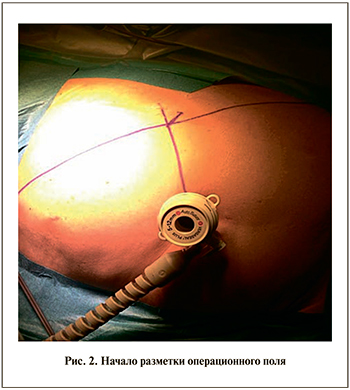 Предпочтение хирурга определяет количество используемых роботических манипуляторов – возможны конфигурации из трех или четырех рук. Использование минимальной конфигурации из трех рук позволяет наиболее эргономично расположить ассистентские и роботические порты и избежать «конфликта» движущихся манипуляторов роботической системы в условиях ограниченного пространства люмботомической позиции пациента. В то же время использование четвертого манипулятора обеспечивает дополнительные возможности для ретракции и контроля со стороны консольного хирурга. Для проведения инструментов ассистента устанавливают два троакара – 5 и 12 мм. Операцию начинают с установки параумбиликально троакара 12 мм с фиксирующим баллоном и последующим созданием пневмоперитонеума. В роботической хирургии необходимо уделять особое внимание разметке операционного поля и правильной расстановке троакаров. Разметку операционного поля осуществляют после создания пневмоперитонеума и начинают с проведения перпендикуляра от параумбиликального троакара к линии, соединяющей мечевидный отросток и переднюю ость подвздошной кости (рис. 2). Данная линия посредством поворота операционного стола (если его конструкция позволяет данный маневр) должна стать перпендикулярной траектории движения роботической системы. От точки пересечения двух линий влево и вправо откладывают два отрезка длиной 7–7,5 см. Такое расстояние должно быть между оптическим троакаром и троакарами для манипуляторов робота. На расстоянии 7–7,5 см от точки пересечения проводят линии, параллельные ранее проведенному перпендикуляру. На этих линиях и лежат точки-ориентиры для установки двух роботических троакаров 8 мм. При выборе постановки троакаров учитывают локализацию опухоли (рис. 3).
Предпочтение хирурга определяет количество используемых роботических манипуляторов – возможны конфигурации из трех или четырех рук. Использование минимальной конфигурации из трех рук позволяет наиболее эргономично расположить ассистентские и роботические порты и избежать «конфликта» движущихся манипуляторов роботической системы в условиях ограниченного пространства люмботомической позиции пациента. В то же время использование четвертого манипулятора обеспечивает дополнительные возможности для ретракции и контроля со стороны консольного хирурга. Для проведения инструментов ассистента устанавливают два троакара – 5 и 12 мм. Операцию начинают с установки параумбиликально троакара 12 мм с фиксирующим баллоном и последующим созданием пневмоперитонеума. В роботической хирургии необходимо уделять особое внимание разметке операционного поля и правильной расстановке троакаров. Разметку операционного поля осуществляют после создания пневмоперитонеума и начинают с проведения перпендикуляра от параумбиликального троакара к линии, соединяющей мечевидный отросток и переднюю ость подвздошной кости (рис. 2). Данная линия посредством поворота операционного стола (если его конструкция позволяет данный маневр) должна стать перпендикулярной траектории движения роботической системы. От точки пересечения двух линий влево и вправо откладывают два отрезка длиной 7–7,5 см. Такое расстояние должно быть между оптическим троакаром и троакарами для манипуляторов робота. На расстоянии 7–7,5 см от точки пересечения проводят линии, параллельные ранее проведенному перпендикуляру. На этих линиях и лежат точки-ориентиры для установки двух роботических троакаров 8 мм. При выборе постановки троакаров учитывают локализацию опухоли (рис. 3).
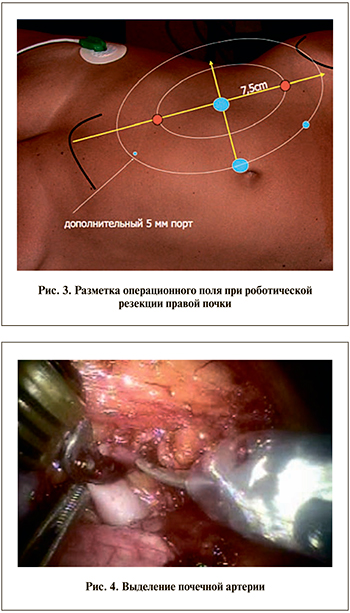 В нижнем квадранте операционного поля, расположенном в подвздошной области, устанавливают порт 5 мм для ассистента.
В нижнем квадранте операционного поля, расположенном в подвздошной области, устанавливают порт 5 мм для ассистента.
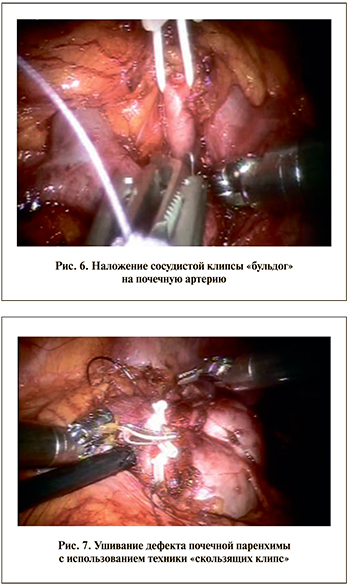
На первом этапе операции выделяют почечную вену, затем артерию, сосуды целесообразно взять на держалку (рис. 4). Технически проводить резиновую держалку безопаснее и удобнее с применением твердого атравматичного направителя, закрепленного на конце держалки.
В отсутствие готовой держалки с направителем возможна модификация обычной с использованием округлой части бобины для нити (рис. 5). Далее выделяют часть почки, где локализуется опухоль; при необходимости можно обозначить контур резекции браншей монополярных ножниц еще до наложения сосудистого зажима. Для создания тепловой ишемии почки на почечную артерию накладывают сосудистую клипсу «бульдог» (рис. 6). Достоверно доказано, что продолжительная тепловая ишемия неблагоприятно влияет на почечную паренхиму [11–13].
Согласно данным обзора литературы по вопросу интраоперационной ишемии почки [13], безопасный период тепловой ишемии ограничивается 20 мин. В настоящее время существует несколько техник, направленных на минимизацию вредного воздействия тепловой ишемии. Одна из них заключается в раннем снятии сосудистого зажима (early-unclamping). При этом зажим снимают после удаления опухоли и наложения первого ряда швов на дефект паренхимы. В работе, посвященной данной технике [14], авторы продемонстрировали уменьшение времени тепловой ишемии с 22,3 до 16,7 мин в когорте 430 пациентов (p<0,0001). При этом кровопотеря была больше в группе раннего снятия зажима (369 против 240 мл, p=0,001). Другая эволюционная техника, так называемая новая зеро-ишемия, подробно описана I. S. Gill et al. [15]. Она представляет собой селективную микродиссекцию ветви почечной артерии 3-го или 4-го порядка, кровоснабжающую непосредственно опухоль, в условиях интраоперационной контролируемой артериальной гипотензии.
Техника off-clamp, подразумевающая отказ от пережатия почечных сосудов, описана в исследовании Y. S. Tanagho et al. [16]. В данной работе были представлены результаты 29 робот-ассистированных резекций с традиционным пережатием почечных сосудов и 29 роботических резекций с применением техники off-clamp. Кровопотеря оказалась ожидаемо выше в группе off-clamp (146 против 104 мл, p=0,04), при этом в данной группе было также продемонстрировано меньшее снижение скорости клубочковой фильтрации (СКФ) по сравнению с группой тепловой ишемии (-4,9 мл/мин/1,73 м² против -11,7 мл/мин/1,73 м² , p=0,03). Тем не менее авторы данной работы подчеркивают отсутствие значимых различий в отношении сохранения почечной функции при сравнении результатов двух групп, что подчеркивает ограниченную роль данной техники в клинической практике.

 Следующим после резекции опухоли этапом операции является ушивание дефекта почечной паренхимы – реноррафия (рис. 7). В настоящее время общепринята техника так называемой sliding-clip renorraphy (ушивание с использованием скользящих клипс), разработанная в Вашингтонском университете и заключающаяся в использовании пластиковых клипс Hem-o-Lock, которые помещаются на нить и за счет скольжения перемещаются хирургом вплотную к паренхиме, создавая дополнительное давление на ткань и предотвращая прорезывание шовного материала. Данная техника подробно описана в статье B. M. Benway et al. [17]. Шовный материал для реноррафии вначале готовят на «черном» столе. На конце 15 см полиглактиновой нити 0 или 1 завязывают узелок. Над узелком накладывают сначала клипсу LapraTy («Ethicon», США), затем клипсу Hem-o-Lock 10 мм («Teleflex», США).
Следующим после резекции опухоли этапом операции является ушивание дефекта почечной паренхимы – реноррафия (рис. 7). В настоящее время общепринята техника так называемой sliding-clip renorraphy (ушивание с использованием скользящих клипс), разработанная в Вашингтонском университете и заключающаяся в использовании пластиковых клипс Hem-o-Lock, которые помещаются на нить и за счет скольжения перемещаются хирургом вплотную к паренхиме, создавая дополнительное давление на ткань и предотвращая прорезывание шовного материала. Данная техника подробно описана в статье B. M. Benway et al. [17]. Шовный материал для реноррафии вначале готовят на «черном» столе. На конце 15 см полиглактиновой нити 0 или 1 завязывают узелок. Над узелком накладывают сначала клипсу LapraTy («Ethicon», США), затем клипсу Hem-o-Lock 10 мм («Teleflex», США).
В последние годы широкое распространение получила техника sliding-clip с использованием безузлового шовного материала V-Loc («Covidien», США). В 2011 г. J. Sammon совместно с группой исследователей опубликовали работу, продемонстрировавшую безопасность применения данного шовного материала для роботической реноррафии [18]. Авторы подчеркивают, что использование колючей нити не только безопасно и упрощает ушивание дефекта паренхимы, но и приводит к снижению продолжительности тепловой ишемии почки.
Результаты
Трифекта
В настоящее время существует немало работ, посвященных сравнению результатов лапароскопической и робот-ассистированной парциальной нефрэктомии. В 2015 г. был опубликован мета-анализ 23 работ, выполненный группой ученых во главе с J. E. Choi и включивший данные о 2240 пациентах [19]. В отношении таких параметров, как количество осложнений I–II и III–V степеней по Clavien–Dindo (p=0,62 и 0,78 соответственно), изменение уровня креатинина (p=0,65), продолжительность операции (p=0,35), объем кровопотери (p=0,76), позитивный хирургический край (p=0,75), авторы не обнаружили различий между двумя техниками выполнения резекции почки.
В то же время для группы роботизированной парциальной нефрэктомии был продемонстрирован меньший процент конверсий в открытую операцию (p=0,02) либо в радикальную нефрэктомию (p=0,0006). Также авторами были получены данные о меньшей продолжительности тепловой ишемии (p=0,005), меньшем изменении СКФ (p=0,03) и более короткой госпитализации (p=0,004) в случае робот-ассистированных операций. Несмотря на большой объем статей, подвергшихся тщательному анализу, на уровень доказательности данного обзора повлияло отсутствие рандомизированных исследований и довольно высокий уровень гетерогенности данных по тепловой ишемии, времени операции и кровопотери. Основным препятствием к систематизации данных послужил недостаток информации, касающейся нефрометрии и метода тепловой ишемии, так как, безусловно, и сложность опухоли, и техника использования сосудистого зажима влияют на исходы операции.
В последние годы результаты парциальной нефрэктомии принято оценивать с использованием концепции «трифекта» [20, 21], включающей такие параметры, как негативный хирургический край, сохранение почечной функции и урологические осложнения. В оригинальной статье, впервые описавшей термин «трифекта», A. J. Hung et al. [20] выделили четыре хронологические эры, ретроспективно распределив пациентов между этими временными отрезками. Первая эра открытия, охватившая временной промежуток с сентября 1999 по декабрь 2003 г., включила 139 пациентов, вторая, обозначенная как эра традиционного пережатия сосудистой ножки, длилась с января 2004 по декабрь 2006 г. (n=213), следующая за ней эра раннего снятия зажима закончилась в ноябре 2008 г. (n=104) и последняя, эра зеро-ишемии, завершилась в октябре 2011 г. (n=78).
При анализе полученных данных авторы выявили тенденцию к увеличению среднего размера опухоли (2,9; 2,8; 3,1 и 3,3 см для эры открытия, традиционного пережатия почечной ножки, раннего снятия зажима и зеро-ишемии соответственно, p=0,08). Тем не менее процент сохранения почечной функции оставался примерно одинаковым (89, 90, 90 и 88% соответственно, p=0,3). Для более поздних периодов было также характерно увеличение числа более сложных опухолей, в том числе размером более 4 см (p=0,03), расположенных центрально (p<0,009) либо в области ворот почки (p<0,0001). Авторы также отметили лучшие результаты сохранения почечной функции в более поздних хронологических когортах (p<0,0001). Наличие положительного хирургического края было нечастым явлением во всех группах, частота урологических послеоперационных осложнений имела тенденцию к снижению в более поздних сериях парциальных нефрэктомий (p=0,01). Соответствие исходов операции концепции «трифекты» более характерно для более поздних этапов освоения хирургической техники. Для периодов открытия, традиционного пережатия сосудистой ножки, раннего снятия зажима и зеро-ишемии результаты операции отвечали критериям «трифекты» в 45, 44, 62 и 68% соответственно (p=0,0002).
В другом мультицентровом исследовании [22] авторы продемонстрировали достижение «трифекты» в 70% случаев робот-ассистированных парциальных нефрэктомий и лишь в 33% случаев при выполнении лапароскопической резекции почки. Преимущество роботизированной операции также отражено в показателях средней продолжительности тепловой ишемии (18 против 26 мин), количества осложнений (16,2 против 25,9%), частоты позитивного хирургического края (3,2 против 9,7%).
Одним из недостатков крупных серий робот-ассистированных резекций почки служит отсутствие такого показателя, как нефрометрия, отражающего сложность удаления опухоли и позволяющего более точно оценить результаты исследования [23–27].
Онкологические результаты
В обзоре, представленном B. M. Benway et al. [28], в когорте, включившей более 1600 пациентов, выявлено только 7 (менее 1%) рецидивов рака почки. При этом кумулятивная доля позитивного хирургического края составила 2,7% [28]. Для сравнения: данный показатель для лапароскопической и открытой резекций почки, по данным [29], составил 2,9 и 1,3% соответственно.
Что касается отдаленных онкологических результатов, данные весьма ограничены в связи с относительно недавним внедрением роботизированной хирургии. Одним из самых актуальных исследований на данную тему является работа [30], опубликованная в 2018 г. и включившая анализ результатов лечения 110 пациентов с периодом наблюдения 64,4 мес. Пятилетняя общая выживаемость, онкоспецифическая выживаемость составили соответственно 94,9 и 96,8%.
Функциональные результаты
Как известно, выполнение радикальной нефрэктомии значительно повышает риск развития почечной недостаточности [31–33].
Первое международное многоцентровое исследование, опубликованное в 2010 г. [25] и включившее 183 пациента, не выявило значимого изменения СКФ через 26 мес. после выполнения робот-ассистированной резекции почки (82,2 мл/мин/1,73 м2 против 79,4 мл/мин/1,73 м2; p=0,74).
Следует также отметить, что функциональные результаты открытой резекции почки и традиционной робот-ассистированной операции с пережатием сосудистой ножки сопоставимы с точки зрения процентных изменений СКФ [34]. H. Zargar et al. [35] оценили результаты радионуклидного исследования почек с меркаптоацетилтриглицином у 99 пациентов, перенесших роботическую парциальную нефрэктомию. Было установлено, что средний процент сохранения общей СКФ и доля сохраненной функции ипсилатеральной почки составили 83,8 (75,2–94,1) % и 72,0 (60,3–81,0) % соответственно. В данном исследовании были выявлены следующие прогностические факторы сохранения функции ипсилатеральной почки: объем удаленной нормальной паренхимы, продолжительность тепловой ишемии более 30 мин, индекс массы тела и предоперационный уровень СКФ оперируемой почки.
К интересному заключению пришли R. K. Kumar et al. [36], проанализировав результаты выполнения роботизированной парциальной нефрэктомии у пациентов с хронической болезнью почек (ХБП). Было продемонстрировано, что снижение СКФ после операции у пациентов с ХБП было значимо меньше по сравнению с группой пациентов с нормальной базовой функцией почек.
В настоящее время появляются работы, оценивающие восстановление почечной функции в отдаленном (5 лет) послеоперационном периоде. J. H. Kim et al. [37] обнаружили, что пациенты, которым была выполнена роботическая резекция, в отдаленном периоде (60 мес.) имели лучшие показатели восстановления почечной функции, чем те, которые были подвергнуты лапароскопической парциальной нефрэктомии. Паттерн восстановления функции почек включал значительное снижение почечной функции через 3–9 мес., затем постепенное увеличение после достижения надира, т.е. минимального значения СКФ. В группе робот-ассистированной резекции почки надир составлял 91,2% от исходного уровня СКФ. Через 5 лет восстановление почечной функции достигло 95,2% от предоперационного уровня.
Осложнения
По данным исследований, представивших первые серии робот-ассистированных резекций почки, доля осложнений была высокой и составляла 20% [5]. В настоящее время процент осложнений с учетом выполнения резекции сложных, крупных опухолей остается примерно на том же уровне (8,6–20,0%) [38–40]. Анализ осложнений 450 роботических парциальных нефрэктомий, выполненных в нескольких ведущих центрах [41, 42], показал, что осложнения имели место у 71 (16%) пациента, из них у 8 интраоперационно и у 65 в послеоперационном периоде. По классификации Clavien–Dindo, в 54 случаях осложнения соответствовали I–II степеням и требовали только консервативного лечения, тогда как в 17 были охарактеризованы как осложнения III–IV степеней. Сопоставимые результаты получены в исследовании [43], представлявшем собой анализ 886 операций, выполненных в 5 центрах США. Так, общая частота осложнений составила 15,6%, из них 2,6% приходилось на долю интраоперационных осложнений. В 77% случаев осложнения соответствовали I–II степеням и в 23% – III или IV степени по классификации Clavien–Dindo. Обновленные данные по описанной работе были представлены 2 года спустя и включили уже 1838 пациентов [52]. Согласно полученным данным, показатель общей частоты осложнений остался на прежнем уровне и составил 17,2%, при этом доля осложнений I–II степеней также практически не изменилась – 72,5%.
Что же касается характера осложнений, авторами были описаны следующие виды. Геморрагические осложнения имели место у 71 (24,9%) пациента, осложнения, связанные с мочеполовой системой, – у 72 (25,2%), легочные – у 38 (12,4%), кардиоваскулярные – у 34 (11,1%), связанные с желудочно-кишечным трактом – у 26 (8,5%), инфекционные – у 22 (7,2%), другие виды осложнений – у 6,9%.
В 2,7% случаев потребовалось проведение гемотрансфузии, 10 (0,05%) пациентам выполнена ангиоэмболизация, 5 (0,2%) – хирургическая ревизия в связи с послеоперационным кровотечением. Такое осложнение, как мочевой затек, выявлено у 13 (0,7%) пациентов, у 10 (0,05%) прооперированных развилась острая почечная недостаточность.
Кровотечение
По данным литературы, необходимость в послеоперационной гемотрансфузии после роботизированной резекции почки возникает в 3–10% случаев, что сопоставимо с аналогичными показателями для лапароскопической и открытой резекций – 5,8 и 3,4% соответственно [44]. Кроме того, частота послеоперационных кровотечений относительно низкая (менее 5%) и примерно одинаковая для лапароскопической и робот-ассистированной операций, так же как и показатель необходимости проведения ангиоэмболизации (0,4%) [50, 51].
По данным исследования [38], посвященного результатам роботизированной и лапароскопической резекций почки, большая доля послеоперационных кровотечений связана с наличием псевдоаневризмы или артериовенозной фистулы сосудов почки, данные сосудистые мальформации могут приводить и к отсроченным кровотечениям через несколько недель после выписки.
Как было отмечено выше, надежными способами снижения риска развития кровотечения являются sliding-clip реноррафия и использование шовного материала с «колючей» нитью [17]. Использование специальных болстеров и герметиков в процессе ушивания ложа резекции не обязательно, но допустимо [45, 46].
Мочевой затек
В эпоху открытой резекции почки мочевой затек – самый распространенный видй осложнения, доля которого составляла 17,4% [47]. Минимально инвазивные операции позволили снизить данный показатель до 2,5% [48]. Низкая частота мочевых затеков (0,6%) описана в работе [49], включившей результаты 347 операций в рамках мультицентрового исследования.
Органосохраняющая операция при раке почки позволяет улучшать показатели сохранения почечной функции и имеет схожие с радикальной нефрэктомией результаты онкоспецифической выживаемости. Одним из преимуществ робот-ассистированной операции является повышение доступности минимально инвазивного метода в связи с более короткой кривой обучаемости и как следствие – расширением показаний к проведению резекции почки. Особая роль отведена различным инновационным модификациям робот-ассистированной парциальной нефрэктомии, которые делают данную операцию еще более привлекательным и удобным инструментом для помощи пациентам с локализованным раком почки. Однако в настоящее время не разработан единый стандартизированный метод выполнения данных операций. Необходимо дальнейшее совершенствование техники роботизированной операции, направленное на минимизацию продолжительности тепловой ишемии и максимальное достижение показателей «трифекты».



