Введение. В последние годы в мире во всех возрастных группах отмечается рост числа пациентов с опухолями паренхимы почки, а также увеличение выявляемости образований почки у больных в возрасте до 40 лет. По данным мировых исследователей, почечно-клеточный рак (ПКР) у таких пациентов наблюдается с частотой 3–7% [1–4]. Одной из причин такого роста наряду с совершенствованием визуализирующих методик диагностики, по мнению некоторых исследователей, является увеличение числа пациентов с наследственными формами ПКР [5–8]. Большинство таких пациентов имеют двустороннее множественное поражение паренхимы почки [6]. Результаты лечения и прогноза ПКР у молодых пациентов свидетельствуют о более агрессивном течении заболевания, имеющем более злокачественный биологический потенциал, в связи с чем больные указанной категории должны быть подвергнуты более пристальному динамическому контролю в послеоперационном периоде независимо от выполненного объема оперативного лечения [9–11].
Принимая во внимание данные факты, определение хирургической тактики лечения и динамический контроль за пациентами возрастной группы ≤40 лет является сложной задачей для врача-уролога. В связи с этим целью нашего исследования было оценить наличие различий морфологических результатов органосохраняющих операций пациентам с образованиями почки в возрасте ≤40 и> 40 лет и оценить прогноз в данных группах больных при верификации локализованного рака паренхимы почки.
Материалы и методы. Ретроспективно были проанализированы результаты 314 лапароскопических резекций почки (ЛРП) у пациентов с образованиями почки, выполненных в клинике урологии Первого МГМУ им. И. М. Сеченова за период с января 2012 по май 2017 г. Средний возраст больных составил 54,4±10,9 (25–78) года. Мужчин было 178 (56,7%), женщин — 136 (43,3%; табл. 1).

Всем пациентам в предоперационном периоде проведены стандартные физикальные и инструментальные обследования. Со стадией сТ1а прооперировано 196 (62,4%) пациентов, сТ1b – 88 (28%) и сТ3а – 30 (9,6%) пациентов. Во всех клинических наблюдениях диагностирован локализованный процесс без поражения регионарных лимфатических узлов и отдаленных метастазов.
Все операции выполнены из лапароскопического доступа (табл. 2).

Для достижения цели пациенты были разделены на две группы. В первую включены 37 (11,8%) больных в возрасте ≤40 лет, средний возраст – 34,25±5,4 (25–40) года, во вторую группу – 277 (88,2%) пациентов старше 40 лет, средний возраст – 57,61±9,2 (41–78) года. У пациентов до 40 лет при сборе анамнеза не было выявлено наследственной отягощенности по факту развития ПКР.
Морфологическое исследование осуществлено в патологогистологическом отделении Первого МГМУ им. И. М. Сеченова. Световая микроскопия проведена на микроскопах Jenamed-2, Jenaval-3 (Германия) с объективами ×3,2, ×16, ×20, ×40 и ×100, с окуляром ×16. Препараты окрашивали гематоксилином и эозином по общепринятой методике. Толщина срезов, выполненных на микротомах, составила 5–10 мкм.
Статистическая обработка полученных данных выполнена при помощи компьютерной программы IBM SPSS версии 22.0. Проверка распределения значений переменных проведена с использованием критериев Шапиро–Уилкса и Колмогорова–Смирнова. При подтверждении нормального распределения количественных переменных в исследуемых группах проверка статистической значимости различий проведена с помощью t-критерия Стьюдента для независимых выборок.
Статистическая значимость различий категориальных и порядковых признаков при парных сравнениях оценена с помощью критерия χ2 Пирсона с поправкой на непрерывность. При ожидаемой встречаемости признака 5 и менее в четырехпольных таблицах использован точный критерий Фишера. Различия между группами наблюдения считали статистически значимыми при р<0,05.
Для изучения выживаемости пациентов после оперативного лечения рака почки был применен метод анализа дожития Каплана–Мейера. При анализе выживаемости цензурированными считали случаи дожития пациентов до окончания 3-летнего (36-месячного) срока наблюдения в отсутствие признаков рецидива заболевания. По отдельности проведена оценка времени дожития до появления рецидива и смерти пациентов. В качестве нецензурированных случаев рассмотрен факт смерти или подтверждение рецидива опухоли до окончания периода наблюдения.
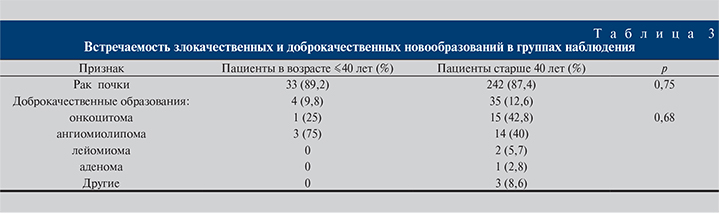
Результаты. У пациентов обеих групп чаще выявлялись злокачественные новообразования – в 89,2 и 87,4% наблюдений (табл. 3). Установлено, что группы не различались ни по встречаемости злокачественных новообразований (р=0,75), ни по частоте различных морфологических видов доброкачественных новообразований (р=0,68).
При сравнении частоты выявления различных морфологических форм злокачественных опухолей и степеней анаплазии установлено, что светлоклеточная форма ПКР несколько чаще встречалась в группе пациентов в возрасте ≤40 лет (31 [93,9%]) против 203 (82,9%) в группе старше 40 лет (табл. 4).

В большинстве случаев как в первой, так и во второй группе анаплазия соответствовала степени G2 (см. табл. 4), причем группы по встречаемости новообразований с различной степенью анаплазии также статистически значимо не различались (р=0,33).
Поскольку летальность составила 0,6% (2 человека в группе пациентов старше 40 лет), а количество рецидивов было равным 3 (1,1%), в целом доля цензурированных случаев среди 314 пациентов составила 99,4% для дожития без летальности и 98,9% для безрецидивного дожития. Точечная оценка дожития без летальности в общей группе пациентов по итогам 36-месячного наблюдения составила 35,77±0,16 мес. Для безрецидивного дожития средний показатель составил 35,47±0,24 мес. Различия по показателям выживаемости при разделении пациентов на группы в зависимости от возраста не носили статистически значимого характера ввиду отсутствия случаев рецидива и летальности в группе пациентов в возрасте ≤40 лет.
Обсуждение. Начиная с 1960-х гг. отмечается неуклонный рост числа вновь регистрируемых случаев ПКР, который достигает 62 тыс., и 89 тыс. случаев ежегодно в США и Европе соответственно [12]. В большинстве наблюдений образования почки в последние десятилетия выявляются случайно, имеют малый размер (до 4 см) и не имеют клинических проявлений [13–15]. Как правило, образования почки диагностируют у пациентов в возрасте от 50 до 69 лет [14–16].
В нашей работе средний возраст пациентов составил 54,4±10,9 (25–78) года. По данным мировых исследователей, ПКР в группе пациентов в возрасте ≤40 лет наблюдается с частотой 3–7% [1–4]. За обозначенный период наблюдений в нашем исследовании пациентов в возрасте ≤40 лет было 37 (11,8%), это больше, чем в среднем в мире. Вероятнее всего, данный факт связан с ростом заболеваемости ПКР в мире в целом и в России в частности.
Клинически пациенты в возрасте ≤40 лет не имели классической триады симптомов ПКР (боль, макрогематурия и пальпируемая опухоль), и образования почки у них были выявлены случайно при обследовании по поводу других заболеваний. Бессимптомное течение малых образований почки подтверждается многими научными публикациями [17–19]. Однако имеется и противоположная точка зрения, согласно которой молодые пациенты (моложе 40 лет) реже подвергаются лучевым методам обследования и проходят их только при появлении каких-либо симптомов по сравнению с пациентами старше 40 лет, которые чаще обследуются по поводу других заболеваний и у них выявляют образования почки случайно, что, по мнению авторов, необходимо интерпретировать как симптоматическое проявление ПКР у больных в возрасте ≤40 лет [1, 10, 20].
Согласно полученным нами результатам морфологического исследования удаленных образований почки, группы не различались по встречаемости доброкачественных и злокачественных новообразований (р=0,75), что согласуется с данными большинства работ [1, 2, 4]. При сравнении частоты выявления морфологических форм доброкачественных и злокачественных новообразований группы также не различались (р=0,25), что не соответствует результатам некоторых исследователей, которые отметили, что у пациентов в возрасте ≤40 лет гораздо чаще верифицируется папиллярная и хромофобная формы ПКР, чем у пациентов старшей возрастной группы [1, 11, 20]. Мы не установили факта более злокачественного течения образований почки у молодых больных с заболеваниями стадий N1 и M1, хотя имеются работы, в которых отмечено более злокачественное течение ПКР, особенно у пациентов старше 30 лет [4]. Возможно, это связано с тем, что нами были проанализированы пациенты, перенесшие ЛПР, и не включены пациенты, перенесшие органоуносящие оперативные вмешательства.
По степени анаплазии ядер опухолевых клеток в нашей работе в группе пациентов в возрасте ≤40 лет больше было наблюдений со степенью G1 и G3 – 10 (30,3%) и 4 (12,1%), чем в группе наблюдения старше 40 лет (53 [21,6%] и 20 [8,2%] соответственно) в отсутствие статистически значимых различий (р=0,33). В работах зарубежных авторов по данному вопросу представлены разноречивые данные. Так, G. Verhoest et al. [10] проведено многоцентровое европейское исследование с анализом результатов лечения 4774 пациентов с ПКР, больных в возрасте ≤40 лет было 288 (6%). При сравнении пациентов в возрасте ≤40 лет с пациентами группы старше 40 лет по степени дифференцировки ядер опухолевых клеток было больше пациентов со стадией G1, G2 – 191 (68%), чем в группе пациентов старше 40 лет, – 2727 (61%) (р<0,001) [10]. В другой работе [11] проведен анализ хирургического лечения 3568 пациентов в возрасте до 30 лет с ПКР. Было установлено, что в группе больных в возрасте от 0 до 20 лет было больше наблюдений ПКР с G3-4 по сравнению с пациентами от 21 года до 30 лет (р<0,0001). Вероятнее всего, данный факт связан и с тем, что пациенты моложе 20 лет чаще страдают саркомами различного генеза, имеющими высокий потенциал злокачественного течения [21, 22].
В настоящее время в мире насчитывается около 50 наследственных синдромов и заболеваний, связанных с развитием ПКР [19]. Несмотря на то что в нашем исследовании у пациентов в возрасте ≤40 лет не было установлено семейного анамнеза ПКР, мы полностью согласны с мнением авторов, согласно которым это не исключает наследственной природы образований почки у больных данной возрастной группы [5, 6, 23]. Также имеются работы, согласно которым наличие ПКР у пациента в возрасте до 46 лет служит показанием к проведению генетического исследования [6].
В нашей работе при прогнозе опухолеспецифической общей выживаемости анализ проведен за 3-летний период, при этом установлено, что в группе пациентов в возрасте ≤40 лет не было ни одного наблюдения рецидива ПКР и летального случая. Несмотря на то что различия между группами по прогнозу безрецидивной выживаемости не имели статистической значимости и они совпадают с большинством опубликованных мировых работ, в которых молодые пациенты имеют лучший прогноз безрецидивной и общей выживаемости [2, 6, 20, 24]. Считаем, что для более точного прогноза требуется проведение дальнейших исследований со сроком наблюдения в течение 5 и 10 лет.
Заключение. При определении хирургической тактики лечения пациентов с образованиями почки в возрасте ≤40 лет предпочтение необходимо отдавать органосохранным операциям. В послеоперационном периоде данным пациентам желательно проводить генетическое исследование для исключения наследственных форм течения ПКР, что несомненно может улучшить прогноз течения ПКР. Прооперированные пациенты в возрасте ≤40 лет должны находиться под динамическим наблюдением в связи с высоким риском возникновения ПКР в паренхиме почки другой локализации.



