Введение. Семейство герпесвирусов (Herpesviridae) объединяет пантропность к органам и тканям, пожизненная персистентность и способность вызывать многообразные манифестные формы заболевания. После внедрения вирусы герпеса персистируют в организме человека пожизненно в виде латентной инфекции и могут под влиянием ослабляющих факторов (грипп, СПИД и др.) реактивироваться с образованием новых вирусов, вызывая клинически выраженные формы болезни с развитием вторичной иммунологической недостаточности [1]. В процессе репликации вируса Эпштейна–Барр (ВЭБ) или вируса герпеса 4-го типа экспрессируется свыше 70 различных вирусспецифических белков, при этом к настоящему времени выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции: EA (еarly antigen) – ранний антиген, включает белки p54, p138; EBNA-1 (Epstein–Barr nuclear antigen) – ядерный антиген, белок p72; VCA (Viral capsid antigen) – капсидный антиген, включает комплекс белков p150, p18, p23; к настоящему времени показано, что иммунодоминантными белками в этом комплексе являются p18 и p23; LMP (Latent membrane protein) – латентный мембранный белок gp 125 [2–4]. Серологическая диагностика вирус-ассоциированных опухолей привлекает внимание многих специалистов [5–7]. Изначально первичная причинно-следственная связь между вирусом Эпштейна–Барр (ВЭБ) и лимфомой Беркитта подтверждена именно повышенным уровнем антител к антигенам ВЭБ, присутствующим у пациентов с лимфомой Беркитта [7]. Возможность ранней диагностики онкологических заболеваний, способность прогнозирования риска прогрессирования и рецидива опухолевого процесса, а также контроля излеченности по уровню противовирусных антител открывают перспективы использования неинвазивных и экономически выгодных методов как диагностики, так и контроля лечения вирус-ассоциированных неоплазм. Ранее в наших работах мы уже говорили о повышении уровня противовирусных антител у больных раком мочевого пузыря [9–11].
Цель исследования: оценить прогностическую значимость уровня противовирусных антител в развитии рецидива рака мочевого пузыря.
Материалы и методы. В пилотном исследовании проведено обследование и лечение 100 больных, страдающих раком мочевого пузыря (72 мужчины и 28 женщин) в возрасте от 38 до 90 лет (средний возраст – 65±10 лет). Интраоперационно выполнен забор ткани опухоли мочевого пузыря с целью выявления вирусов ВПГ 1-го и 2-го типов, вируса папилломы человека (ВПЧ) высокого онкогенного риска, цитомегалловируса (ЦМВ), ВЭБ. Определение вирусных ДНК осуществлено методом ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени. Исследование проведено полуавтоматическим способом с использованием ПЦР-детекторов CFX-96, Bio-Rad (США) и реактивов Вектор-Бест (Россия), верхний предел определения (с разведением) – 100 копий в пробе. Следует отметить, что из всех проанализированных в работе вирусов только ВПЧ высокого онкогенного риска и ВЭБ онкогенные. У всех пациентов определен уровень противовирусных антител иммуноферментным методом к ВПГ 1-го и 2-го типов, ЦМВ, ВЭБ. Материалом для иммуногистохимического исследования послужил биопсийный и операционный материалы от 32 пациентов с верифицированной опухолью мочевого пузыря. Из них у 21 больного выявлено наличие вирусных ДНК (ЦМВ, ВЭБ, ВПГ 1-го и 2-го типов, ВПЧ высокого онкогенного риска) в опухолевой ткани, в 11 случаях вирусных ДНК выявлено не было.
Операционный материал фиксировали в 1%-ном растворе нейтрального формалина и заливали в парафин. Срезы толщиной 5 мкм, окрашенные гематоксилином и эозином, были подвергнуты обзорному морфологическому анализу, при котором стадию рака определяли в соответствии с классификацией TNM, степень дифференцировки опухолевых клеток оценивали в соответствии с рекомендациями ВОЗ от 1973 г. Микроскопическое изучение препаратов проведено с применением бинокулярного микроскопа с фотоприставкой Axio Zeis при 400-кратном увеличении. Иммуногистохимическое исследование выполнено на серийных парафиновых срезах 5 мкм путем стрептавидинбиотинового метода. В качестве детекционной системы использовано 6 маркеров. Определены следующие показатели: маркер пролиферативной активности Ki67 (sp6), маркер супрессора опухолевого роста Bcl-2 (D07), p53 (124), маркер ангиогенеза CD31 (sp164), маркер адгезии CD44 (spm521), ростовой фактор EGFR (sp84) (Spring Bioscience).
Интенсивность реакций с антигенами, локализованными на мембранах клеток и внутриклеточных мембранах (CD44, CD31, EFGR и Bcl-2), оценена полуколичественным способом по балльной шкале от 0 до 3 с учетом выраженности реакции и ее локализации: 0 – отсутствие реакции, 1 – слабая реакция, 2 – умеренная реакция, 3 – сильная реакция. Результаты реакции с антигенами, имевшими ядерную локализацию (Кi67, р63), оценивали по системе подсчета histochemical score, включающей интенсивность иммуногистохимической окраски по 3-балльной шкале и долю (%) окрашенных клеток и представляющей сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание.
С целью определения прогностической значимости уровня противовирусных антител в развитии рецидива рака мочевого пузыря в качестве статистического анализа использованы деревья классификации (дерево решений – CHAID). Этот метод позволяет предсказывать принадлежность наблюдений или объектов к тому или иному классу категориальной зависимой переменной в зависимости от соответствующих значений одной или нескольких предикторных переменных. Деревья решений – мощное средство для классификации и прогнозирования. Преимуществом деревьев решений является то, что они могут быть выведены графически, что делает их удобными для восприятия. Цель построения деревьев классификации заключается в предсказании (или объяснении) значений категориальной зависимой переменной.
Для исследования влияния нескольких независимых переменных на одну зависимую переменную использовали одномерный дискриминантный анализ – метод бинарного логистического регресса. При этом независимые переменные могут иметь любой вид шкалы (количественные, порядковые, дихотомические). Для оценки характера и степени влияния различных факторов на риск возникновения рецидивов у пациентов был использован метод бинарной логистической регрессии. Вероятность наступления события для некоторого случая рассчитывается по формуле z= b0+ b1 ∙ X1 + b2 ∙ Х2 + ... + bn ∙ Xn, где X – значения независимых переменных; bi – коэффициенты, расчет которых является задачей бинарной логистической регрессии; b0 – некоторая константа.
В качестве зависимой переменной (переменной отклика) был взят показатель наличия рецидивов. В ходе построения математической модели проведен многофакторный анализ возможного влияния на зависимую переменную следующих факторов: возраста пациентов, пола, стадии заболевания, степени анаплазии, характера поражения; наличие рецидивов, уровня противовирусных антител, наличия вирусных ДНК в опухолевой ткани. При построении математической модели проведен поэтапный анализ влияния вышеперечисленных показателей на наличие рецидивов. В результате данного анализа в модели остались только независимые факторы, достоверно влияющие на возникновение рецидива (p<0,05). Группе пациентов с наличием рецидива присвоена кодировка 1, без рецидива – 0. С помощью полученных коэффициентов уравнения бинарной логистической регрессии для каждого пациента рассчитывается вероятность принадлежности к той или иной группе. Принадлежность к группе с негативным прогнозом приняли при р>0,5, к группе с положительным прогнозом – при р<0,5.
С помощью метода ранговой корреляции Спирмена определены параметры, влияющие на возникновение рецидивов. Для исключения зависимых между собой факторов проведен корреляционный анализ Пирсона или Спирмена в зависимости от вида исследуемых показателей.
Результаты. У пациентов с рецидивным характером опухолевого роста имело место статистически значимое повышение средних показателей уровня анти-ЦМВ IgG – 616,5±501,46 ЕД/мл против 339,06±306,61 (p=0,0017; рис. 1, 2).
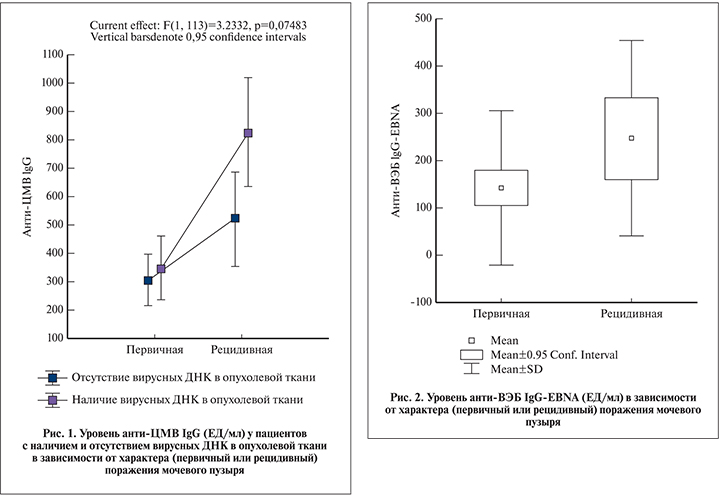
При этом уровень анти-ЦМВ IgG у пациентов с наличием вирусных ДНК в опухолевой ткани был значительно выше, чем при их отсутствии (см. рис. 1).
Статистически значимые результаты мы получили и для уровня нуклеарных антител к ВЭБ: 141,5±163,7 ЕД/мл у пациентов с первичной опухолью против 246,7±207 у пациентов с наличием рецидива (р<0,05) (рис. 2).
В связи с этим с целью прогнозирования рецидива опухоли мочевого пузыря нами использован метод построения деревьев классификации с использованием опции CART (Classification And Regression Trees), которая при построении дерева осуществляет полный перебор всех возможных вариантов одномерного ветвления. Матрица классификаций для тестовой выборки показывает число случаев, классифицированных верно, и тех, которые были классифицированы неправильно, т.е. отнесены к другой категории.
Выделено два класса: наличие (n=24) и отсутствие (n=72) рецидива. В результате анализа получена модель с пятью условиями разделения (split) на ветви и 6 узлами (node), т.е. последним делением (красные квадратики, рис. 3).
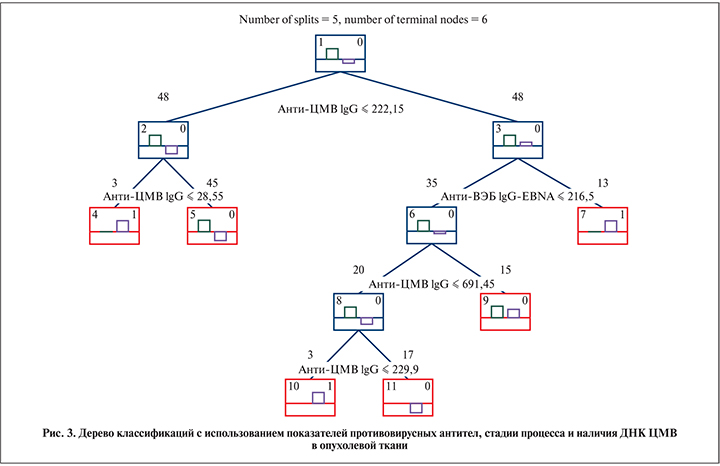
В результате анализа отобраны показатели анти-ЦМВ IgG, анти-ВЭБ IgG-EBNA, стадия процесса и наличие ДНК ЦМВ в опухолевой ткани, при которых были правильно классифицированы 20 из 24 с рецидивом, 58 из 72 без рецидива. Данные по чувствительности и специфичности метода представлены в табл. 1.

На основании дерева классификаций в табл. 2 представлены прогностические критерии развития рецидива рака мочевого пузыря: уровни анти-ЦМВ IgG, анти-ВЭБ IgG- EBNA, наличие ДНК ЦМВ в опухолевой ткани и стадия процесса. Наиболее прогностически значимыми показателями в отношении риска рецидива опухоли мочевого пузыря все-таки являются уровни анти-ЦМВ IgG (100%) и анти-ВЭБ IgG-EBNA (78%).
Нами был проведен многофакторный анализ (бинарная логистическая регрессия) и получена достоверная модель (χ2=22,438, p=0,00043), в которую вошли следующие факторы, влияющие на развитие рецидива опухоли мочевого пузыря (табл. 2).
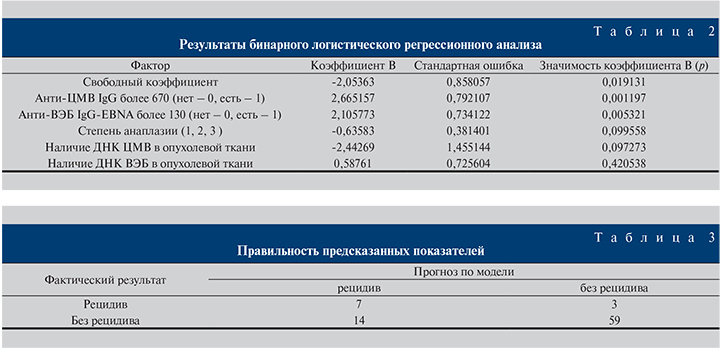
На основании полученного регрессионного уравнения проведена проверка, в результате которой получены достаточно высокие предсказательные результаты: специфичность – 95,2%, чувствительность – 33,3% (табл. 3, 4)
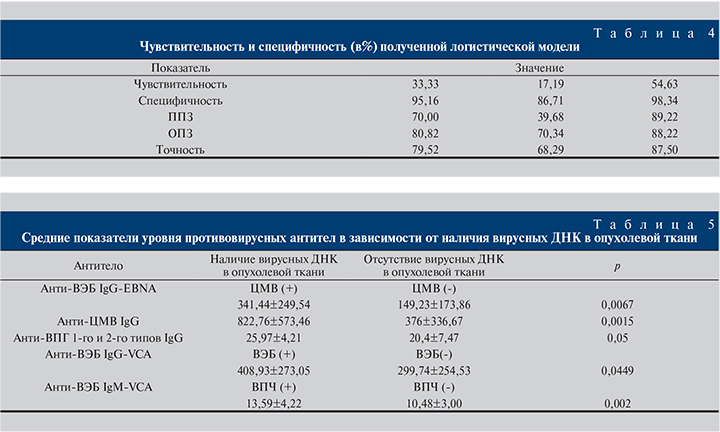
В целом, если рассматривать группы пациентов с наличием или отсутствием вирусных ДНК в опухолевой ткани, то, как продемонстрировано в табл. 5, в ряде случаев уровень противовирусных антител статистически значимо выше в первой группе, нежели во второй. В частности, на рис. 4 представлено соотношение уровня нуклеарных антител в зависимости от степени анаплазии у больных с наличием и отсутствием ДНК ЦМВ в опухолевой ткани.
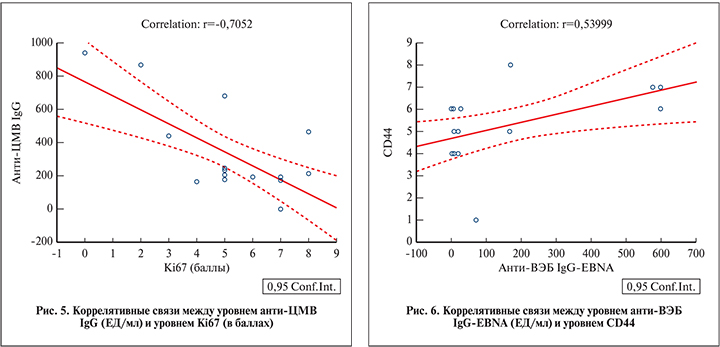
 В ходе анализа коррелятивных связей уровня противовирусных антител и факторов апоптоза, неоангиогенеза, пролиферативной активности опухоли, факторов роста, выявлено, что уровень антител к ЦМВ не коррелирует с пролиферативной активностью опухоли (рис. 5) и степенью апоптоза, а также имеет обратную зависимость.
В ходе анализа коррелятивных связей уровня противовирусных антител и факторов апоптоза, неоангиогенеза, пролиферативной активности опухоли, факторов роста, выявлено, что уровень антител к ЦМВ не коррелирует с пролиферативной активностью опухоли (рис. 5) и степенью апоптоза, а также имеет обратную зависимость.
В то же время уровень нуклеарных антител к ВЭБ (рис. 6) с высокой степенью соотносится с метастатическим потенциалом опухоли у пациентов как с наличием вирусных ДНК в опухолевой ткани, так и в общей группе. Следует отметить наличие положительных высоких, статистически достоверных коррелятивных связей между уровнем капсидных антител к ВЭБ и факторами роста (EGFR), а также пролиферативной активностью опухоли. Сводные данные представлены в табл. 6 у пациентов как с наличием вирусных ДНК в опухолевой ткани, так и в общей группе.
Следует отметить, что высокие коррелятивные связи мы получили между уровнем капсидных антител к ВЭБ и факторами роста как у пациентов с наличием вирусных ДНК в опухолевой ткани, так и в группе в целом. Такая же ситуация наблюдается и при повышении уровня нуклеарных антител и маркера адгезии CD44. Однако уровень корреляционных взаимоотношений выше именно при наличии вирусного агента в опухолевой ткани. Что касается факторов ангиогенеза, то статистически значимые коррелятивные связи получены только от пациентов с наличием вирусных ДНК в опухолевой ткани. Отдельно хотелось отметить обратные коррелятивные связи между уровнями пролиферации и нуклеарных антител. На наш взгляд, это связано с тем, что у ряда пациентов с хронической герпес-вирусной инфекцией или иммуносупрессивных больных нуклеарные антитела могут не определяться или сохраняться на низком уровне [12, 13]. После реактивации персистирующей ВЭБ-инфекции определяются повышенные титры анти-ВЭБ IgG-VCA, тогда как уровень нуклеарных антител может снижаться [13, 14].
Ранее в наших работах мы указывали, что у 6 пациентов с инцидентальным раком предстательной железы имело место повышение уровня анти-ВЭБ IgG-VCA (612,5±214,5 ЕД/мл против 372,8±218,1; p=0,03) и уровня анти-ВЭБ IgG-ЕA (38,7±54,9 ЕД/мл против 11,4±23; p=0,0008) при сравнимых уровнях ПСА (4,9 и 4,4 нг/мл) и объеме простаты (69,3 и 77,4 мл) по сравнению с уровнем антител у пациентов с ДГПЖ [15]. Повышение значений противовирусных антител свидетельствует о реактивации ВЭБ-инфекции.

Рецептор эпидермального фактора роста EGFR (HER1) играет важную роль в пролиферации эпителиальных клеток. Белок EGFR имеет тирозинкиназную активность, необходимую для передачи сигнала при его активации. Активация механизмов с участием EGFR приводит к усилению пролиферативной активности опухолевых клеток, неоангиогенезу, замедлению апоптоза, более раннему появлению метастазов [16]. С учетом высоких коррелятивных связей уровня капсидного антигена и факторов роста у пациентов с наличием новобразований мочевого пузыря вполне возможно, что именно реактивация герпес-вирусной инфекции приводит к развитию вторичной иммунологической недостаточности и опухолевого процесса при сопоставимых показателях ПСА за счет активации ростовых факторов у пациентов, страдающих раком предстательной железы.
Обсуждение. В настоящее время появляется все больше работ, посвященных серологической диагностике ВЭБ-ассоциированных неоплазм [5–8]. При этом предлагается использовать уровень противовирусных антител в качестве как скрининга в общей популяции, так и контроля излеченности [17, 18]. У пациентов с наличием ВЭБ-ассоциированной назофарингеальной карциномы выявлено повышение уровня определенных ВЭБ-антител. С учетом эндемичности поражения назофаринегальной карциномой (Южный Китай) выделяют как генетически обусловленные факторы, так и факторы окружающей среды, выступающие как ко-факторы развития вирусиндуцированного рака, такие как соленая рыба, растительные медикаментозные препараты, курение, злоупотребление алкоголем и др., влияющие на исход ВЭБ-инфекции [19]. R. Shinkura et al. [20] в своей работе, посвященной изучению противовирусных антител у больных назофаренгиальной карциномой, указывают на реактивацию ВЭБ-инфекции при наличии ДНК ВЭБ в опухолевой ткани. A. Tamada et al. [21] говорят: после излечения карциномы титр антител снижается до нормальных показателей через 6–18 мес., тогда как у пациентов, рефрактерных к комбинированной терапии (лучевой, химиотерапии, хирургическому лечению), титр антител остается высоким. В мета-анализе [22], посвященном диагностической ценности определения уровня анти-ВЭБ IgA-VCA, указано на целесообразность определения не только этого маркера, но и других серологических маркеров ВЭБ-инфекции у больных назофаренгиальной карциномой. Аналогичного мнения придерживаются Cui Xia et al. [17]. Авторы говорят о комплексном диагностическом подходе использования серологических маркеров (SA, Rta-IgG, EA-IgA, VCA-IgA) ВЭБ-инфекции не только в качестве скрининга общей популяции, но и с целью мониторинга прогрессирования опухолевого процесса. Y. Li et al. [18] предлагают определение уровня VCA-IgA, Rta-IgA, EA-IgA, и ДНК ВЭБ в качестве комбинированного метода диагностики назофарингеальной карциномы.
При обследовании пациентов с ларингеальными опухолями (n=28) выявлено повышение уровней анти-ВЭБ IgG-VCA и анти-ВЭБ IgG-EBNA, однако разница с уровнем вышеуказанных антител у пациентов контрольной группы (n=18) была статистически не значимой. Ни в одном случае повышения уровня белков острой фазы выявлено не было. При этом у пациентов с N0 уровни антител были значительно выше, чем у пациентов с N1–N3. Авторы делают вывод о возможном влиянии ВЭБ на канцерогенез рака носоглотки [23].
María G. Cárdenas-Mondragón et al. указывают на высокие корреляционные связи между повышенными титрами анти-ВЭБ IgG-VCA и риском развития рака желудка (интестинального типа) у взрослых и развития выраженных гастритов у детей [24, 25]. Кроме того, у пациентов с высокими титрами антител к ВЭБ и H. pylori имело место повышение уровня клеточной иммунной инфильтрации и риска развития системной воспалительной реакции, что в свою очередь подчеркивает ко-факторную роль ВЭБ как триггера развития воспаления слизистой желудка. Авторами выявлен высокий уровень IFN-γ у пациентов, страдающих раком желудка, с повышенным уровнем анти-ВЭБ IgG-VCA [26].
Другие авторы выявили наличие вирусного генома ВЭБ у 43% женщин, страдавших раком молочной железы, при этом имело место повышение титров анти-ВЭБ IgG VCA+IgG EBNA1 в 87% случаев. В этом исследовании установлена зависимость между ВЭБ-инфекцией и развитием инфильтративной протоковой карциномы (infiltrating ductal carcinomas (IDC) [27].
Как и при неоплазмах других локализаций, мы выявили повышенные уровни капсидных и нуклеарных антител к ВЭБ у больных раком мочевого пузыря (особенно при наличии вирусных ДНК в опухолевой ткани), повышение уровня анти-ЦМВ IgG у пациентов с рецидивным характером опухолевого процесса.
По данным статистического анализа, с высокой степенью достоверности можно говорить о прогностической ценности повышения уровня анти-ЦМВ IgG и анти-ВЭБ IgG-EBNA в развитии рецидива рака мочевого пузыря.
К сожалению, в литературе мы не нашли работ, касающихся коррелятивных связей между повышением уровня антител к ЦМВ и рецидивным характером неоплазм других локализаций. Присутствует указание на онкомодулирующий эффект ЦМВ-инфекции, в частности, при глиобластомах [28]. Последние публикации, касающиеся сочетанной вирусной инфекции при раке желудка, свидетельствуют о частой ко-инфекции ВЭБ и ЦМВ [29, 30], при этом при наличии ЦМВ-инфекции рак желудка статистически значимо развивался на 14 лет раньше, чем у не инфицированных ЦМВ больных [29]. В наших предыдущих работах мы также указывали на возможный онкомодулирующий эффект ЦМВ при раке мочевого пузыря [11] и указывали точки «cut-off» для уровней противовирусных антител в зависимости от стадии процесса, степени анаплазии и рецидивного характера опухоли мочевого пузыря [31].
Что касается иммуногистохимических показателей, то мы получили достоверные высокие коррелятивные связи между уровнем анти-ВЭБ IgG-VCA и экспрессией EGFR, анти-ВЭБ IgG-EBNA и экспрессией CD44 и отрицательные коррелятивные связи между уровнем анти-ЦМВ IgG и маркерами пролиферации. Таким образом, уровень антител к ЦМВ, по всей видимости, не влияет на пролиферативную активность опухоли и степень апоптоза. Тогда как уровень нуклеарных и капсидных антител к ВЭБ с высокой степенью достоверности свидетельствует о повышении метастатического потенциала опухоли у пациентов как с наличием, так и с отсутствием вирусных ДНК в опухолевой ткани.
Таким образом, уровень противовирусных антител отражает риск развития рецидива опухолевого процесса, метастатического потенциала опухоли и при наличии вирусных ДНК в опухолевой ткани – ангиогенеза.
Заключение. В результате проведенной работы установлено: уровни анти-ЦМВ IgG более 670 ЕД/мл, анти-ВЭБ IgG-EBNA более 130 ЕД/мл служат достоверными прогностическими критериями развития рецидива рака мочевого пузыря.



