Введение. Гидронефроз на фоне обструкции пиелоуретерального сегмента (ОПУС) – одна из наиболее распространенных аномалий верхних мочевыводящих путей (ВМП) у детей [1]. Ведущую роль в скрининге гидронефроза, как и в последующем динамическом наблюдении, занимает ультразвуковое исследование (УЗИ), широкое применение которого обеспечило максимально раннее, прежде всего антенатальное, его выявление [2]. Большое значение в определении тактики ведения пациента помимо клинических проявлений имеет степень расширения лоханки и оценка функционального состояния почки.
С этой целью в диагностике гидронефроза используют изотопные исследования.
До недавнего времени основным методом визуализации гидронефроза считалась экскреторная урография (ЭУ). Недостатком ЭУ является диуретический эффект контрастного вещества, усиливающего степень дилатации чашечно-лоханочной системы (ЧЛС) на рентгенограммах и большая лучевая нагрузка на ребенка, особенно негативная для новорожденных и детей грудного периода.
В силу ряда ограничений и неоднозначности в трактовке результатов ЭУ практически утратила в настоящее время свое значение в качестве основного метода диагностики гидронефроза у детей, но, к сожалению, она все же выполняется во многих лечебных учреждениях нашей страны.
В силу тех же обстоятельств и спиральная компьютерная томография (СКТ), которая дает всеобъемлющую анатомическую оценку состояния ВМП, позволяет исключать уролитиаз, оценивать уровень обструкции ВМП, ограниченно применяется в отношении детей раннего возраста.
В настоящий момент, по мнению большинства экспертов, УЗИ совместно с динамической нефросцинтиграфией (ДНСГ) считаются «золотым» стандартом в диагностике гидронефроза и имеют решающее значение в определении необходимости хирургической коррекции данного заболевания [1,3]. Однако, к сожалению, во многих регионах Российской Федерации изотопные исследования, особенно детей раннего возраста, не выполняются вообще.
Вышеизложенные ограничения различных методик выявления гидронефроза определили актуальность изучения роли функциональной магниторезонансной урографии (фМРУ) в диагностическом алгоритме гидронефроза как метода, позволяющего проводить морфологическую и функциональную оценку состояния почек и ВМП в одном исследовании [2].
По данным литературы, фМРУ является активно развивающейся и неуклонно набирающей популярность методикой в урологической диагностике. Ряд исследователей продемонстрировали ее высокую эффективность в выявлении уровня обструкции пересекающего пиелоуретеральный сегмент сосуда, удвоения ЧЛС [1, 4, 10, 12]. Отсутствие ионизирующего излучения, высокая анатомическая детализация почек и ВМП с возможностью одновременной функциональной оценки почечной паренхимы, ранее определяемой только радиоизотопным исследованием, служат основным преимуществом фМРУ перед другими методами исследования при гидронефрозе.
Целью нашего исследования стало проведение сравнительного анализа результатов фМРУ и ДНСГ у детей с гидронефрозом на фоне ОПУС с целью определения роли и значения фМРУ в диагностике ОПУС у детей.
Материалы и методы. С января 2017 по декабрь 2019 г. фМРУ и диуретическая динамическая нефросцинтиграфия выполнены 36 пациентам, их средний возраст составил 89±63 мес. Мальчиков было 26 (72,2%), девочек – 10 (27,8%). Левосторонний гидронефроз выявлен у 23 (63,9%) детей, правосторонний – у 12 (33,3%) , двустороннее поражение – у 1 (2,8%) пациента (2 почечные единицы [ПЕ]). Антенатально гидронефроз выявлен у 9 (25%) пациентов, постнатально – у 27 (75%). По данным ультразвукового исследования, гидронефроз II степени имел место в 11 (29,8%) ПЕ, III – в 21 (56,7%), IV степени – в 5 (13,5%) ПЕ по классификации SFU. Диуретическая проба проведена 26 пациентам.
Статическую и динамическую МРУ с диуретической пробой осуществляли на аппарате Toshiba Vantage Titan (1,5 ТЛ). Пациентам младше 5 лет процедуру проводили в состоянии медикаментозного сна. Протокол исследования включил Т1-WI GRE-локализатор (локализатор T1-взвешенной градиентной последовательности), Т2-WI 2D single shot FSE (двухмерная T2-взвешенная последовательность с ускоренным спин-эхо [одиночный снимок]) в аксиальной и коронарной проекциях, Т2-WI 2D FS (двухмерная T2-взвешенная последовательность с подавлением сигнала от жировой ткани) в аксиальной и сагиттальной проекциях, T1-WI 2D SE (двухмерная T1-взвешенная спин-эхо-последовательность) в аксиальной проекции. Для статической урографии применяли изотропную 3D-FSE (трехмерное ускоренное спин-эхо) с толщиной среза 1 мм в косо-коронарной проекции. Динамическую нефрографию выполняли 2D-односрезовой Fast FE (двумерное односрезовое сверхбыстрое градиентное эхо) толщиной 20 мм в косо-коронарной проекции. Одно сканирование занимало 2 с., интервал – 4 с. После 20 сканирований выполняли постконтрастную урографию при помощи 3D-GRE (трехмерная градиентная последовательность). Затем проводили внутривенное болюсное (скорость – 0,2 мл/с) введение препарата гадобутрол в дозировке 0,1 мл/кг с последующим введением 20 мл физиологического раствора. Через 10 мин вводили фуросемид в дозировке 0,5 мг/кг для детей старше 1 года и 0,1 мг/кг для детей младше 1 года. Через 10 мин по окончании исследования выполняли повторную постконтрастную урографию. Общее время процедуры составило 45–50 мин.
Результаты исследования использовали для построения графиков накопления и выведения контрастирующего препарата при помощи программного обеспечения рабочей станции томографа. В дальнейшем вычисление раздельной почечной функции в области интереса выполняли на отдельном персональном компьютере с помощью OpenOffice Calc. Для данной цели применяли усреднение методом наименьших квадратов области линейного нарастания сигнала паренхимы почек и последующего умножения на площадь области интереса. Полученные данные для одной почки в дальнейшем нормировали к сумме значений обеих почек для получения раздельной почечной функции в процентах.
фМРУ дает возможность определять объемную и дифференциальную почечную функцию (ДПФ) методом Patlak-Rutlenda. Объемная дифференциальная почечная функция изучена в сравнении с нормативными значениями. Оператор определял максимальное накопление контрастного препарата в момент начала его перехода в просвет ЧЛС. Patlak-дифференциальную почечную функцию рассчитывали на основании показателей скорости клубочковой фильтрации, что имеет преимущество перед другими методами при двусторонней обструкции и наличии выраженного нефросклероза.
Второй функциональной характеристикой МРТ является время почечного перехода (RTT – Renal Transit Time) которое соответствует интервалу времени от момента начала перемещения контраста из почечной паренхимы в проксимальный отдел мочеточника. Если RTT меньше 245 с , обструкции в области ПУС нет, если RTT в интервале 245–490 с – проба сомнительная, пациент нуждается в динамическом наблюдении с целью мониторинга ДПФ. При удлинении RTT более 490 с – обструкция в области ПУС считается доказанной.
Статистический анализ и обработку полученных данных проводили с использованием программного обеспечения «STATISTICA. 10» (версия 10, StatSoft, Inc, Tulsa, USA).
 В качестве описательной статистики для исчисляемых параметров использовали медианы, квартильный размах [Q1; Q3], средние значения, среднее отклонение. При проверке на нормальность использовали критерии Шапиро–Уилка, Колмагорова–Смирнова. С целью сравнения исчисляемых переменных применяли критерий Вилкоксона. Для изучения связи между полученными данными использовали параметрический критерий Пирсона (χ2), а также непараметрический метод оценки корреляционный связи Спирмена (r).
В качестве описательной статистики для исчисляемых параметров использовали медианы, квартильный размах [Q1; Q3], средние значения, среднее отклонение. При проверке на нормальность использовали критерии Шапиро–Уилка, Колмагорова–Смирнова. С целью сравнения исчисляемых переменных применяли критерий Вилкоксона. Для изучения связи между полученными данными использовали параметрический критерий Пирсона (χ2), а также непараметрический метод оценки корреляционный связи Спирмена (r).
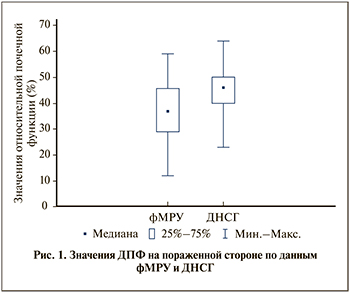
Результаты. Медиана и квартили ДПФ, по данным фМРУ, на пораженной стороне составили 37% [29;43], по данным ДНСГ, – 46% [40;49] (рис. 1). По данным ДНСГ, у 12 пациентов проба была положительной, у 10 – отрицательной и у 4 пациентов – сомнительной.
Получены следующие различия ДПФ между фМРУ и ДНСГ: различия менее чем на 5% выявлены у 10 (27,78%) пациентов, от 5 до 10% – 11 (30.56%), от 10 до 20% – у 8 (22.22%) , более чем на 20% – у 7 (19,44%) пациентов.
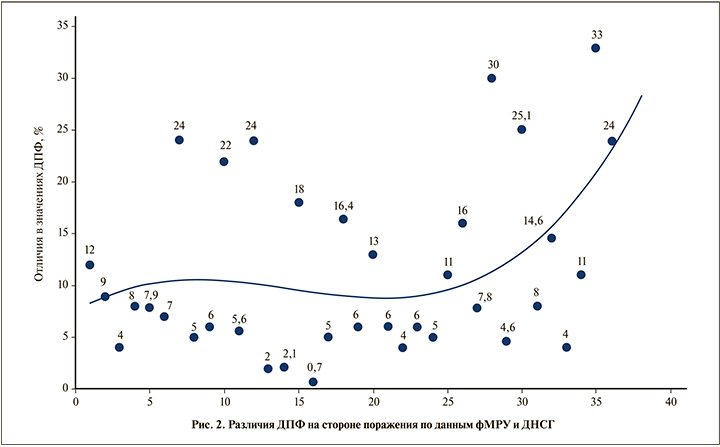
В целом различия в ДПФ между фМРУ и ДНСГ варьировались в пределах 0,7–33%. Среднее значение в различиях ДПФ на стороне поражения составило 11,3±8,5%. При сравнении результатов ДПФ на пораженной стороне выявлена умеренная корреляционная связь между данными фМРУ и ДНСГ по шкале Чеддока (r=0,59; p<0,05). Сравнение данных ДПФ по критерию Вилкоксона выявило статистически значимые различия между двумя исследованиями (р<0,05).
Исследования в точечной диаграмме (рис. 2) расположены в хронологическом порядке относительно даты выполнения фМРУ для уточнения возможного влияния опыта исследователя на соответствие результатов выполнения фМРУ данным ДНСГ. Установлено, что в процессе накопления опыта выполнения фМРУ абсолютные значения различий в значениях ДПФ не уменьшаются, более того, после 25-го исследования отмечена тенденция к увеличению значений разницы ДПФ по результатам фМРУ и ДНСГ. Таким образом, опыт исследователя не приводит к повышению вероятности совпадения данных, полученных при проведении фМРУ и ДНСГ.
При выполнении фМРУ положительная диуретическая проба выявлена у 20 пациентов, у 5 – отрицательная и у 1 пациента – сомнительная. На точечной диаграмме (рис. 3) отображены результаты диуретической пробы, в которых отмечено расхождение и совпадение данных фМРУ и ДНСГ.
 Результаты на диаграмме 3 расположены в хронологическом порядке относительно даты выполнения диуретической пробы с целью оценки возможного влияния опыта исследователя на соответствие результатов диуретической пробы между двумя исследованиями. Как видно, результаты диуретической пробы по данным фМРУ и ДНСГ совпали у 15 пациентов. Анализ демонстрирует, что накопление опыта выполнения фМРУ не приводит к уменьшению частоты результатов, отличавшихся от данных, полученных при проведении ДНСГ, более того отмечается увеличение количества отличающихся результатов после 18-го исследования. При сравнении вероятности совпадения результатов у первых 13 пациентов, которым выполняли диуретические пробы при фМРУ и ДНСГ, и у следующих 13 больных с помощью критерия Хи-квадрат статистически значимых различий не выявлено (p>0.05).
Результаты на диаграмме 3 расположены в хронологическом порядке относительно даты выполнения диуретической пробы с целью оценки возможного влияния опыта исследователя на соответствие результатов диуретической пробы между двумя исследованиями. Как видно, результаты диуретической пробы по данным фМРУ и ДНСГ совпали у 15 пациентов. Анализ демонстрирует, что накопление опыта выполнения фМРУ не приводит к уменьшению частоты результатов, отличавшихся от данных, полученных при проведении ДНСГ, более того отмечается увеличение количества отличающихся результатов после 18-го исследования. При сравнении вероятности совпадения результатов у первых 13 пациентов, которым выполняли диуретические пробы при фМРУ и ДНСГ, и у следующих 13 больных с помощью критерия Хи-квадрат статистически значимых различий не выявлено (p>0.05).
Обсуждение. Изучение роли фМРУ в диагностике гидронефроза как метода, обеспечивающего высокое качество анатомической детализации почек и ВМП, оценку дифференциальной почечной функции (ДПФ), возможность проведения диуретической пробы, предопределяет растущую востребованность данного исследования в алгоритме диагностики обструктивной патологии ВМП у детей. Ограничения широкого использования фМРУ в качестве основного метода диагностики гидронефроза включают отсутствие опытных специалистов, владеющих соответствующими технологиями, высокую стоимость исследования, ограниченную доступность и необходимость седации [2, 11].
Поиск литературы демонстрирует крайне узкий перечень исследований по изучению корреляционных связей данных фМРУ с результатами других диагностических исследований при гидронефрозе у детей. М. Reither et al. [5] в своем исследовании оценили соответствие ДПФ, полученных при фМРУ, с результатами диуретической радиоизотопной ренографии и сообщили о высокой степени корреляции между данными двух исследований (r=0.95). Boss et al. [9] показали аналогичную степень корреляции (r=0.95) результатов фМРУ и динамической нефросцинтиграфии.
M. R. Perez-Brayfield et al. [6] пришли к выводу, согласно которому, МР-урография дает отличную детализацию анатомических структур мочевыводящих путей и ДПФ почек в одном исследовании без ионизирующего излучения, отметив высокую корреляцию (r2=0.93) ДПФ по данным фМРУ и почечной сцинтиграфии.
Rohrschneider et al. [7] на основании МРТ 62 пациентов с гидронефрозом отметили высокое качество визуализации в 96% случаев, а также значительную корреляцию (r=0.92) данных фМРУ и изотопного исследования.
McDaniel et al. [8] отметили высокую ценность фМРУ в выявлении ОПУС и особенно возможности выявления внешних причин обструкции ПУС, в частности пересекающего пиелоуретеральный сегмент сосуда, что, по мнению авторов, является одним из существенных преимуществ фМРУ по сравнению с другими методами исследований.
А. Leppert et al. [10] в своем исследовании сравнили предоперационные данные (УЗИ, ЭУ, МЦУГ, изотопная ренография и фМРУ) с интраоперационными данными и обнаружили, что фМРУ дает наиболее точную оценку локализации уровня обструкции мочевыводящих путей и морфологии почечной паренхимы. Авторы утверждают, что фМРУ демонстрирует более высокую точность среди всех методов визуализации. По мнению авторов, данное исследование позволит заменить ЭУ в диагностике гидронефроза.
Несмотря на огромные потенциальные возможности фМРУ, пока существуют ограничения широкого применения метода в клинической практике. К сожалению, отсутствие стандартизированных протоколов служит основой, ограничивающей точность и воспроизводимость результатов фМРУ [11, 13].
Однако внедрение фМРУ в диагностический алгоритм гидронефроза в ближайшем будущем даст хирургу, по нашему мнению, возможность на основании одного исследования определиться с показаниями к оперативному вмешательству при гидронефрозе на фоне ОПУС.
Выводы. Наш опыт демонстрирует высокие потенциальные возможности фМРУ в части замещения классических методов диагностики ОПУС у детей, принимая во внимание высокие коэффициенты корреляции между результатами фМРУ и ДНСГ. Стандартизация протокола выполнения фМРУ позволит повысить значимость диагностической информации и в перспективе, возможно, превратит фМРУ в единственно необходимое исследование для определения тактики ведения больных ОПУС.



