Введение. Обструктивные уропатии (ОУ) – гетерогенная группа врожденных структурных дефектов мочевыводящих путей (МВП), сопровождающихся нарушением уродинамики. Они занимают более половины всех пренатально выявленных аномалий развития [1]. Показатель встречаемости в детской популяции достигает 5,4% и имеет тенденцию к неуклонному ежегодному росту [2].
Внедрение высокотехнологичных методов диагностики и лечения на пре- и постнатальном этапах позволило проводить хирургическую коррекцию анатомического дефекта в раннем возрасте [3]. Однако реконструктивно-пластические операции и разработанные малоинвазивные технологии по восстановлению уродинамики в большинстве случаев проводятся без объективной оценки активности воспалительного процесса в МВП [4]. Отсутствие клинических эквивалентов латентной формы пиелонефрита и трудности ее диагностики создают условия мнимого благополучного течения ОУ. Существующие инструментальные методы визуализации и стандартные лабораторные параметры не позволяют достоверно выявлять латентную фазу воспаления, мониторировать течение и прогнозировать исход заболевания [5]. Операции, выполненные на исходно патологически сформированных структурах в условиях воспаления, неизбежно приводят к выраженной травматизации, последующему активному процессу рубцевания с высоким риском рецидива и необходимостью повторных вмешательств [6]. По данным ряда авторов, ранний послеоперационный период осложняется обострением хронического пиелонефрита в 25–40% случаев с последующим развитием нефросклероза, сводя на нет результаты успешной, своевременно выполненной реконструктивной операции [7]. Именно ОУ в 40–50% случаев являются причиной формирования, прогрессирования хронической болезни почек (ХБП) и основным показанием к трансплантации в детском возрасте [8].
Увеличение количества пациентов с обструктивными уропатиями в периоде новорожденности и первого года жизни, тяжесть патологии, сочетание с другими аномалиями развития, высокий риск развития ХБП и инвалидизации в раннем возрасте указывают на необходимость комплексной оценки состояния МВП на протяжении всего периоперационного периода.
Цель исследования: выявить предикторы периоперационных осложнений у детей с ОУ на основе сравнительного анализа содержания молекулярных маркеров воспаления в моче и биоптатах, результатов морфологического исследования и клинических данных.
Материалы и методы. Проведенное клиническое исследование являлось когортным продольным проспективным контролируемым и было одобрено локальным этическим комитетом и выполнено в соответствии с ст. 20 Федерального закона РФ «Об основах охраны здоровья граждан в Российской Федерации» № 323 от 21.11.2011. Обследованы 178 пациентов, которые в зависимости от уровня обструкции были разделены на 3 группы. Первую группу составили 108 детей с гидронефрозом (ГН); 2-ю – 47 с уретерогидронефрозом (УГН); 3-ю группу – 23 ребенка с инфравезикальной обструкцией (ИВО) в виде клапанов задней уретры. В 1-й и 2-й группах соотношение мальчиков и девочек было 2:1, в 3-ю группу вошли только мальчики. Средний возраст обследованных составил 5,1±4,6 года.
Критерии исключения: возраст до 3 мес., приобретенные формы обструкции МВП (посттравматические, мочекаменная болезнь), тяжелая сопутствующая патология (сахарный диабет, некомпенсированные формы патологии щитовидной железы и надпочечников), интеркуррентные формы воспалительного процесса (пневмония, миокардит), а также отказ родителей от участия в обследовании. Группу контроля составили 20 детей с пупочной или паховой грыжей, в предоперационном периоде стратифицированных по возрасту и полу.
План обследования включал клинические, лабораторные, микробиологические, рентгеноурологические (экскреторную урографию и микционную цистоуретерографию), ультразвуковые (с допплерографией), радиологические (динамическую нефросцинтиграфию) методы исследования. Цистоскопию выполняли по показаниям. Постановку диагноза ОУ и определение уровня конфликта осуществляли при помощи ультрасонографии (контуры почки, размеры, толщина и структура паренхимы, размеры чашечно-лоханочной системы, диаметр мочеточников) и экскреторной урографии (секреторно-эвакуаторная функция). Для исключения функциональных нарушений в области пиелоуретерального сегмента проводили УЗИ с диуретической нагрузкой (лазикс внутримышечно в возрастной дозировке однократно). При необходимости для раздельной оценки функции каждой из почек выполняли динамическую нефросцинтиграфию (ДНСГ). Наличие ИВО диагностировали с помощью микционной цистоуретрографии (выведение уретры при трехчетвертном положении). Тип клапанов устанавливали при цистоскопии.
Активность хронического обструктивного пиелонефрита (ХОП) во всех группах определяли по клиническим и лабораторным данным (общему анализу крови, общему анализу мочи, посеву мочи и анализу мочи по Нечипоренко). Для оценки тяжести состояния пациентов и активности воспалительного процесса использовали критерии синдрома системного воспалительного ответа (R. C. Bone, 1992; M. Parker, 1998), оценивали течение мочевого синдрома (уровень лейкоцитурии, эритроцитурии, протеинурии). При установлении двух и более признаков данного синдрома, а также при наличии мочевого синдрома диагностировали активную фазу ХОП. Внутри каждой группу были выделены две подгруппы в зависимости от фазы течения ХОП: подгруппа А – ХОП в фазе латентного воспаления; подгруппа Б – в фазе активного воспаления.
Всем пациентам проводили микробиологическое исследование мочи и интраоперационных биоптатов с полной идентификацией возбудителя.
В послеоперационном периоде (10–14 сут.) все больные получали эмпирическую антибактериальную терапию в возрастной дозировке, в дальнейшем скорректированной в соответствии с чувствительностью к антибиотикам.
При выраженном истончении почечной паренхимы и снижении функции менее 10–15% принимали решение о нефруретерэктомии.
Содержание про- и противовоспалительного цитокинов, IL-8 и -10, в моче оценивали у всех пациентов с ОУ (n=178) и у детей группы сравнения (n=20) в двух точках: точка I – до начала лечения и точка II – на 3–5-й день после хирургической коррекции. Исследование проводили методом твердофазного иммуноферментного анализа с помощью тест-систем «Вектор-Бест» (Россия, Новосибирск) (IL-8), «Bender Medsystems» (Австрия) (IL-10) на иммуноферментном анализаторе Stat Fax 2010 («Stat Fax», США).
Резецированные участки пиелоуретерального (n=106), уретеровезикального (n=44) сегментов, ткань удаленных почек (n=5) подвергали патоморфологическому исследованию с использованием обычной обработки и окрашиванием тканей гематоксилином и эозином, трихромом по Массону. Фотографии сделаны с помощью микроскопа Leica DM 2000.
Статистический анализ полученных результатов выполнен с использованием пакета прикладных программ Statistica 9.0 («StatSoft», 2009, Россия). Результаты представлены в виде медианы (Me) и интерквартильного диапазона (LQ; UQ). Данные по определению уровня цитокинов в моче были проанализированы с использованием теста Краскела–Уоллиса с поправкой Данна для множественных сравнений. Оценку активности воспалительного процесса в МВП по анализу спектра чувствительности и специфичности в диапазоне исследованных значений проводили путем построения характеристических кривых (ROC-анализ).
Результаты. В 1-й группе антенатально выявленная в 83% случаев дилатация полостной системы почки была подтверждена результатами ультрасонографии в раннем неонатальном периоде и служила показанием к проведению комплексного урологического обследования.
При поступлении в стационар среди пациентов с ГН 67 (62%) имели латентное течение ХОП, 41 (38%) – обострение воспалительного процесса в МВП. Одностороннее и двустороннее поражения установлены у 89 (82%) и 19 (18%) детей соответственно. Нарушение секреторно-эвакуаторной функции по данным экскреторной урографии и ДНСГ диагностировано у 96% пациентов. Микробиологическое исследование позволило обнаружить микроорганизмы в моче у 75% больных. Доминирующим патогеном оказалась Esherichia coli (41%). Второе место в структуре возбудителей ХОП занял Enterococcus faecalis (18%). На долю остальных патогенов пришлось от 0,8 до 3,7%.
По завершении обследования выбор метода лечения проводили в зависимости от возраста, течения воспалительного процесса в МВП, объема поражения (одно- или двустороннее), состояния почечной паренхимы, наличия и функции контралатеральной почки. При сохранении функции почки более 10–15% (по данным ДНСГ) коррекцию ОУ осуществляли открытым (n=98) или лапароскопическим (n=10) доступом. В зависимости от причин ГН выполняли либо уретеропиелопластику по методике Хайнса–Андерсена–Кучера (n=97), либо антевазальную пластику (n=11) с установкой пиелостомического дренажа на 7–10 дней.
Во 2-й группе антенатальное увеличение диаметра мочеточника, дилатация полостной системы почки, зачастую сопровождавшаяся уменьшением толщины паренхимы, выявлены в 79% случаев. При поступлении в стационар среди пациентов с УГН 30 (64%) имели латентное течение ХОП, 17 (36%) – обострение воспалительного процесса в МВП. Одностороннее и двустороннее поражения установлены у 40 (85%) и 7 (15%) человек соответственно. Нарушение секреторно-эвакуаторной функции диагностировано в 98% наблюдений. Микробиологическое исследование позволило обнаружить микроорганизмы в моче у 80,9% больных. Как и в 1-й группе, доминировали патогены E. coli (43%) и E. faecalis (17%).
После обследования выполняли реимплантацию мочеточников с резекцией их дистального отдела по методике Коэна (n=39) или Политано–Леадбеттера (n=8) с установкой уретрального катетера на 10 дней.
Микробиологическое исследование образцов ткани пиелоуретерального и уретеровезикального сегментов (n=35) позволило идентифицировать возбудитель в 89% случаев. У 25% пациентов 1-й и 2-й групп микрофлора биоптатов не соответствовала микроорганизмам, выделенным из мочи.
В 3-й группе антенатальное увеличение размеров мочевого пузыря, сопровождавшееся в большинстве случаев дилатацией полостной системы почек с одной или чаще с двух сторон, истончением почечной паренхимы, установлено у 97% плодов. По данным контрольной ультрасонографии, в раннем неонатальном периоде помимо расширения чашечно-лоханочного комплекса и мочеточников установлено изменение толщины стенки мочевого пузыря, наличие дивертикулов, а также объема остаточной мочи более 10%.
Все пациенты этой группы поступали в состоянии обострения воспалительного процесса в МВП. На фоне высокого давления в мочевом пузыре диагностированы рефлюксирующий или обструктивный мегауретеры (мочевой пузырь высокого давления с морфологическими изменениями стенки детрузора являлся обструктивным компонентом). Одностороннее и двустороннее поражения установлены у 4 (17%) и 19 (83%) детей соответственно. Нарушение секреторно-эвакуаторной функции диагностировано у всех пациентов. Микробиологическое исследование мочи выявило микроорганизмы у всех детей, несмотря на длительно проводимую антибактериальную терапию. На фоне основного патогена E. coli (32%) чаще выявляли грамотрицательные энтеробактерии: Proteus spp., Klebsiella spp., Pseudomonas cepacia, Pseudomonas aueruginosa.
Пациентам этой группы выполняли эндоскопическое разрушение клапанов задней уретры с последующим дренированием мочевого пузыря на 7–10 дней. При наличии рефлюксирующего мегауретера одномоментно проводили его коррекцию при помощи биодеградируемых препаратов (n=26).
Исследование содержания цитокинов воспаления в моче показало значимое повышение уровня IL-8 (p<0,0001) в динамике у пациентов всех групп в отсутствие достоверных изменений IL-10. При сравнительном межгрупповом сравнении концентрации провоспалительного (IL-8) и противовоспалительного (IL-10) цитокинов в моче в периоперационном периоде (табл. 1) установлено, что в активную фазу воспаления ни уровень обструкции, ни вид хирургической коррекции существенно не влияли на динамику мочевых концентраций IL-8 и -10 в динамике.

Определяющей стала исходно высокая концентрация данных маркеров, отражающая тяжесть воспаления. Кроме того, установлена четкая корреляция между увеличением содержания IL-8 в моче, количественным и качественным составом воспалительных инфильтратов, найденных при морфологическом исследовании биоптатов почек, пиелоуретерального и уретеровезикального сегментов.

В латентную фазу течения ХОП (1-я и 2-я группа) только в точке II отмечено достоверное повышение концентрации IL-8 (р=0,04) и -10 (p=0,002). По всей видимости, хирургическая коррекция обструктивного компонента приводила к обострению локального воспалительного процесса (табл. 2).

Следует отметить, что во всех биоптатах независимо от фазы течения ХОП и уровня конфликта помимо воспалительных инфильтратов (рис. 1) имелись диффузные грубоволокнистые и нежно-волокнистые склеротические изменения с замещением нормальных структурных элементов ткани до 80% (рис. 2).
На течение и исход воспалительного процесса особое влияние оказывает соотношение про- и противовоспалительных фракций цитокинов, в связи с чем нами был предложен индекс активности воспаления (ИАВ). Учитывая установленную по данным ROC-анализа высокую чувствительность (87%) и специфичность (89%) IL-8, площадь под кривой (AUC=0,97) для оценки активности течения воспалительного процесса в МВП, ИАВ рассчитывали как соотношение концентраций IL-8 и -10 в моче. В точках I и II зарегистрировано резкое увеличение ИАВ во всех группах больных вне зависимости от фазы течения ХОП по сравнению с контрольной группой (рис. 3).

При этом наибольшие значения ИАВ наблюдались у детей с ОУ в период обострения ХОП по сравнению с группой контроля (р=0,02) и группой детей с латентным течением ХОП (р=0,0007). Также установлено, что у 70% пациентов группы сравнения ИАВ был выше единицы, что свидетельствовало об умеренном дисбалансе основных про- и противовоспалительных цитокинов и наличии вялотекущего воспалительного процесса в организме. Это позволило выявить в группе сравнения детей с латентным воспалением неуточненной локализации, что требовало их детального обследования. Таким образом, ИАВ дал возможность дифференцировать не только активную и латентную фазы ХОП, но и здоровых детей и детей с латентным воспалением иной этиологии.
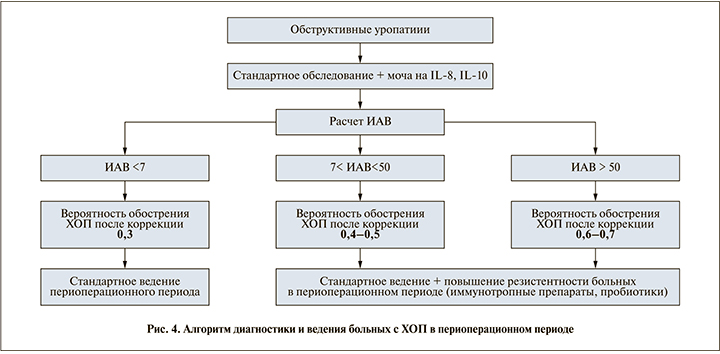
Проведя многофакторный логистический регрессионный анализ, удалось создать модель прогнозирования обострения ХОП в послеоперационном периоде с учетом ИАВ. Установлено, что вероятность обострения ХОП напрямую зависела от исходного уровня ИАВ в моче (р=0,0081). На основании полученных данных разработан алгоритм диагностики и ведения больных ХОП в периоперационном периоде (рис. 4).
Обсуждение. Отсутствие признаков синдрома системного воспалительного ответа и мочевого синдрома у большинства (63%) пациентов 1-й и 2-й групп не позволило нам объективно оценить активность течения ХОП. Ряд авторов указывают на важность своевременной диагностики и лечения латентного воспаления в МВП, в том числе и у детей с ОУ [9]. J. Jayaweera et al. [10] доказали, что каждый эпизод обострения ХОП на 11% повышает риск формирования и прогрессирования почечного рубцевания [10].
Оценка микробиологического спектра мочи во всех группах показала преобладание E. coli и E. faecalis, что согласуется с данными литературы [11]. Установленное несоответствие качественного состава возбудителей в моче и биоптатах у четверти пациентов 1-й и 2-й групп, вероятно, было обусловлено образованием бактериальных биопленок [12]. В настоящее время определение в биологических средах биопленок с измененным фенотипом известных патогенов или некультивируемых форм вызывает у исследователей все больший интерес [12]. Shrestha L.B. Baral R. et al., а также ряд других исследователей доказали, что именно наличие биопленок в моче обусловливает нецелесообразность и неэффективность проводимой антибактериальной терапии и служит основной причиной частых рецидивов воспалительного процесса в МВП [10, 12]. Эффективность антибактериальной профилактики в снижении риска обострений пиелонефрита у детей с ОУ остается под вопросом с позиций доказательной медицины [13].
Повышение содержания IL-8 в моче больных ОУ всех групп подтверждается результатами исследования ряда авторов, которые отметили перспективность использования IL-8 для оценки выраженности воспалительного процесса в МВП [14]. Дисбаланс между провоспалительным IL-8 и противовоспалительным IL-10 может изменять течение ХОП [15] и приводить к хронизации процесса. Хирургическое вмешательство на фоне воспалительного процесса в патологически сформированных тканях становится причиной тяжелого ишемическо-реперфузионного повреждения почек. Наличие в зоне воспаления YB-1-дефицитных макрофагов, регулирующих синтез IL-10, приводит к угнетению пролиферации и продукции оксида азота, потере фагоцитарной активности, тем самым создавая условия длительной иммуносупрессии и персистенции воспаления в МВП [15]. Аналогичные изменения содержания цитокинов в моче в латентную фазу ХОП, по всей видимости, указывают на активацию воспалительного процесса в МВП на фоне хирургического вмешательства. Разработанный нами ИАВ, а именно его исходные показатели, помогли разграничить больных с высоким и низким риском послеоперационных осложнений в виде обострения ХОП. Алгоритм персонифицированного ведения больных в периоперационном периоде позволит улучшить результаты хирургической коррекции и прогнозировать исход заболевания.
Заключение. Отсутствие объективных методов диагностики латентной фазы ХОП при клинически благополучном течении врожденных уропатий, возможности мониторинга течения пиелонефрита влекут за собой невозможность проведения адекватной предоперационной подготовки. Высокий риск и тяжесть послеоперационных осложнений диктуют необходимость поиска молекулярных индикаторов латентного воспаления в МВП.
В нашей работе было показано: 1) исследуемые цитокины могут служить маркером латентного воспаления, а их мониторинг позволит корректировать тактику ведения пациентов с ОУ; 2) повышенные мочевые уровни маркеров в послеоперационном периоде свидетельствуют о продолжающемся воспалительном процессе в МВП или его активации; 3) ИАВ информативен для определения риска послеоперационных осложнений и персонализированного подхода к лечению пациентов с ОУ.
Финансовая поддержка: Авторы данной статьи подтвердили отсутствие финансовой поддержки исследования, о которой необходимо сообщить.
Конфликт интересов: Авторы заявляют, что конфликт интересов отсутствует.



