Введение. Десять процентов населения мира страдают хронической болезнью почек [1], при этом нарушения проходимости мочеточника остаются одной из наиболее частых причин их развития. Широкая распространенность и рецидивирующий характер болезней почек определили основное направление научных исследований, нацеленное на понимание механизмов, лежащих в основе развития фиброзного процесса при повреждении почки [2].
В настоящее время в качестве одного из ведущих путей прогрессирования хронических болезней почек рассматривается эпителиально-мезенхимальный переход (ЭМП) как отражение морфофункциональной пластичности дифференцировки эпителия [3]. ЭМП – это уникальный биологический процесс, который включает четкое молекулярное перепрограммирование и фенотипические изменения, характеризующиеся трансформацией поляризованных эпителиальных клеток в рассеянные мезенхимальные клетки, что приводит к увеличению их подвижности [4–9]. Как известно, эпителиальные клетки тесно взаимосвязаны, что препятствует их возможной миграции из эпителиального слоя. Мезенхимальные клетки не образуют клеточных слоев или комплексов межклеточной адгезии, удлиненная форма и сквозная полярность мезенхимальных клеток способствуют их миграционной способности. В связи с этим эпителиальные клетки, подвергшиеся ЭМП, приобретают фибробластический характер и утрачивают свои функции [10].
Понимание происхождения миофибробластов в почках представляет большой интерес, так как эти клетки ответственны за образование рубцов при фиброзе почечной ткани [11–12]. В физиологических условиях масса миофибробластов накапливается в местах продолжающегося воспаления и репарации. В таких условиях миофибробласты действуют как репаративные клетки, производят, организуют внеклеточный матрикс и восстанавливают целостность тканей после повреждения [13]. Однако при патологическом рубцевании активированные фибробласты создают богатый коллагеном жесткий рубец, который нарушает структуру тканей, изменяет биохимическое и биофизическое микроокружение, что приводит к дисфункции ткани [14]. Есть данные, согласно которым одним из путей появления активированных фибробластов из эпителиальных клеток служит ЭМП [15]. Механизмы, лежащие в основе регенеративной способности почек, также служат предметом дискуссий, и в качестве одного из таких механизмов рассматривается ЭМП [16–18]. В связи с этим актуальность приобретают исследования динамики изменений эпителия отделов нефрона при обструктивной уропатии как наиболее часто встречаемой из заболеваний верхних мочевыводящих путей. Модель с односторонней непроходимостью мочеточника (ОНМ) позволяет быстро добиваться терминальной стадии процесса [19].
Цель нашего исследования – изучить в динамике изменения фенотипа эпителиальных клеток нефрона обструктивной почки при односторонней непроходимости мочеточника на экспериментальной модели.
Материалы и методы. Содержание, питание, уход за животными и выведение из эксперимента осуществляли в соответствии с нормативными документами по работе с лабораторными животными в ЦНИЛ РостГМУ. Исследования были разрешены локальным независимым этическим комитетом (протокол № 21/15 от 10.12.2015). Экспериментальная модель ОНМ на 24 взрослых кроликах (самцы в возрасте 3,5 мес. весом 2,4–2,75 кг) воспроизведена по методике E. Giamarellors-Bourbalis et al. [20]. Животные были разделены на 4 группы по 6 животных в каждой: одна контрольная и три экспериментальные в зависимости от сроков механической обструкции (7-е, 14-е и 21-е сутки). Образцы ткани почек для световой микроскопии и иммуногистохимического исследования фиксировали 10%-ным забуференным нейтральным формалином и заключали в парафин по классической методике [21].
Иммунофенотипирование образцов ткани почки, полученных в эксперименте, проводили на маркеры эпителиального фенотипа (цитокератин-7 [СК7] и Е-кадгерин) и мезенхимального фенотипа (виментин [Vim], гладкомышечный актин [α-SMA]). Использовали первичные моноклональные мышиные антитела: Anti-Cytoceratin-7 (Abcam 9021, USA, разведение 1:200), Anti-Е-cadgerin (Abcam 233766, USA, разведение 1:150), Vimentin antibody (Biorbyt 317381, United Kingdom, разведение 1:200), Smooth Muscle Actin antibody (Biorbyt 334169, United Kingdom, разведение 1:250). Для визуализации образовавшихся комплексов антиген-антитело применяли систему детекции EnVision FLEX (Dako, Дания).
Микроскопию и фотосьемку образцов осуществляли на автоматической системе со светодиодной подсветкой Leica DM4000 B LED (Германия). Результаты ИГХ-реакций оценивали по интенсивности окрашивания каждого из маркеров.
Результаты. С 7-х по 21-е сутки происходило прогрессивное снижение цитоплазматического окрашивания СК7 эпителиальных клеток проксимальных, дистальных канальцев и собирательных трубочек. Таким образом, первые признаки изменения фенотипа эпителиальных клеток нефрона имели место уже на седьмые сутки полной ОНМ. К 14-м суткам ОНМ определялось увеличение просвета собирательных трубочек и канальцев нефрона. К 21-м суткам большая часть просвета канальцев была значительно эктазирована, выстлана резко уплощенным эпителием, слабоокрашенным СК7.
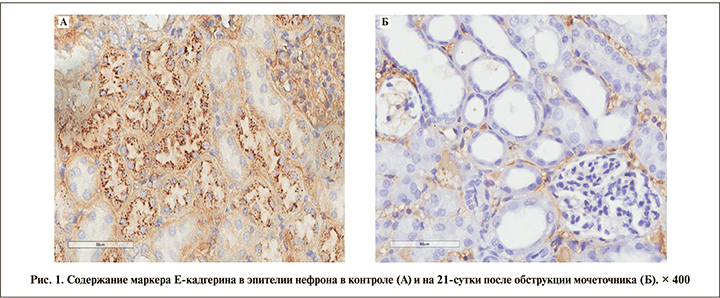
Визуализация E-кадгерина, который относится к кальций-зависимым белкам клеточной адгезии и вовлечен в механизмы регулировки межклеточной адгезии, клеточной подвижности и пролиферации эпителиальных клеток, также снижалась в ходе эксперимента, однако экспрессия маркера была более выраженной в эпителии дистальных извитых канальцев и собирательных трубочек и слабо выражена в эпителии проксимальных извитых канальцев (рис. 1). Уменьшение количества белка Е-кадгерина в эпителии канальцев нефрона по ходу эксперимента привело к диссоциации эпителиальных клеток за счет ослабления межклеточных контактов.
Исследование маркера ранних этапов ЭМП – виментина, который обеспечивает прочность клеток и их устойчивость к механическому стрессу [23], установило, что с увеличением срока ОНМ регистрировалось значительное возрастание числа виментин-позитивных клеток, что подтверждает прогрессирование фиброза интерстиция почки.
Начиная с 7-х суток ОНМ в дистальных извитых канальцах и капсуле клубочка регистрировалось появление актинового белка α-SMA, который является маркером мезенхимального фенотипа (рис. 2 А). С увеличением срока обструкции наблюдалось увеличение количества α-SMA-позитивных клеток, что свидетельствует об усилении синтеза цитоскелетных белков и дисфункции эпителиальных клеток (рис. 2 Б).

Таким образом, уже к 14-м суткам ОНМ имел место еще один признак ЭМП: переход от цитокератиновых промежуточных филаментов к виментиновым. Одновременное наличие маркеров как эпителиального, так и мезенхимального фенотипов в нефронах обструктивной почки указывает на возможность обратимости процессов при устранении повреждающего фактора. Но к 21-м суткам ОНМ регистрировались грубые структурные изменения в нефронах пораженной почки: эктазия просвета канальцев, уплощение эпителия, в дистальных канальцах – кистозная или псевдокистозная трансформация с резкой атрофией эпителиоцитов. В интерстиции, в зонах развития крупных участков межуточного фиброза, преобладали клетки, экспрессирующие Vim и α-SMA.
Обсуждение. Физиологическая адаптация нефрона для поддержания гомеостаза при ОНМ выражается в изменении размеров отделов нефрона, ограничении эффективной площади поверхности для реабсорбции и в изменении длины канальцев, создающих сопротивление потоку образующейся мочи. Есть данные об изменениях в проксимальных канальцах при остром повреждении почек и прогрессировании болезни почек [25]. Переход гипертрофированных нефронов к атрофии и фиброзу уже неадаптивный, если рассматривать его как отклонение от оптимального гомеостатического ответа [26]. Изучение вариаций гено- и фенотипа нефронов при ОНМ дает новое понимание восприимчивости их к нагрузкам на протяжении периода заболевания.
Хроническая обструктивная уропатия, вызванная длительной ОНМ у кролика, морфологически характеризуется интерстициальным фиброзом и эктазией канальцев. Повреждение эпителия приводит к нарушению межклеточных связей как между самими клетками, так и с базальной мембраной, что ведет к нарушению межклеточного взаимодействия, межклеточного транспорта и незащищенности клеток от механического напряжения.
По результатам нашего исследования, первые признаки ЭМП проявились к 7-м суткам в виде снижения визуализации маркеров эпителиального фенотипа с сохранением функций нефрона. К 14-м суткам имела место полномасштабная перестройка морфофункциональных свойств эпителиальных клеток нефрона обструктивной почки. К этому сроку в почечных канальцах отмечалась визуализация маркеров как эпителиального (СК7, Е-кадгерин), так и мезенхимального (α-SMA и Vim) типа, что говорит об активной конверсии эпителиальных клеток почечных канальцев в виде ЭМП, которые становятся значительным источником миофибробластов при фиброзных изменениях в почках. Прогрессирующий характер перехода эпителиоцитов в клетки мезенхимы определялся к 21-м суткам, что подтверждалось практически полной потерей эпителиальных маркеров и приобретением мезенхимальных маркеров.
С учетом полученных нами результатов исследования можно говорить о том, что длительная ОНМ провоцирует активацию апоптоза и атрофию эпителия или приводит к ЭМП с изменением фенотипа не только клеток нефрона, но и интерстиция. При иммунофенотипировании ткани обструктивной почки имеют место следующие молекулярно-биологические изменения, подтверждающие активное ремоделирование эпителия: 1) снижение визуализации молекул и структур, определяющих эпителиальный фенотип – Е-кадгерина (белка межклеточной адгезии) и СК7 (белка цитоскелета); 2) появление и визуализацию структур, определяющих мезенхимальный фенотип, – белков цитоскелета (Vim, α-SMA). Визуализация в зонах фиброза α-SMA и Vim указывает на повышение количества мезенхимальных клеток (фибробластов) в ходе эксперимента, что в итоге заканчивается дисфункцией почечной ткани.
Заключение. Таким образом, экспериментальная модель односторонней обструкции мочеточника выявила трансформацию фенотипа клеток канальцев нефрона от эпителиального к мезенхимальному.
Несмотря на массу работ о роли перехода от эпителия к мезенхиме в патогенезе заболеваний почек, в последнее десятилетие произошла революция в нашем понимании о пластичности клеток почки. Однако вопрос о роли и степени участия ЭМП в фиброзе почек на сегодня остается до конца неясным. Понимание данного механизма может пролить свет еще на одно звено в патогенезе этого процесса. Изучение ранних молекулярно-биологических маркеров ЭМП открывает перспективы для развития таргетной терапии фиброза почки.



