Актуальность. Проблема пролапса гениталий (ПГ) сохраняет актуальность в связи с ростом заболеваемости, приобретающей масштаб скрытой эпидемии, с существенным влиянием на здоровье женщин, приводящим к ухудшению их качества жизни, социальной дезадаптации и снижению трудоспособности [1, 2]. Актуальность проблемы ПГ обусловлена не только увеличением ее встречаемости, но и высокой частотой рецидивов после оперативного лечения. В случае использования собственных тканей для коррекции ПГ частота рецидивов может достигать 40%, при установке синтетических имплантатов варьируется в пределах от 1,6 до 29% [3, 4].
Пролапс гениталий – полиэтиологичное заболевание. Возникновение дефектов в структурах тазового дна обусловлено двумя основными причинами: чрезмерной нагрузкой и анатомической слабостью тканей, осуществляющих поддержку органов малого таза у женщин в физиологическом положении [5]. Среди факторов риска развития ПГ у женщин выделяют следующие: наличие симптомокомплекса дисплазии соединительной ткани (ДСТ), особенности репродуктивной функции (наличие родов в анамнезе; число родов); травма тазового дна в анамнезе и родовой травматизм; ранняя менопауза и гипоэстрогения; наличие заболеваний, приводящих к длительному повышению внутрибрюшного давления; тяжелый физический труд с повышение внутрибрюшного давления [6–8].
Дисплазия соединительной ткани – генетически детерминированный процесс, в основе которого лежат мутации генов, ответственных за синтез/катаболизм структурных белков соединительной ткани или ферментов, участвующих в этих процессах; количественное изменение образования полноценных компонентов экстрацеллюлярного матрикса (ЭЦМ); нарушения фибриллогенеза [9].
Прочность и долговечность соединительной ткани обеспечивают коллагеновые волокна, деградация которых происходит при участии матриксных металлопротеиназ (ММП). Фибробласты поддерживают структурную целостность всех компонентов соединительной ткани (протеогликанов гелеобразной среды, коллагеновых и эластиновых волокон) и секретируют все ферменты, необходимые для формирования и ремоделирования соединительной ткани (металлопротеиназы и др.). Известно, что эстрогены и прогестерон влияют на формирование межклеточного матрикса и его основного компонента – коллагена [10, 11].
Как свидетельствуют результаты ряда исследований [12–14], при ПГ развивается несостоятельность соединительной ткани в результате качественных преобразований коллагенового каркаса и эластина, нарушения регулирующих их синтез ферментов и изменения других компонентов межклеточного вещества.
Биологическая основа развития ПГ и его рецидива до сих пор не ясна. Приоритетным научным направлением в изучении механизмов прогрессирования ПГ в мире считается углубленный анализ этиологии и патогенеза заболевания, большинство аспектов которого остаются дискуссионными [12].
В настоящее время перспективным направлением медико-биологических исследований является изучение эпителиально-мезенхимального перехода (ЭМП) [15]. Последний участвует в разнообразных биологических процессах: нормальном эмбриогенезе, фиброзировании, канцерогенезе. В результате ЭМП 2-го типа эпителиальные клетки превращаются в фибробласты и миофибробласты, впоследствии образующие волокна ЭЦМ [15, 16]. Признаком ЭМП служит снижение экспрессии в клетках эпителиальных маркеров и повышение мезенхимальных. В качестве первых обычно используют Е-кадгерин, в качестве вторых – N-кадгерин, виментин, фибронектин [15, 17].
В связи с вышесказанным выявление особенностей содержания коллагена, протеогликанов ЭЦМ, ММП и мезенхимальных маркеров ЭМП (виментина и гладкомышечного актина), возможно, расширит представления о патогенезе ПГ в субклиническом развитии и клинической манифестации заболевания.
Цель исследования: изучить корреляцию клинической стадии генитального пролапса с гистологической структурой и данными иммуногистохимического (ИГХ) исследования стенки влагалища.
Материалы и методы. Исследование выполнено на клинических базах кафедры урологии и нефрологии, кафедры хирургии, акушерства и гинекологии ФДПО ФГБОУ ВО РязГМУ Минздрава России, Центральной патологоанатомической лаборатории ФГБНУ НИИ морфологии человека и кафедры патологической анатомии и клинической патологической анатомии № 2 ФГБОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России.
В исследование включены 60 женщин пери- и постменопаузального возраста (средний возраст – 61,9±8,4 года), оперированных по поводу ПГ II–IV стадий по классификации POP-Q или по поводу стрессовой формы недержания мочи, имевших сопутствовавшее цистоцеле I–II стадий без показаний к операции по поводу ПГ. Во время операций пациенткам выполнили биопсию передней стенки влагалища на расстоянии 2 см от уретры по средней линии (размеры биоптата – 1×1×0,5 см). Все пациентки давали письменное информированное согласие на взятие биопсии и участие в исследовании.
В зависимости от стадии ПГ биопсийный материал был разделен на две группы. В 1-ю группу вошло 30 образцов с I и II стадиями ПГ во 2-ю – также 30 образцов с III стадией и выше.
Группу сравнения (3-я группа) составили 20 пациенток без ПГ (средний возраст – 63,4±11,0 лет), которым проведена гистерэктомия с односторонним и/или двусторонним удалением придатков матки по поводу доброкачественных новообразований матки и яичников (миома матки, цистаденомы, зрелые тератомы яичников), генитального эндометриоза. Критерии исключения из исследования: беременность, облучение малого таза в анамнезе, тяжелые сопутствующие соматические заболевания, ставшие абсолютным противопоказанием к оперативному лечению, острые воспалительные процессы органов малого таза, злокачественные и предраковые заболевания гениталий.
Всем пациенткам в предоперационном периоде было проведено комплексное клиническое, лабораторное и инструментальное обследование. Клиническое обследование включило сбор анамнеза, общий осмотр пациентки с оценкой состояния эндокринной, нервной, сердечно-сосудистой, дыхательной, пищеварительной, мочевыделительной и половой систем. Всем пациенткам определен уровень эстрадиола в крови; во всех случаях выполняли УЗИ органов малого таза и мочевыделительной системы, а также промежностное сканирование.
При гинекологическом обследовании оценку степени пролапса проводили в покое и при натуживании с определением ведущей точки пролапса по классификации POP-Q (pelvic organ prolapse quantification), предложенной Международным обществом по удержанию мочи (ICS, 1996).
Выявление и определение степени выраженности ДСТ у каждой пациентки проводили по балльной шкале, предложенной Л. Н. Аббакумовой (2006) [18]. При первой степени тяжести ДСТ (вариант нормы) сумма баллов не превышает 12, при умеренной – 23, при выраженной степени тяжести составляет 24 и более.
Образцы тканей влагалищной стенки подвергали гистологическому и ИГХ-исследованиям для определения тканевого содержания коллагена типа I, III; ММП-1 и -2, тканевого ингибитора металлопротеиназ-1 (ТИМП-1), виментина и гладкомышечного актина.
Биоптаты фиксировали в нейтральном формалине (10%) на протяжении 24 ч с дальнейшей проводкой по батарее спиртов возрастающей концентрации заливали в гомогенизированный парафин с температурой плавления 54°С. Для гистологического и ИГХ-анализа серийные срезы толщиной 5 мкм монтировали на стекла, покрытые поли-L-лизином (Menzel SuperFrost UltraPlus). Препараты для обзорных исследований окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону и фукселином по Вейгерту.
Иммуногистохимическое окрашивание выполняли на парафиновых срезах ткани с использованием антител к MMП-1, -2, ТИМП-1 (1:100 «Novocastra», Великобритания) и системы детекции NovoLink («Novocastra», Великобритания), к коллагенам типа I, III (поликлональные антитела, 1:300, Dako Cytomation), виментину и гладкомышечному актину (1:100, Dako Cytomation). Депарафинизированные срезы обрабатывали в цитратном буфере рН 6.0. Выявление иммунных комплексов проводили безбиотиновой системой детекции на основе пероксидазы хрена («BioGenex», США). Для демаскировки антигенов депарафинизированные срезы обрабатывали в микроволновом режиме при мощности 650 Вт 2 раза по 5 мин с использованием восстанавливающего раствора pH 6,0 («Dako», Дания) (Dako Protocols). Ядра клеток докрашивали гематоксилином Майера.
Интенсивность иммунного окрашивания оценивали визуально как коричневое окрашивание ЭЦМ, гладкомышечных клеток и эндотелия сосудов. С помощью полуколичественного метода по проценту окрашенных клеток или окрашенного ЭЦМ и интенсивности окраски оценивали в баллах: 2 балла – менее 20% окрашенного ЭЦМ/клеток, 4 – от 20 до 40%, 6 баллов – более 40%.
Статистическую обработку массива данных проводили на персональном компьютере с помощью электронных таблиц Microsoft Excel и пакета прикладных программ Statistica for Windows v. 7.0 («StatSoft Inc.», США). Рассчитывали следующие показатели: среднее арифметическое (М); стандартное отклонение (СО); коэффициент вариации; асимметрию и эксцесс с оценкой их репрезентативности по t-критерию Стьюдента; коэффициент корреляции (r); степень вероятности возможной ошибки (p). При оценке существенности различий между средними величинами вычисляли коэффициент достоверности по критериям Стьюдента. За уровень достоверности была принята вероятность различия 95% (р=0,05). Для выявления доли факториального и случайного влияния проводили дисперсионный анализ полученных результатов.
Результаты. Группы исследования были сопоставимыми по возрасту и распределению по возрастным группам (p>0,05; табл. 1).

При оценке фенотипических признаков ДСТ и степени ее тяжести в 1-й группе легкая степень тяжести ДСТ диагностирована 10 (33,3%) пациенткам, умеренная – 13 (43,3%) и выраженная – 7 (23,4%); во 2-й группе – 11 (36,7%), 13 (43,3%) и 6 (20%) соответственно, в 3-й группе – 10 (50%), 8 (40%) и 2 (10%) соответственно. В 3-й группе статистически значимо чаще (p≤0,05) выявляли легкую степень тяжести ДСТ, реже – выраженную.
Средняя продолжительность заболевания в 1-й группе составила 7,7±5,5, во 2-й – 7,5±6,0 лет (p>0,05).
Особенностей в становлении менструальной функции в группах нами не отмечено. В постменопаузе находились 86,7% пациенток 1-й и 2-й групп и 85,0% – 3-й (p>0,05). При этом средний возраст наступления менопаузы в 1-й группе составил 49,4±3,4 года, во 2-й – 50,2±3,3 и в 3-й – 50,5±3,7 года (p>0,05); средняя длительность постменопаузы – 10,9±8,4, 10,2±8,6 и 10,6±9,4 года соответственно (p>0,05).
Анализ анамнестических данных выявил, что среди пациенток 1-й и 2-й групп не было нерожавших. Двадцать одна (70%) пациентка 1-й, 23 (76,7%) –2-й и 8 (40,0%) – 3-й групп имели в анамнезе двое и более родов (p>0,05).
Средний уровень эстрадиола в крови пациенток 1-й группы составил 154,1±127,6 пмоль/л, 2-й – 149,9±110,8 и 3-й группы – 144,7±110,3 пмол/л (p>0,05).
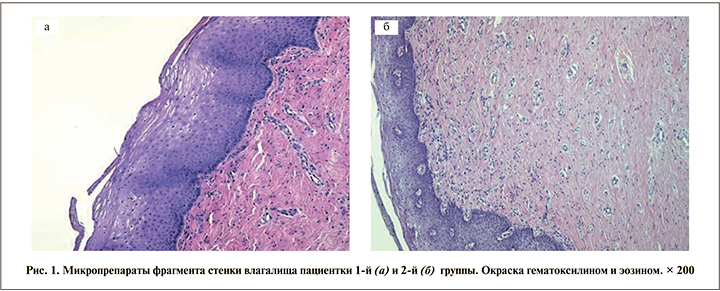
 При морфологическом исследовании биоптатов стенок влагалища пациенток 1-й и 2-й групп отмечалась однотипная картина морфологии эпителиального и субэпителиального компонентов. Со стороны эпителия имели место очаговые, местами и очагово-диффузные атрофические изменения эпителиального пласта, с фокусами акантоза, паракератоза и участками койлоцитоза. Субэпителиально определялись очагово-диффузная мононуклеарная инфильтрация, утолщение волоконного каркаса, умеренно выраженный сосудистый рисунок (рис. 1).
При морфологическом исследовании биоптатов стенок влагалища пациенток 1-й и 2-й групп отмечалась однотипная картина морфологии эпителиального и субэпителиального компонентов. Со стороны эпителия имели место очаговые, местами и очагово-диффузные атрофические изменения эпителиального пласта, с фокусами акантоза, паракератоза и участками койлоцитоза. Субэпителиально определялись очагово-диффузная мононуклеарная инфильтрация, утолщение волоконного каркаса, умеренно выраженный сосудистый рисунок (рис. 1).
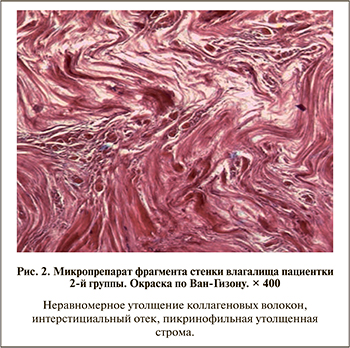
Пациентки 2-й группы в отличие от женщин 1-й и 3-й групп имели значительные изменения соединительнотканного каркаса, коллаген в виде волокнистой массы с участками разрежения. При окраске по Ван Гизону вышеописанные участки характеризовались фуксинофилией (рис. 2).
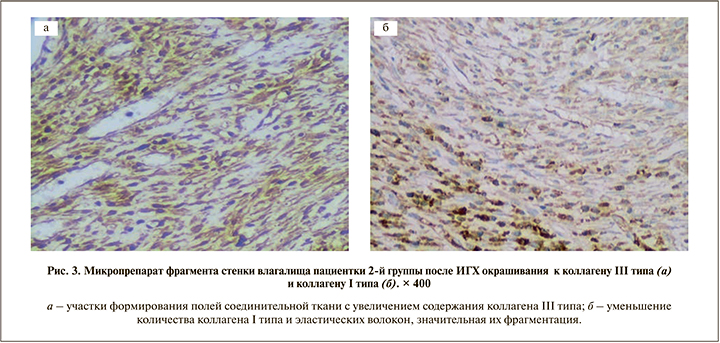
Отмечались участки рубцевания соединительной ткани с увеличением содержания коллагена III типа (рис. 3 а), уменьшением количества коллагена I типа и эластических волокон со значительной их фрагментацией (рис. 3 б). Кроме того, у пациенток с выраженными (III–IV) стадиями ПГ выявлялись деградация волокон коллагена с уменьшением прочности соединительной ткани и уменьшение ее эластичности. У пациенток с ПГ и выраженной стадией ДСТ в 84,6% образцов выявлялись набухание коллагеновых волокон с дискомплексацией и дезорганизацией их и выраженный периваскулярный отек (рис. 4).
В 3-й группе сравнения отмечалось преобладание коллагена I типа, выраженное в высоком индексе соотношения коллагенов I и III типов (табл. 2).
Женщин с ПГ отличал низкий индекс соотношения коллагенов I и III типов, превалирование содержания коллагена III типа в 1-й и 2-й группах свидетельствовало о снижении механической прочности тканей стенки влагалища. Анализ содержания коллагенов в стенке влагалища пациенток с начальными (I–II) стадиями ПГ выявил достоверное увеличение содержания коллагена I типа (р=0,0003) и уменьшение – III типа (р=0,045) по сравнению с таковым при выраженных (III–IV) стадиях ПГ.
Экспрессию ММП-1 и -2 определяли как коричневое окрашивание ЭЦМ, гладкомышечных клеток и эндотелия сосудов (рис. 5–8).
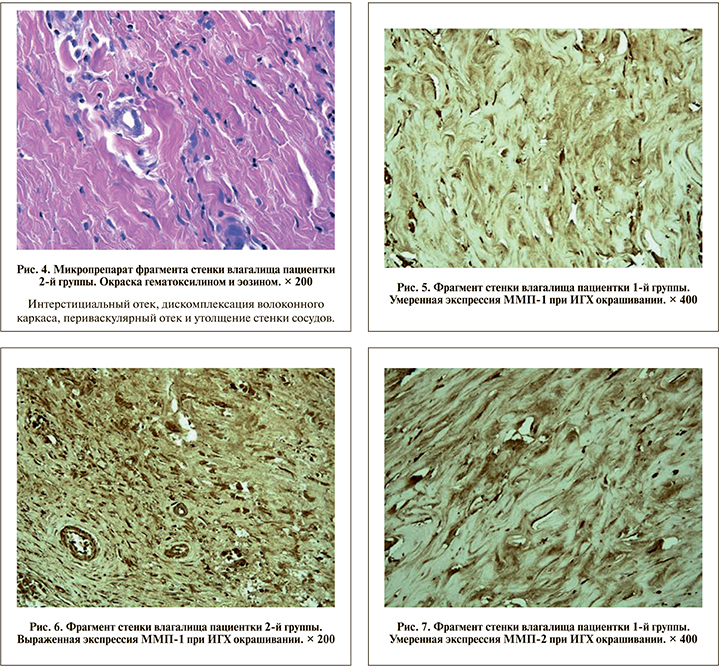
 Биоптаты стенок влагалища пациенток с ПГ характеризовались повышенной металлопротеиназной активностью по сравнению с группой контроля. Уровень ММП-1 и -2 при ПГ превышал показатель накопления фермента в группе сравнения в 1,7 раза (p<0,05; табл. 3). Содержание ТИМП-1, окрашенного в цитоплазме фибробластов, эпителиальных и эндотелиальных клеток и в ЭЦМ в коричневый цвет, в 1-й группе было снижено в 1,5 и в 2,2 раза относительно показателей 2-й и 3-й групп соответственно. Однофакторный дисперсионный анализ содержания ММП-1 и -2 у пациенток 1-й и 2-й групп выявил достоверное (р=0,04) снижение их активности при выраженных (III–IV) стадиях ПГ. Проведенная оценка уровня накопления ММП-1, -2 и ТИМП-1 в исследуемых группах указывает на превалирование процессов деградации в соединительной ткани стенки влагалища при ПГ.
Биоптаты стенок влагалища пациенток с ПГ характеризовались повышенной металлопротеиназной активностью по сравнению с группой контроля. Уровень ММП-1 и -2 при ПГ превышал показатель накопления фермента в группе сравнения в 1,7 раза (p<0,05; табл. 3). Содержание ТИМП-1, окрашенного в цитоплазме фибробластов, эпителиальных и эндотелиальных клеток и в ЭЦМ в коричневый цвет, в 1-й группе было снижено в 1,5 и в 2,2 раза относительно показателей 2-й и 3-й групп соответственно. Однофакторный дисперсионный анализ содержания ММП-1 и -2 у пациенток 1-й и 2-й групп выявил достоверное (р=0,04) снижение их активности при выраженных (III–IV) стадиях ПГ. Проведенная оценка уровня накопления ММП-1, -2 и ТИМП-1 в исследуемых группах указывает на превалирование процессов деградации в соединительной ткани стенки влагалища при ПГ.
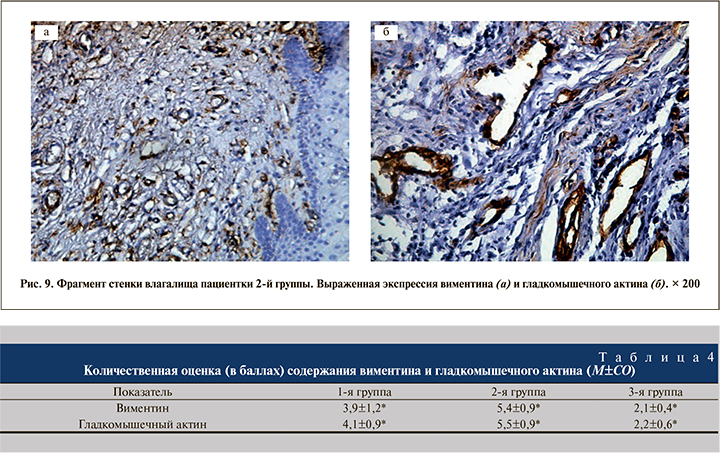
У женщин 2-й группы в биоптатах стенки влагалища отмечалась достоверно (р<0,05) более выраженная экспрессия виментина и гладкомышечного актина в соединительной ткани (рис. 9 а) по сравнению с двумя другими группами. Так, содержание виментина во 2-й группе было в 1,4 и 2,6 раза выше, чем в 1-й и 3-й соответственно (табл. 4).
Виментин определялся преимущественно диффузно в строме, гладкомышечный актин – периваскулярно и очагово в соединительнотканной строме (рис. 9 б).
В группе сравнения экспрессия вышеуказанных маркеров в стенке влагалища была минимальной и очаговой. Эти данные свидетельствуют о преобладании процессов деградации в соединительной ткани у женщин при ПГ.
Обсуждение. Приоритетной научной задачей перинеологии является изучение механизмов прогрессирования ПГ, решение которой возможно только при углубленном изучении этиологии и патогенеза ПГ. Необходимо отметить, что морфологические и иммуногистохимические аспекты изменений тканей тазового дна остаются предметом дискуссий [5, 6].
A. M. Meijerink et al. [19] доказали, что прочность фибрилл в соединительной ткани зависит от баланса коллагена I, III и V типов. Увеличение количества коллагена III типа приводит к уменьшению прочности и размера фибрилл.
Наши данные коррелируют с результатами исследователей, которые отмечают увеличение количества «слабых» с низкой прочностью коллагеновых волокон III типа в стенке влагалища пациенток с ПГ, что нарушает «тазовую поддержку» [12, 20–22]. Помимо дисбаланса коллагена I и III типов при тазовой десценции определяются качественные преобразования: молекулярная дезорганизация и фрагментация коллагеновых волокон в стенке влагалища у женщин с ПГ [23, 24].
Исследование [25] показало, что коллаген III типа является основным фибриллярным коллагеном влагалища пациенток с ПГ независимо от возраста и паритета. Кроме того, общее количество коллагена было увеличено у женщин с ПГ по сравнению с женщинами без ПГ – в основном из-за повышенной экспрессии коллагена типа III. Они предположили, что преобладание коллагена III типа может объяснить повышенную растяжимость тканей влагалища и снижение прочности на растяжение, а следовательно, способствовать прогрессированию заболевания [25].
Не менее важной составляющей поддерживающего аппарата таза наряду с коллагеном является эластин.
В межклеточном веществе соединительной ткани он формирует трехмерную сеть белковых волокон, обеспечивая механическую прочность ткани, и обусловливает прочные контакты между клетками [19]. В ряде исследований при ПГ отмечено ослабление эластического каркаса, что коррелирует с данными нашей работы [12].
Ремоделирование компонентов соединительной ткани стенок влагалища при ПГ катализируется ММП. Ряд авторов отмечали увеличение уровня ММП-1 и -2 при ПГ, вызывая недостаточность коллагена I типа, что нашло отражение в проведенной нами работе [12, 22]. Однако у пациенток с поздними стадиями ПГ повышение содержания коллагена связано со снижением активности ММП-2, что свидетельствует о снижении метаболической активности соединительной ткани у этих пациенток [26].
M. K. Boreham et al. [27] показали меньшую экспрессию гладкомышечного актина в мышечной оболочке пациенток с ПГ. Исследователи предполагают, что это может быть следствием потери дифференцировки клеток гладких мышц или результатом апоптоза клеток гладкой мускулатуры. Таким образом, авторы продемонстрировали факт вовлеченности в патогенез ПГ гладкомышечных клеток.
В проведенном нами исследовании выявлена обратная зависимость в виде выраженной экспрессии гладкомышечного актина и виментина в соединительной ткани пациенток с ПГ. При этом более поздние стадии ПГ сопровождались значимым увеличением экспрессии маркеров мезодермальной ткани – гладкомышечного актина и виментина.
Рассуждая о роли ЭМП в патогенезе ПГ, можно выдвинуть следующую гипотезу. Повреждение стенки влагалища, в том числе эпителия, сопровождается разрушением эпителиальных межклеточных контактов и связей между клетками и базальной мембраной, что может приводить к ЭМП с экспрессией мезенхимальных генов и миграцией фенотипически измененных клеток в интерстиций, где эти клетки приобретают свойства миофибробластов. Посредством экспрессии ММП запускается процесс фиброзирования с дисбалансом и дезорганизацией коллагеновых волокон и эластина, что обусловливает уменьшение эластичности, растяжимости и прочности соединительной ткани. Длительное воздействие повреждающего фактора, развитие ЭМП и фиброза в стенке влагалища с ослаблением ее прочности могут стать причиной формирования «порочного круга», что способствует непрерывному прогрессированию ПГ.
Заключение. В ходе настоящего исследования установлено, что у пациенток с выраженными (III–IV) стадиями ПГ по сравнению с пациентками с начальными (I–II) стадиями ПГ имеет место статистически значимое (р<0,05) увеличение количества коллагена III типа, уменьшение содержания коллагена I типа, эластических волокон, уменьшение активности ММП-1 и -2 на фоне усиления экспрессии виментина и гладкомышечного актина. Эти данные свидетельствуют о том, что при ПГ преобладают процессы фиброзирования и деградации соединительной ткани стенки влагалища, а изменения, наблюдаемые в ней, служат следствием, но не причиной ПГ. Усугубление дегенеративных изменений в соединительной ткани приводит к прогрессированию ПГ.



