Актуальность. Урогенитальный синус (УГС) – слияние влагалища с уретрой в общий канал, открывающийся в промежность – является одной из редких форм аноректальных мальформаций (АРМ), возникает в результате неполного разделения мочеиспускательного канала и влагалища во внутриутробном периоде. УГС возникает в результате недостаточной активности 21-гидроксилазы, встречается у 1:5000–25000 ребенка среди родившихся [1]. Аномалия впервые описана в работах Hendren и включена в группу редких региональных вариантов АРМ [2]. УГС часто сочетается с нарушениями дифференцировки половых органов в виде внешней вирилизации при врожденной гиперплазии надпочечников (ВГН). Комплексные дооперационные исследования с включением уретроцистовагиноскопии и рентгенконтрастных методов необходимы для определения анатомической формы УГС и выбора метода оперативной коррекции [3]. Вирилизация наружных половых органов может варьироваться от легкой клиторомегалии без слияния лабиоскротальных складок (Prader I) до полной маскулинизации наружных половых органов (Prader V) [4]. Наблюдаются изолированные формы без явных внешних генитальных аномалий. Данная аномалия устанавливается поздно, когда у пациенток возникают проблемы с менструацией или развиваются осложнения [5]. УГС, как правило, включают в состав персистирующей клоаки [6].
Цель исследования – проанализировать результаты диагностики и оперативной тактики при врожденном урогенитальном синусе.
Материалы и методы исследования. В клинических базах кафедры госпитальной детской хирургии с курсом онкологии ТашПМИ в 2009–2019 г. на обследовании и лечении находились 9 девочек с урогенитальным синусом, что составило 3,5% в общей структуре среди девочек с АРМ и свидетельствует о редкости данной аномалии.
Всем больным проводили комплексные клинические и специальные методы (уретроцистовагиноскопия, контрастные исследования урогенитальной системы, МСКТ, УЗИ) исследования для идентификации анатомической формы основной аномалии и определении ассоциированных аномалий.
Результаты. Больные поступили в клинику с направительными диагнозами: ложный гермофродитизм – 3, гипоспадия – 2, гипертрофия клитора – 1, атрезия влагалища – 1, эктопия уретры – 1, клоака – 1. Основанием для установления этих диагнозов стала неадекватная трактовка выявленных у пациенток признаков нарушения половой дифференцировки в виде вирилизации различной степени выраженности. Ни в одном случае не установлен правильный диагноз, что, видимо, связано с отсутствием настороженности и достаточных знаний о УГС у врачей первичного звена здравоохранения. При госпитализации и установлении правильного диагноза в клинике больные были в возрасте: 1–3 года – 4; 4–7 лет – 5. Это самое запоздалое установление правильного диагноза детям среди других форм АРМ.
При объективном осмотре в клинике для определения степени выраженности вирилизации по Prader из 9 пациенток у 2 (22,2%) изменения расценены как I степень (небольшая гипертрофия клитора без вирилизации, вход во влагалище, развитие малых и больших половых губ нормальные); 4 (44,5%) установлена II степень (клитор с головкой, кавернозными телами, большие половые губы увеличены, малые – недоразвиты, вход во влагалище сужен); 3 (33,3%) больным – III степень (гипертрофированный клитор с головкой и крайней плотью, напоминающий половой член, большие половые губы как мошонки, общее отверстие урогенитального синуса открывается у корня клитора по типу гипоспадии); IV и V степени вирилизации в наших наблюдениях не встречались.
Как известно, влагалище и мочеиспускательный канал при УГС могут соединяться в любом месте вдоль спектра от шейки мочевого пузыря с длинным общим каналом. В зависимости от уровня впадения различают высокую, низкую и промежуточную формы УГС. Критерием считается место слияния уретры и влагалища по отношению к наружному уретральному сфинктеру (НУС) и вертикальная глубина влагалищно-уретрального слияния с промежностью [7]. При высоком УГС влагалище соединяется с уретрой проксимально НУС; при промежуточном и низком УГС занимает дистальное положение с разницей длины вертикальной глубины влагалищно-уретрального слияния с промежностью. Окончательное заключение делается на основе измерения длины уретры (расстояние от точки впадения влагалища до шейки мочевого пузыря) и длины общего канала (до меатуса на промежности) по результатам уретроцистовагиноскопии и рентгено-контрастных исследований. Nicolas Seranio et al. (2018) использовали контрастную сонографическую генитозонографию, исключающую ионизирующее излучение, как альтернативный способ традиционной рентгеноскопии для изображения анатомических структур при УГС. Длина общего канала более 3–4 см и уретры менее 1,5–2,0 см соответствует высокой форме УГС [8]. При сравнительном анализе установили, что контрастные исследования точно очертили аномальную анатомию клоаки в 50% наблюдений, при урогенитальном синусе – 85%. Результаты уретроцистовагиноскопии превосходили контрастные исследования: соответственно 75% при аномалиях клоаки, 100% – при УГС [9].
На этапе диагностики в клинике проводили рентгенологические методы или МСКТ-генитографию с контрастированием и уретроцистовагиноскопию. На наш взгляд, комбинация этих методов диагностики повышает информативность в определении анатомической формы УГС, локализации слияния влагалища с уретрой; позволяет достоверно судить о длине общего канала, проксимальной части уретры, вертикальной глубины влагалищно-уретрального слияния от промежности; установить размеры влагалища, наличие дополнительных аномалий (удвоения) и/или рефлексирующих форм нарушения в уретровезикальном сегменте. В наших наблюдениях, по результатам исследования, у 2 девочек слияние влагалища с уретрой соответствовало высокой форме УГС (рис. 1а); у 7 – низкой (рис. 1б).

При высокой форме УГС длина проксимального отдела мочеиспускательного канала составила от 13 до 35 мм, в среднем – 24 мм; вертикальная глубина влагалищно-уретрального слияния с промежностью была от 15 до 25 мм, в среднем 20 мм. При низкой форме УГС длина проксимального отдела мочеиспускательного канала была до 12 мм, в среднем 6 мм. Вертикальная глубина влагалищно-уретрального слияния с промежностью от 10 до 18 мм, в среднем 14 мм. Нами установлено, что степень вирилизации не коррелирует с длиной уретры и глубиной влагалищно-уретрального слияния, что соответствует данным других авторов. Представленные данные свидетельствуют о том, что у 2 пациенток УГС можно расценить как изолированную форму заболевания, у 7 – в комбинации с признаками вирилизации наружных половых органов, связанных с врожденной гиперплазией надпочечников. Поэтому больные были осмотрены эндокринологами, которые провели соответствующие исследования. При цитогенетическом исследовании (кариотипирование лимфоцитов периферической крови) у 8 больных были выявлены признаки, характерные для женского типа, – 46;ХХ. У 1 пациентки кариотип выглядел как 45;X0. Такой вариант кариотипа в виде моносомии лежит в основе синдрома Тернера. У больной объективные данные соответствовали высокой форме УГС, у нее были выявлены и другие характерные клинические признаки данного генетического синдрома.
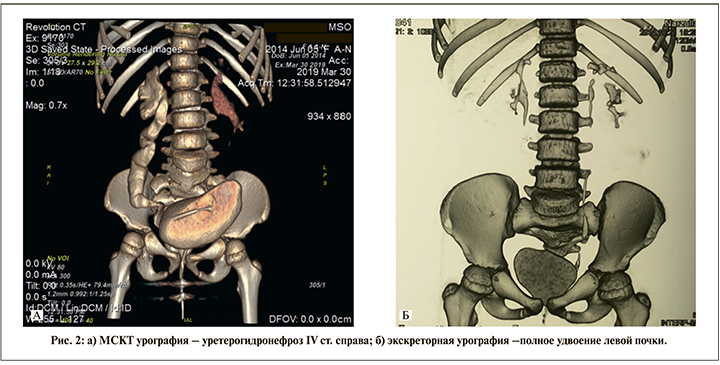
При комплексном обследовании девочек сочетанные аномалии со стороны сердечно-сосудистой системы (ССС) и желудочно-кишечного тракта (ЖКТ) не выявлены, однако урогенитальные и вертебральные аномалии часто встречались. Рентгеноконтрастные исследования позволили выявить сопутствующие урогентитальные аномалии: варианты удвоения почки – у 1 (11,1%) больной, рефлексирующая или стенозирующая форма нарушения уретеровезикального сегмента – у 3 (33,3%) (рис. 2), требующие консервативного, эндоскопического и оперативного лечения в плановом порядке. В двух наблюдениях с высокой формой УГС было выявлено удвоение влагалища: в одном наблюдении – неполное удвоение влагалища, во втором – полное удвоение. По данным МСКТ с контрастированием, были установлены ассоциированные вертебральные аномалии: агенезия копчика, неправильное сращение крестцовых позвонков в изолированном виде, а также в сочетании с гемисакрумом – у 6 (66,7%) больных.
В наших наблюдениях из девяти девочек оперативное вмешательство проведено шести в возрасте от 2 до 7 лет. Родители одной пациентки с II формой отказались от операции, две пациентки ожидают плановой операции после коррекции анемии.
При выборе способа операции учитывались длина общего канала и анатомический вариант (высокая, низкая) УГС. Важным критерием при выборе операции считали расстояние от слияния влагалища и уретры до кожи промежности. Для достижения этих целей проводили тщательную пред-операционную объективную и эндоскопическую оценку анатомии УГС с выявлением места слияния влагалища с уретрой, измерением длины общего канала, вертикальной глубины влагалищно-уретрального слияния. На основании до- и интраоперационных исследований у двух пациенток аномалия расценена как высокая форма, у четырех – низкая. Одному ребенку с низкой формой УГС, с вертикальной глубиной влагалищно-уретрального слияния до 0,6 см выполнили дистальную общую мобилизацию с разделением уретры и влагалища на небольшом протяжении и фиксацией на мобилизованные края кожи промежности. В двух таких же случаях выполнили общую дистальную мобилизацию с разделением уретры от влагалища и расположили их в анатомически правильном положении в промежности, завершив операцию уретро- и вагинопластикой. Одной из пациенток с низким УГС с вирилизацией III степени по ходу пластики клитора мобилизовали дистальный отрезок уретры, создали площадку из слизистой оболочки по Passerini. Через пересечение мобилизованной уретральной площадки на задней ее стенке сделали продольный разрез, через который вывели катетер, вставленный на нижнюю поверхность мобилизованного клитора. Свободные края уретры фиксировали отдельными швами на оставшуюся поверхность клитора после резекции избыточной его части. Свободный край лоскута, перекидывая назад, подшивали к стенке мобилизованного влагалища в поперечном направлении, создавали перегородку между влагалищем и уретрой. Специальную лабиопластику не проводили. При высоком УГС двум девочкам выполнили раздельную катетеризацию мочевого пузыря и влагалища. Одной из них катетером Фолея через общий канал провели проксимальную общую мобилизацию синуса до лобно-уретральной связки с отделением уретры от влагалища с последующим его низведением на промежность. Другой девочке вагинопластику провели с замещением недостающей части местными кожными лоскутами. Края разделенной уретры и влагалища ушивали к прилегающим участкам мобилизованной кожи промежности.
Из шести оперированных ни в одном случае не возникла необходимость в наложении превинтивного противоестественного заднего прохода до и после операции, так как больным проводили тщательную подготовку и деконтоминацию кишечника. В послеоперационном периоде местно использовали УФО и лазеротерапию. Уретральный катетер в мочевом пузыре оставляли на 8–10 сут., ежедневно промывали мочевой пузырь раствором диоксидина.
Ранний послеоперационный период у всех больных протекал без осложнений. При осмотре через 3 мес. со стороны пациенток, перенесших операции по поводу низких форм УГС, жалоб не было, анатомическая структура промежности ближе к норме, нарушения акта мочеиспускания не отмечено. Из двух девочек, оперированных с высокой формой заболевания, у одной выявлены явления стеноза у входа во влагалища, который удалось ликвидировать после 3-кратного бужирования. У второй девочки, перенесшей операцию типа Hendren и Crawford (1969), вагинопластику с использованием кожных перинеальных лоскутов, развилась умеренная рубцовая деформация промежности и стенозирование влагалища, потребовавшие проведения повторных курсов физиотерапевтических процедур и бужирования. Все пациентки находятся под наблюдением без ухудшения местного статуса после оперативной коррекции.
Коррекция сочетанных аномалий при УГС подбирается индивидуально с учетом их характера, одной девочке с уретерогидронефрозом верхней половины удвоенной левой почки с эктопией мочеточника в промежность проведена геминефроуретерэктомия. Больные рефлексируюшим уретерогидронефрозом получают консервативное лечение, находятся под активным наблюдением.
Обсуждение. Целью оперативного лечения больных УГС является низведение общего канала на промежность без натяжения и формирование на ней двух отверстий: уретрального меатуса и вход во влагалище. Hendren и J. Crawford (1969) обосновали необходимость отделения влагалища с последующим его низведением и замещением недостающей части кожными лоскутами. Данное вмешательство осуществлено через промежностный доступ, технически сложный и чреватый нарушением кровоснабжения влагалища и/или недостаточной его мобилизацией и низведением с натяжением, что нередко приводит к рубцеванию и стенозированию уретры и влагалища.
Способы оперативного лечения постоянно совершенствуются. Так, A. Pena для реконструкции УГС использовал задний сагиттальный трансаноректальный доступ (PSTA), который обеспечивает хороший обзор, позволяет свободно мобилизовать влагалище и низвести его на промежность [14]. Недостатки операции: рассечение задней и передней стенок ануса и прямой кишки с полным пересечением аноректального сфинктера. Кроме того, операция проводится после предварительного наложения колостомы, которую требуется в последующем закрыть. Rink et al. (1977) рекомендовали свой способ коррекции УГС [15]. Он отличается от операции A. Pena et al. тем, что прямую кишку не вскрывают, а отводят ретрактором вверх. Это позволяет улучшать обзор при мобилизации передней стенки влагалища от проксимальной уретры и шейки мочевого пузыря. Domini et al. (1979) предложили аналогичный вариант мобилизации общего канала с использованием переднего сагиттального трансаноректального доступа (ASTRA).
Феминизирующую генитопластику (клиторо-, лабио- и вагинопластика) проводят в случаях высокой вирилизации (Prader III–V) только в специализированных центрах с учетом восстановления косметического эффекта и сексуальной функции [16].
Основным принципом оперативного лечения при УГС является дистальная или тотальная мобилизация синуса, уретры и влагалища единым блоком или после мобилизации синуса – отделение уретры от влагалища и низведение на промежность. Метод оперативной коррекции выбирают с учетом длины общего канала, анатомии УГС, характера сочетанных аномалий [12]. Простой вагинопластики достаточно в лечении при низком УГС. При высокой форме необходимы более обширные мобилизации, отделение влагалища от уретры и низведение с использованием заднего сагиттального трансаноректального (PSTA), переднего сагиттального трансаноректального доступа (ASTRA) или с помощью дистальной или тотальной урогенитальной мобилизация (ТУМ) [13].
Сроки операции при УГС остаются дискутабельными. Некоторые исследователи считают, что все компоненты операции следует проводить в комбинации в период новорожденности. Другие считают, что целесообразно отложить операции до наступления половой зрелости. Существуют сторонники выполнения клиторо- и лабиопластики в неонатальном периоде, а вагинопластику откладывать до полового созревания. Европейское общество детской эндокринологии рекомендует проводить оперативное вмешательство в возрасте от 2 до 6 мес. пациенткам с высоким слиянием и завершать все этапы операции начиная к 12 мес., не доводя до подросткового возраста [10]. Выполнение вмешательств больным в постпубертатном возрасте отличалось большей трудностью и длительностью, чем маленьким детям, в связи с повышенной кровоточивостью тканей и сложностью нахождения нужного для диссекции слоя.
К тому же младенцам часто удавалось свободно низводить влагалище на промежность без привлечения кожных лоскутов, хотя длина общего канала была не менее 3 см [11].
Заключение. Можно отметить, что неправильная трактовка нарушений дифференцировки наружных половых органов без затруднения оттока мочи у девочек из-за недостаточной осведомленности врачей служит причиной поздней постановки правильного диагноза. Верификация анатомических форм аномалии требует комплексного обследования, результаты которого служат критерием при выборе оперативной коррекции. В литературе появляются сообщения о новых способах диагностики и корригирующих операций, позволяющих улучшать результаты лечения.



