Введение. Аномалии уретеровезикального сегмента мочеточника у детей в виде пузырно-мочеточникового рефлюкса (ПМР) и обструктивного мегауретера (ОМ) в части случаев требуют оперативного лечения.
Внутрипузырные Cohen [1] и внепузырные Lich-Gregoir [2] подходы (открытые, лапароскопические, робот-ассистированные), применимые в отсутствие существенной дилятации мочеточников, дают наилучшие исходы. Когда реимплантация мочеточников в мочевой пузырь должна производиться при тяжело дилятированном мочеточнике, необходима реконструкция его дистального сегмента. И после реконструкции такой мочеточник, как правило, уже невозможно и нецелесообразно прецизионно имплантировать в зону треугольника Льето.
Еще более сложной представляется задача повторной реимплатации тяжело дилятированного мочеточника после неудачной реимплатации, выполненной по поводу обструкции уретеровезикального сегмента или везикоуретерального рефлюкса.
Исторически предпосылки поиска альтернативных технологий реимплатции расширенного мочеточника основаны на низкой эффективности операции Politano-Leadbetter, успех при которой, по данным Williams et al., достигался только в 37% случаев [3]. Bradic проанализировал собственные результаты использования техник Bischoff, Paquin, Williams и Politano-Leadbetter при имплантации расширенного мочеточника и сообщил об успехе в 47% случаев [4].
Более поздние модификации коррекций расширенного мочеточника Daines и Hodgson [5], Kalicinski et al. [6], Starr [7], Heljuant et al. [8], подлежащего реимплантации, повысили успешную функцию уретероцистоанастомоза (до 84,6%), снизив частоту рецидива рефлюксов и стенозов [9, 10].
Лапароскопические и пневмовезикоскопические реконструкции тяжело расширенных мочеточников сократили потерю крови, использование послеоперационной анальгезии, койко-день, однако не снизили уровень осложнений и не увеличили успешность операции [11, 12].
Еще в 1975 г. хорватский детский хирург Bradic опубликовал методику антирефлюксной реимплантации мочеточника при ПМР в верхушечную область мочевого пузыря и ее первые результаты [13]. Впоследствии им и его коллегами был проведен опыт экстрапузырного антирефлюксного уретероцистоанастомоза у 668, а затем у 1280 детей с ПМР и успешностью в 93,5% случаев [14]. Преимущество имплантации мочеточника в верхушечную область мочевого пузыря авторы видели в том, что тяжелые рефлюксные мегауретеры, встречающиеся у детей первых 2 лет жизни, затруднительно имплантировать в малые объемы мочевого пузыря с выраженной гипертрофией детрузора, что снижает успешность операции в 50% наблюдений, и, напротив, предлагаемый Bradic участок мочевого пузыря для имплантации расширенного мочеточника более доступен визуальному контролю и тем самым повышает прецизионность техники хирургии.
Цель исследования: оценить эффективность и безопасность антирефлюксного уретероцистоанастомоза, производимого внепузырно по методике Bradic детям с рецидивным обструктивным мегауретером.
Материалы и методы. В основу работы положен опыт оперативного лечения ОМ у пятерых детей в возрасте 1—4 лет, четырех мальчиков и одной девочки с рецидивной обструкцией уретеровезикального сегмента после ранее выполненной реимплантации мочеточника по поводу обструкции уретеровезикального сегмента и пузырномочеточникового рефлюкса (см. таблицу). Антенатально поражение уретеровезикального сегмента диагностировано у 2 пациентов.
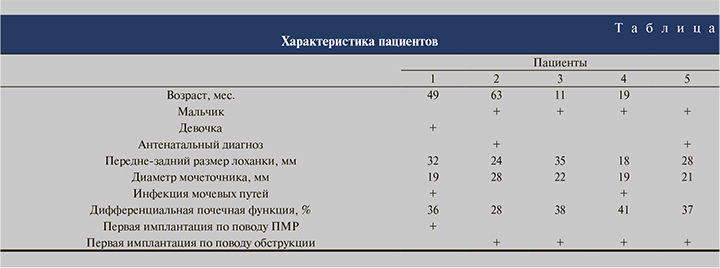
Во всех случаях обследование включало анализ мочи, ее культуральное исследование, УЗИ почек и мочевых путей, динамическую компьютерную нефросцинтиграфию, микционную цистографию, по показаниям - в/в урографию, СКТ почек.
Техника операции:
Больной находится на операционном столе лежа на спине с сомкнутыми ногами.
1. Дугообразный разрез в подвздошной области проводится со стороны пораженного мочеточника, проксимальный конец разреза достигает верхнего края подвздошной кости, дистальный - срединной линии тела на 2 см выше лона (рис. 1).
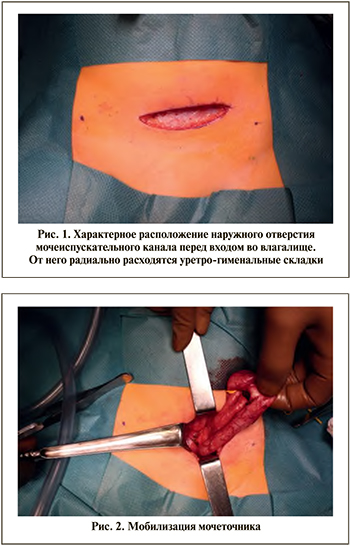
2. Мочеточник визуализируют забрюшинно на уровне подвздошных сосудов. Выделяют его из клетчатки с сохранением сосудистой ножки и, продвигаясь в дистальном направлении вплоть до мочевого пузыря в случае ПМР или до сужения в юкставезикальном отделе в случае обструктивного мегауретера, поперечно пересекают мочеточник. При стриктуре резецируют суженный участок. Культю мочеточника прошивают, перевязывают либо клипируют (рис. 2).
3. Дилятированный мочеточник высвобождают из перегибов путем пересечения деформирующих спаек на протяжении дистальной и средней третей.
4. Путем сопоставлений дистальной трети мочеточника и верхушечной зоны мочевого пузыря определяют наличие избыточности длины мочеточника и резецируют его по длине, продольно рассекают мочеточник по антибрыжеечному краю на протяжении 4-5 см (в пределах дистальной трети) и резецируют его по ширине так, чтобы сформировать его обуживание, адекватное возрасту пациента. Если планируется внутренний диаметр, скажем, 3 мм, то в соответствии с формулой длины окружности, равной 2 nr. Ширина мочеточниковой пластинки после резекции по ширине должна составлять 10 мм, но к этому надо добавить еще 30% на сократимость ткани, таким образом, ширина распластанного мочеточника должна составлять не менее 12—13 мм.
5. Продольный разрез мочеточника тубуляризируют сшиванием его краев абсорбируемой нитью 5/0 непрерывным швом с захватом слизистой и мышечного слоев. Второй ряд отдельных швов накладывают на адвентецию монолитной нитью 5—6/0. Формируют уретеромеатус диаметром на 25-30% больше возрастного норматива.
6. Обнажают передневерхушечную стенку мочевого пузыря с ипсилатеральной стороны и производят косой разрез детрузора на всю толщу вплоть до слизистой длиной 3-4 см. Положение разреза: проксимальный конец - линия перехода передней стенки в верхушечную зону, дистальный конец - на передней стенке в 3-4 см от проксимального. Угол разреза - 450 по отношению к продольной оси мочевого пузыря (рис. 3).
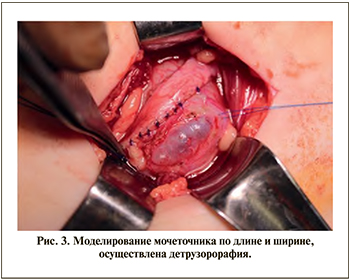
7. По обе стороны от разреза детрузора отделяют его от слизистой острым и тупым путем настолько, чтобы реконструированный мочеточник мог быть свободно укрыт сверху детрузором.
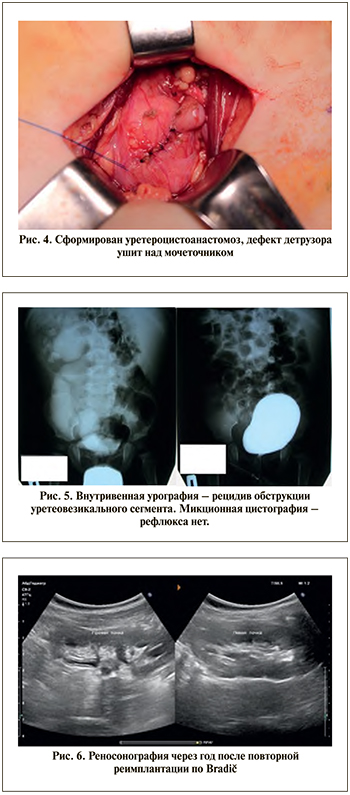
8. В дистальном конце разреза делают окно в слизистой, к нему подтягивают мочеточник и сшивают слизистую мочевого пузыря с концом мочеточника через всю его толщину по задней полуокружности абсорбируемыми нитями 5/6-0, устанавливают JJ стент и завершают формирование анастомоза по передней стенке.
9. Оба края детрузора у дистального угла его раны сшивают абсорбируемой нитью 4/0 с захватом адвентиции мочеточника по его передней поверхности (U-образный шов). Рану детрузора ушивают подобным образом через каждые 4-5 мм отдельными нитями, тем самым погрузив мочеточник между слизистой пузыря и детрузором на протяжении ~3,0 см, мочеточник при входе в туннель фиксируют дополнительно 2-3 нитями к детрузору с тем, чтобы анастомоз был ненатяжным. Соотношение между длиной субмукозного туннеля и диаметром мочеточника, как правило, составляет 4:1.
10. Мочевой пузырь дренируют уретральным катетером. Устанавливают страховой дренаж в околопузырное пространство. Ушивают рану передней брюшной стенки.
Послеоперационное ведение. Послеоперационные исследования производят через 3, 6, 9, 12 мес. Далее - по необходимости. Отсутствие в течение года симптомов пузырно-мочеточникового рефлюкса, стеноза уретероцистоанастомоза, инфекции мочевых путей, редукции объема чашечно-лоханочной системы и дилатации мочеточника определяет результат операции как успешный. Результат является неудовлетворительным при развитии ПМР или стеноза уретероцистоанастомоза. В качестве методик контроля служат УЗИ, МРТ или СКТ с/без контрастирования верхних мочевых путей, радионуклидная диагностика.
Результаты. Больная Ш.: в 4 года первый эпизод острого левостороннего пиелонефрита, УЗИ почек: дилятация левой лоханки - 32 мм и дистального мочеточника - 19 мм. При цистографии пузырно-мочеточникового рефлюкса нет. Динамическая нефросцинтиграфиия: период полувыведения после введения фуросемида >20 мин, снижение функции левой почки - 36%.
Через 2 мес. после купирования ИМП выполнена реимплантация по Коэну левого дилятированного до 23 мм мочеточника после его реконструкции по Hodgson в мочевой пузырь. Уретральный катетер удален на 7-е сутки, а интубирующий мочеточник стент - через 14 сут.
Через сутки после удаления стента переднезадний размер лоханки по данным УЗИ - 34 мм. Клинических проявлений инфекции мочевых путей отмечено не было. Через месяц анализ мочи нормализовался, при культуральном исследовании уропатогены не выявлены.
В процессе динамического наблюдения не отмечено редукции ПЗР лоханки (32 мм) и диаметра мочеточника (22 мм). По данным изотопного исследования обструктивный тип кривой, после выполнения диуретичекой пробы Т1/2 27 мин.
Больной выполнен по поводу обструкции уретеровезикального сегмента левосторонний уретероцистоанастомоз по Bradic. Послеоперационный период протекал гладко. Через 12 мес. анализ мочи в норме, при УЗИ размер лоханки - 14 мм, ПМР отсутствует. Спустя 8 лет рецидива болезни нет.
Больной М. 5 лет: на 25-й неделе беременности выявлен гидронефроз справа, постнатально при экскреторной урографии подтвержден обструктивный мегауретер и в 8-месячном возрасте выполнена реимплантация мочеточника по Cohen справа с продольно-поперечной резекцией дистальной трети мочеточника.
Через год, по данным УЗИ и СКТ, сохранился уретерогидронефроз, селективная почечная функция при нефросцинтиграфии - 28%. Выполнена реимплантация реконструкции мочеточника по Hodgson и его расширенного до 28 мм правого мочеточника в мочевой пузырь по Bradic. Через год размер лоханки - 14 мм, селективная почечная функция - 36%.
Больной Н.: в 11 мес. при плановом УЗИ почек выявлена дилятация лоханки справа до 35 мм и дистальной трети мочеточника до 22 мм. ПМР отсутствует. По поводу обструктивного мегауретера произведена реимплантация правого мочеточника по Politano-Leadbetter, выписан из клиники через 12 сут. В течение первых 6 мес. после операции 4 эпизода острого пиелонефрита, дилятация лоханки - 19 мм, мочеточника в нижней трети - 17 мм.
Через год после операции выявлен правосторонний смешанный ПМР IV степени, выполнено введение полиакриламидного геля справа по методике HIT. Через 4 мес. сохранение ПМР IV степени. Эпизоды ИМП повторялись, лекоцитурия и бактериурия были стойкими. В 2,5 года произведена реимплантация правого мочеточника в мочевой пузырь по Bradic с реконструкцией дистальной трети по Hodgson. Спустя 12 мес. передне-задний размер лоханки справа по данным УЗИ — 11 мм, дистальный мочеточник не визуализируется. В течение 3 лет симптомов болезни нет, вклад правой почки в суммарные почечные функции 32%, к 14-й минуте при динамической сцинтиграфии практически полное освобождение от изотопа.
Больной И. 1,5 лет: в 2-месячном возрасте выявлен мегауретер слева (лоханка — 19 мм, чашки — 18 мм, дистальный мочеточник — 18 мм) ПМР исключен. Произведена чрескожная пункционная нефростомия слева в связи с острым пиелонефритом. В возрасте 1 года произведена операция по Коэну с продольной резекцией дистального мочеточника.
Перед удалением нефростомического дренажа при тесте Пакена выявлено лоханочное давление 25 см водного столба. Восстановить пассаж мочи в мочевой пузырь не удалось. Через 6 мес. после реимплантации мочеточника при цистоскопии в области артифициального устья визуализируются рубцовые ткани. При антеградной пиелоуретерографии мочеточник контрастируется до уровня юкставезикального отдела мочеточника.
Ребенку выполнена повторная реконструкция дистального мочеточника с использованием техника Bradic. После удаления нефростомического дренажа отмечается стабильная ремиссия инфекции мочевых путей. ПЗР лоханки через год после операции — 11 мм. Нижняя треть мочеточника уверенно не визуализируется.
Больной Г. 2 лет. Диагноз ОМ на 25-й неделе гестации. Постнатально в возрасте 2 мес. по данным реносонографии выявлено расширение лоханки с двух сторон, больше справа. По данным микционной цистографии рефлюкса нет, по данным функциональной МРТ урографии поставлен диагноз «обструкция уретеровезикального сегмента, справа, гидронефроз III по SFU». Ребенок наблюдался в кардиоцентре с диагнозом «врожденный порок развития сердца, деффект межжелудочковой перегородки, хроническая сердечная недостаточность 1А».
В возрасте 1 года выполнена операция: резекция дистального отдела правого мочеточника, реимплантация по Коэну справа с моделированием мочеточника, установлен мочеточниковый стент справа. В процессе динамического наблюдения выявлено нарастание расширения лоханки до 37 мм на ипсилатеральной операции стороне (рис. 5).
Повторная реимплантация мочеточника по Bradic. Через год после операции передне-задний размер лоханки справа - 11 мм, каликоэктазия до 5 мм (рис. 6). Стойкая клиниколабораторная ремиссия инфекции мочевых путей.
Обсуждение. ОМ встречается примерно в 10% уропатий с общей частотой в диапазоне 1:1500-1:2000. Расширение дистального отдела мочеточника >7 мм с 30-недельной беременности считается аномальным, т.е. клиническая значимость дилятации выявляется перинатально. Хорошо известно, что 80% перинатально обнаруженных мегауретеров способно спонтанно разрешиться в течение первого года жизни, поэтому важен хорошо организованный мониторинг [15].
Однако, если селективная почечная функция ниже 30%, а диаметр нижней трети мочеточника больше 1,33 см, дальнейшее наблюдение нецелесообразно, поскольку эти факторы являются статистически значимыми и независимыми прогностическими факторами необходимости хирургического лечения [16].
Итак, обструктивный мегауретер, связанный с обструкцией уретеровезикального сегмента, подлежит реимплантации мочеточника как излечивающей процедуры при ИМП, болях в животе, изначально сниженном и прогредиентно падающем уровне почечной функции [17]. «Золотым» стандартом является открытая хирургия, предполагающая иссечение стриктуры мочеточника, уменьшение его калибра и антирефлюксную реимплантацию мочеточника в мочевой пузырь.
Показатель успешности в различных сериях достигает 90-96%. Однако возможны краткосрочные и долгосрочные осложнения в виде рефлюксов и рецидивов обструкции [18]. С целью снижения морбидности и рисков осложнений использованы различные лапароскопические техники, которые оказались вполне успешными, однако показали очевидные трудности в хирургии детей 1 года жизни, особенности при создании подслизистого туннеля в зоне треугольника Льето [12, 18]. Именно трудоемкость и длительность этого этапа операции легли в основу различных модификаций реимплантации с/без коррекции диаметра мочеточника [12, 15, 18-20].
В современной литературе практически отсутствуют публикации, посвященные особенностям хирургии рецидивного обструктивного мегауретера, что, по всей видимости, связано с достаточно высокой эффективностью используемых методик при первичных вмешательствах на уретеровезикальном сегменте. Поэтому, с нашей точки зрения, представленный опыт должен быть интересен ввиду недостатка соответствующих публикаций и в связи с использованием незаслуженно «забытой» техники, обладающей, с нашей точки зрения, преимуществами, особенно в ситуациях с тяжело дилятированным мочеточником.
Наш опыт техники Bradic в открытой хирургии для взрослых, который накапливался с 1977 г. и к настоящему времени превышает 150 операций, привел к необходимости оценки этой методики у детей. В предложенной Bradic методике подслизистый отдел мочеточника формировался в поперечном направлении, подобном направлению при технике Коэн. В нашей модификации мы выполняли детрузорафию в направлении, продолжающем естественный ход мочеточника, с некоторым смещением каудальной точки разреза к срединной линии.
В настоящей серии мы описываем пять различных по клиническому течению случая рецидивного обструктивного мегауретера, в которых была выполнена реимплантация мочеточника по Bradic. Основное преимущество этой техники состоит в том, что зона анастомоза мочеточника с мочевым пузырем располагается в верхней гемисфере последнего по передне-боковой стенке. Максимально возможная визуализация тканей и легкость выполнения технических приемов позволили предпочесть методику Bradic перед техникой Cohen и Politano-Leadbetter. Причем, по понятным соображениям, преимущество может быть реализовано в равной мере открытым, лапароскопическим и робот-ассистированным доступами.
Как показывает наш опыт, техника Bradic может быть применена не только в случае первичной хирургической процедуры, но и как спасательная операция после предшествовавшего неуспешного оперативного лечения. Возраст пациентов также не является ограничивающим фактором.
Заключение. В заключение считаем важным подчеркнуть, что как теоретически, так и практически техника экстрапузырной реимплантации мочеточника по Bradic имеет преимущество в простоте исполнения перед внутрипузырными техниками. Коррекция по ширине и длине мочеточника также легко выполнима при экстрапузырном подходе. В принципе, на наш взгляд, экстрапузырная техника предпочитаема перед внутрипузырной. Ограниченность опыта в операции Bradic детям при рецидивном обструктивном мегауретере нуждается в подтверждении в дальнейших рандомизированных клинических исследованиях.



