Открытие антибактериальных препаратов и их дальнейшая коммерциализация произвели поистине революционный подход к терапии инфекционных болезней, повысив эффективность терапии и снизив смертность среди населения. Вместе с тем рутинное применение антибиотиков способствовало постепенному формированию устойчивости, рост частоты которой регистрируют в последние десятилетия [1]. В отчете ВОЗ о глобальной эпидемиологической обстановке антибактериальная резистентность названа одной из трех наиболее важных угроз для общественного здравоохранения в XXI в. [2]. По оценке Центра по контролю и профилактике заболеваний (США), ежегодно по меньшей мере 20 тыс. человек умирают в результате инфекций, вызванных устойчивыми к антибиотикам бактериями [3]. Более того, по данным ежегодного отчета международной консультативной группы под руководством J. O’Neill (Великобритания), устойчивость к антибиотикам может служить причиной 300 млн случаев преждевременной смерти к 2050 г., что, несомненно, отразится на мировой экономике [4]. Ситуация еще больше усугубляется чрезвычайно частым применением антибактериальных препаратов, не всегда по показаниям одного и того же пациента, что приводит к постепенному появлению модифицированных бактерий, не поддающихся лечению.
Среди способов лечения бактериальных инфекций, вызванных микроорганизмами с множественной антибактериальной устойчивостью, применение бактериофагов стали вновь рассматривать как перспективный метод терапии. Кроме того, бактериофаги широко используются при производстве вакцин, лекарственных препаратов с целью обнаружения бактерий и их последующего типирования. Высокая эффективность и безопасность фаговой терапии по сравнению с антибиотиками обусловлены их специфичностью и способностью инфицировать только один вид, серотип или штамм бактерий. Применение бактериофагов не сопровождается уничтожением комменсальной бактериальной флоры, что значительно расширяет перечень клинических показаний к фаготерапии.
История бактериофагов
Впервые явление лизиса бактерий (на примере Vibrio cholerae) было описано E. Hankin в 1896 г. Спустя 2 года подобный эффект в работе с Bacillus subtilis был отмечен Н. Ф. Гамалея. В начале XX в. во время культивирования Staphylococcus aureus на питательных средах F. Twort обнаружил «подозрительную» антибактериальную активность. В 1917 г. F. d’Herelle сообщил об открытии «невидимого микроба», поражающего дизентерийную палочку. В последующем исследователем был введен термин «бактериофаг» [5]. Начался период активного изучения биологии фага.
В 1921 г. R. Bruynoghe и J. Maisin была опубликована первая работа о возможностях клинического применения бактериофагов в лечении инфекционных заболеваний кожи, вызванных бактериями семейства Staphylococcaceae [6].
С момента эмпирического определения эффективной дозировки фага ряд фармацевтических компаний, таких как Parke-Davis и Eli Lilly Company, начали активное коммерческое производство бактериофагов. После открытия первого антибиотика и начала эры антибиотикотерапии применение фагов отошло на второй план. И лишь спустя несколько десятилетий медицинское сообщество, столкнувшись с проблемой антибиотикорезистентности и поиска альтернативных препаратов, обратило внимание на успешный метод борьбы с инфекциями – фагопрофилактику и фаготерапию.
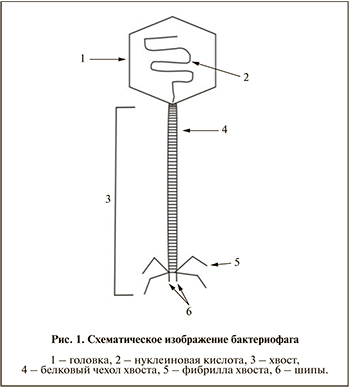 Таксономия и жизненный цикл бактериофагов
Таксономия и жизненный цикл бактериофагов
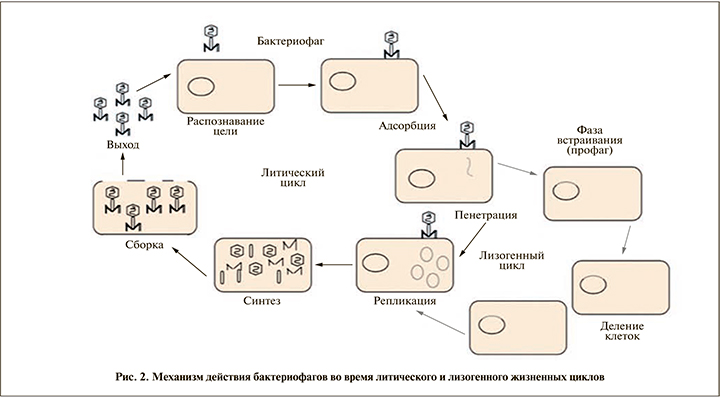
Бактериофаги являются наиболее распространенной формой жизни на Земле, подавляющее большинство из которых (около 96%) относится к Myoviridae, Podoviridae и Siphoviridae [7]. Фундаментальной характеристикой фагов служит наличие одного типа нуклеиновой кислоты в качестве носителя генетической информации и капсида, состоящего из структурных белков. Большинство известных бактериофагов имеют геном, состоящий из двухцепочечной ДНК (рис. 1). Бактериофаги связаны с определенным бактериальным штаммом и проявляют бактерицидную активность в отношении различных грамположительных и грамотрицательных бактерий. Некоторые фаги имеют тропность к отдельным типам бактерий, в то время как другие обладают широким спектром активности, а их специфичность определяется наличием специальных рецепторов, расположенных на поверхности бактериальных клеток. Бактериофагам присущи два типа активности в отношении бактериальной клетки: литическая, характерная для вирулентных фагов, и лизогенная активность, предусматривающая интеграцию генетического материала бактериофага с бактериальной хромосомой и репликацию в составе бактериальной ДНК, что приводит к появлению профага [8].
Первый контакт между фагом и бактериальной клеткой служит результатом случайного столкновения при условии, если клетка имеет специфические рецепторы на своей поверхности. Как правило, контакт осуществляется между рецепторными молекулами хозяина (например, тейхоевой кислотой в грамположительных или липополисахаридом в грамотрицательных бактериях) и специфическими белками фага, расположенными на кончике хвостового волокна или на одном конце нитчатого фага. Имплификация в ДНК происходит сразу после того, как фаг стабильно и необратимо адсорбируется на клеточной поверхности (рис. 2) [9]. Вирулентные вирусные частицы в большой концентрации скапливаются в очаге воспаления, проникают в бактериальные клетки и репродуцируются внутри них в геометрической прогрессии. На начальном этапе инфекционного процесса в системе фаг–клетка бактериальный вирус адсорбируется на рецепторах внешней мембраны клетки и при выходе из клетки фагового потомства происходит лизис бактерии. Вышедшие из клетки новые фаговые частицы поражают следующие бактериальные клетки до полного уничтожения возбудителя в области воздействия препарата. Фаговые частицы – наноразмерные биологические объекты, При местном использовании они частично проникают через неповрежденные кожные покровы и слизистые оболочки, но высокая концентрация бактериофагов сохраняется длительное время в зоне нанесения за счет самопроизводства [10].
Особенностью фагов является строгая специфичность. Каждый бактериальный вирус поражает определенный штамм бактерии. Современные препараты состоят из фаговых коктейлей, включающих фаги, специфичные в отношении наиболее распространенных возбудителей инфекций одной нозологии или определенного локуса. Разрабатываются и перспективные составы коктейлей, содержащие основные виды антибиотикорезистентных возбудителей инфекций, связанных с оказанием медицинской помощи [11].
Возможности и ограничения использования бактериофагов
Одним из основных ограничений для принятия и реализации фаговой терапии является отсутствие двойных слепых плацебо-контролируемых рандомизированных клинических исследований, подтверждающих клиническую эффективность и преимущества бактериофагов в отношении инфекций, вызванных устойчивыми к антибиотикам бактериями. Большинство представленных в России препаратов на основе бактериофагов рекомендовано в лечении гнойно-воспалительных заболеваний кожи, слизистых оболочек и мягких тканей, инфекционных заболеваний желудочно-кишечного тракта (ЖКТ), органов дыхательной и мочевыделительной систем (МВС). На сегодняшний день препараты на основе бактериофагов, выпускаемые в РФ, имеют статус безрецептурных.
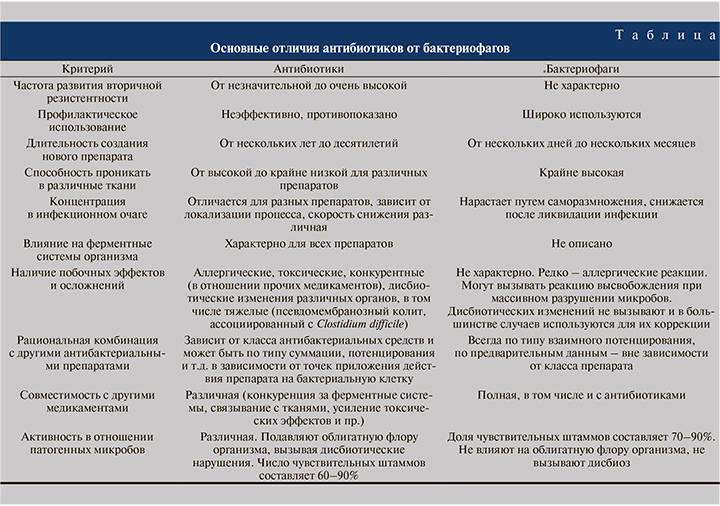
Основные отличия антибиотиков от бактериофагов отображены в таблице [12].
По мнению О. И. Костюкевич [13], в настоящее время к причинам, ограничивающим активное внедрение фаговой терапии в клиническую практику, в первую очередь относят отсутствие нормативно-правовых документов и недостаточную информированность специалистов, а также отсутствие литических фагов для некоторых патогенных для человека бактерий (Rickettsia, Ehrlichia и Coxiella). В меньшей степени к ограничениям фаготерапии можно отнести отсутствие исследований, направленных на оценку выраженности иммунного ответа при взаимодействии с фагом.
Принципы рациональной фаготерапии должны базироваться на предварительном определении чувствительности бактерий к препарату и литической активности бактериофагов (in vitro), на выборе способа доставки бактериофагов. Местная (адресная) доставка фагов предпочтительна для локализованной инфекции, в то время как при системных инфекционно-воспалительных процессах рекомендован парентеральный путь введения [14]. При использовании пероральных форм препаратов необходимо учитывать чувствительность фагов к действию соляной кислоты желудка и в этом случае отдавать предпочтение доставке в кислотоустойчивой оболочке [15]. В связи с этим одним из важных этапов в становлении фаготерапии как неотъемлемой части урологической практики может стать использование инновационных лекарственных форм препаратов бактериофагов в форме геля. Гель в отличие от традиционных жидких форм позволит бактериофагам, входящим в его состав, дольше сохраняться на слизистых оболочках (в том числе слизистой мочеиспускательного канала, а также в области наружных половых органов), тем самым пролонгируя лечебное действие и повышая комплаентность к фаговой терапии.
На кафедре урологии ФГБОУ ВО МГМСУ им. А. И. Евдокимова совместно с ООО НПЦ «МикроМир» в рамках реализации гранта РНФ (соглашение № 19-15-00379) с 2019 г. ведется активная работа по внедрению в клиническую практику разработанного антибактериального и обезболивающего препарата на основе бактериофагов в гелевой форме [16, 17] с целью минимизации риска развития инфекционных осложнений в ходе проведения различных инструментальных исследований (таких, как цистоскопия, уродинамическое исследование и т.д.) и лечебно-диагностических процедур (таких, как катетеризация мочевого пузыря, дренирование верхних мочевыводящих путей и т.д.), а также профилактики катетер-ассоциированных инфекций мочевыводящих путей. Принципиальным отличием разработанного препарата является гель, входящий в его состав, который частично состоит из водорастворимой бланозы и/или лидокаина гидрохлорида и/или хлоргексидина гидрохлорида; концентрат бактериофагов: количество штаммов бактерий для репродукции – 40, активность фагов (титры по Аппельману) – 10-8–10-9, количество компонентов (видов бактериофагов, лизирующих патогены) в концентрате – 48; рН – 7,2. Проведенные серии клинико-экспериментальных работ позволили выявить ряд уникальных свойств разработанной гелевой субстанции: гель не разжижается при нагревании и не вытекает после нанесения, отсутствие в его составе спирта не вызывает сухости и раздражения кожных покровов, слизистых оболочек органов мочевыделительной системы. Оценка собственных результатов займет дополнительное время и будет сообщена позднее.
Преимущество фаготерапии в урологии заключается в местном применении препарата, однако на данный момент бактериофагов в удобной для локального введения форме не существует. Зарегистрированные препараты на основе бактериофагов для лечения бактериальных урогенитальных инфекций выпускаются в жидкой форме, сложной в применении вследствие отсутствия возможности обеспечения достаточной терапевтической концентрации фаговых частиц в области лечения и снижения комплаентности. Как показало сравнение потенциальных преимуществ и сравнительно небольшого количества недостатков, фаги безусловно обладают рядом характеристик, обеспечивающих им сильнейший терапевтический потенциал в качестве альтернативных средств борьбы с устойчивыми бактериальными штаммами. Учитывая растущую потребность в использовании каких-либо лекарственных средств помимо антибиотиков, вполне вероятно, что фаговая терапия станет реальностью и будет использоваться в широкой клинической практике в ближайшем будущем. Проведение собственных клинических исследований по оценке эффективности разработанного антибактериального препарата на основе бактериофагов в гелевой форме позволит осуществить персонализированный подход к терапии инфекционных заболеваний органов МВС.



