Инфекции мочевыводящих путей (ИМП) – одна из самых распространенных форм бактериальных инфекций в клинической практике, поражающих около 150 млн пациентов в мире ежегодно [1]. По данным опросов молодых женщин, к 32 годам 12% из них имеют минимум один эпизод ИМП, у 50–70% опрошенных в течение жизни имеет место по крайней мере один эпизод ИМП [2]. В исследованиях, в которых принимали участие девушки – учащиеся колледжей, установлено, что цистит развивается с частотой 0,7 эпизода на 1 учащуюся в год, при этом отмечено, что у 25% опрошенных ИМП рецидивируют [3].
Отечественные данные по распространенности ИМП свидетельствуют о том, что один эпизод цистита в течение жизни развивается у 20% женщин уже к возрасту 18–20 лет, а со временем увеличивается как процент женщин с ИМП, так и количество эпизодов на одну пациентку [4]. Сходные данные были получены в России при анкетировании 1185 студенток вузов в 2005 и 2017 гг. О перенесенном эпизоде дизурии в течение жизни сообщили 19–21% опрошенных, при этом у 22,9–28,5% респонденток имели место рецидивирующие ИМП [5].
Этиология неосложненных ИМП хорошо описана в литературе: в 70–95% случаев возбудителем является Escherichia coli, в 5–20% – Klebsiella pneumoniae, Proteus mirabilis, Enterobacter spp., Pseudomonas. aeruginosа и другие представители порядка Enterobacterales. Грамположительные бактерии при внебольничных ИМП выделяют не так часто – у 1–10% пациенток; как правило, это Enterococcus faecalis, другие энтерококки, Staphylococcus saprophyticus, стрептококки группы B. Для формирования представления о чувствительности к антимикробным препаратам (АМП) уропатогенов, вызывающих внебольничные ИМП, наибольший интерес представляют данные о E. coli [6].
Во многих странах мира в последние годы отмечается тенденция к значительному росту устойчивости возбудителей ИМП к β-лактамам, ко-тримоксазолу, фторхинолонам [7, 8]. Отмечается распространение уропатогенов, способных продуцировать β-лактамазы широкого спектра [9, 10]. В связи с этим в мире проводится много микробиологических исследований по мониторингу резистентности возбудителей ИМП. Подобные проекты – либо самостоятельные исследования (ARESС, ECO-SENS), либо часть более масштабных проектов (SENTRY). Такие исследования (часто многоцентровые) нередко проводятся на территории нескольких стран, например проекты ARESС, ECO-SENS [8, 11, 12].
Микробиологические исследования отличаются не только временем и географией их проведения, но и методологией, особенностями формирования популяции и ее объемом.
В России мониторинг чувствительности возбудителей ИМП ведется с 1998 г. За это время выполнено несколько многоцентровых микробиологических исследований: UTIAP-1, UTIAP-2, UTIAP-3, ARESC, DARMIS, RESOURCE, DARMIS-2018 [12–18]. Они проводились в разные временные промежутки и включали разные категории пациентов (табл. 1).
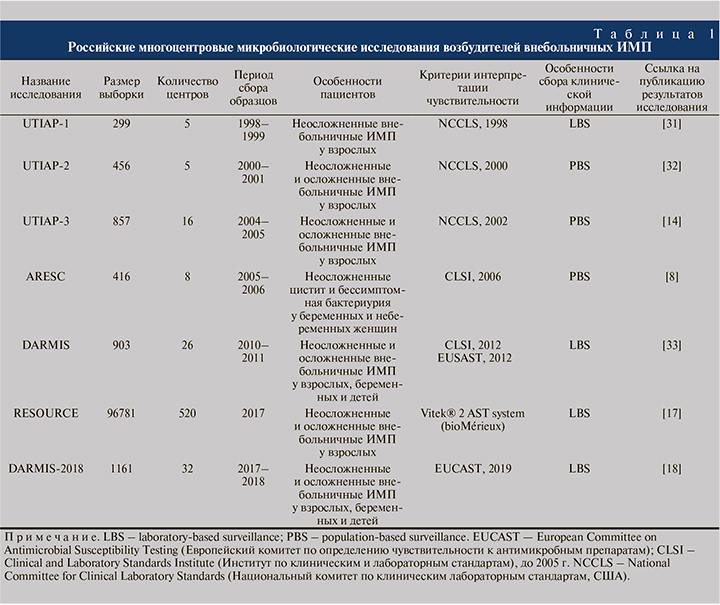
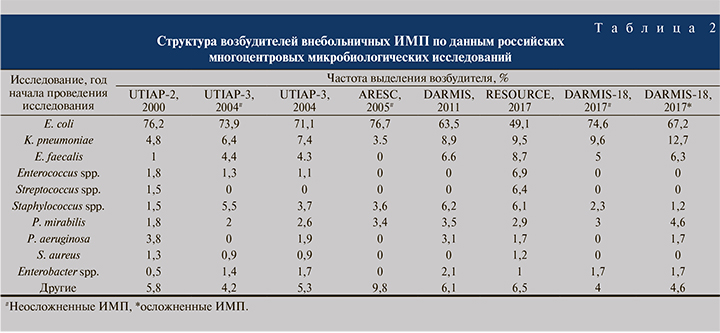
В табл. 2 приведены данные о спектре возбудителей внебольничных ИМП, выполненных в разные временные периоды. Отдельно показана структура возбудителей для неосложненных и осложненных ИМП, если методика исследования и опубликованные данные позволяли проводить такое разделение. Главный вывод, который можно сделать на базе анализа результатов исследований, выполненных в России за последние 20 лет, состоит в том, что E. coli является основным внебольничным уропатогеном. На втором месте по частоте выявления находится K. pneumoniae. В последние годы растет число грамположительных бактерий, выделяемых из образцов мочи пациентов с клиникой ИМП, прежде всего энтерококков. Однако с учетом преобладания E. coli в структуре возбудителей внебольничных ИМП при изучении антимикробной устойчивости прежде всего интересует чувствительность этого уропатогена.
На наш взгляд, наиболее драматичная ситуация с ростом антимикробной резистентности сложилась в отношении пероральных препаратов, прежде всего β-лактамов и фторхинолонов. Проблема усугубляется тем, что количество нетяжелых форм ИМП, допускающих терапию пероральными препаратами в амбулаторных условиях, в десятки раз больше числа случаев ИМП, требующих госпитализации и терапии в стационаре с использованием парентеральных препаратов. Перечень АМП для терапии ИМП в стационаре довольно широк (аминогликозиды, ингибиторозащищенные цефалоспорины, карбапенемы) и пополняется новыми парентеральными лекарственными средствами, тогда как новых пероральных АМП в ближайшем будущем зарегистрировано не будет. С другой стороны, часть доступных пероральных препаратов, таких как нитрофурантоин, фосфомицин, несмотря на их высокую активность in vitro, не обладают достаточной клинической эффективностью даже для терапии инфекций нижних отделов мочевыводящих путей.
Сравнительный анализ чувствительности уропатогенной E. coli в России в разные временные промежутки позволил выявить несколько закономерностей. Устойчивость E. coli к незащищенным аминопенициллинам выросла с 33,3 в 1999 г. до 51–57% в 2017–2018 гг. (табл. 3). Очевидно, что для эмпирической терапии внебольничных ИМП нельзя рекомендовать амоксициллин или ампициллин без ингибиторов β-лактамаз. В то же время существуют ситуации, когда амоксициллин внутрь или ампициллин парентерально могут быть использованы. Это возможно, если аминопенициллины назначаются в составе этиотропной терапии ИМП при выделении в качестве уропатогена энтерококков. Есть работы, в которых показано, что аминопенициллины оказываются эффективными при ИМП, вызванных даже ванкомицинрезистентными штаммами энтерококков [19].
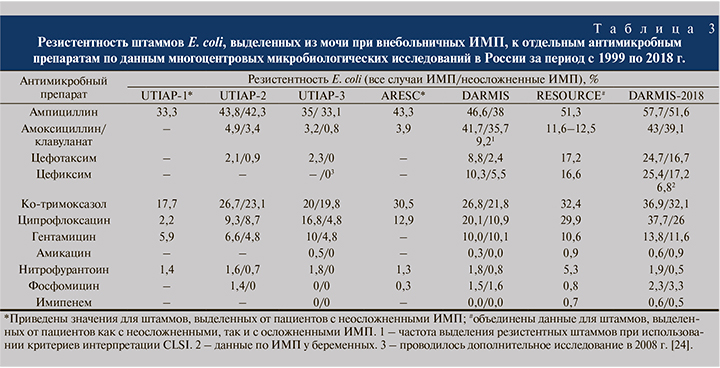
Обращает на себя внимание резкий рост после 2010 г. числа штаммов E. coli, резистентных к ингибиторозащищенным пенициллинам, прежде всего амоксициллину/клавуланату (АКК). По данным исследований DARMIS и DARMIS-2018, доля резистентных штаммов составила 41,7 и 43% соответственно. Результаты других российских исследований свидетельствуют о значительном расхождении показателей популяционной резистентности E. coli к АКК. Так, в исследовании RESOURCE доля резистентных к АКК штаммов составила 11,6–12,5% [17], в работе [20] –23%.
Более высокие цифры могут быть объяснены не столько истинным распространением устойчивых штаммов, сколько изменением используемых в исследованиях критериев интерпретации чувствительности. В настоящее время существует два подхода: первый основан на использовании при оценке чувствительности постоянного соотношения амоксициллина и клавулановой кислоты 1:2 (CLSI); во втором используется постоянная концентрация клавулановой кислоты для всех разведений – 2 мг/л (EUCAST). При этом один и тот же штамм при тестировании разными методами может демонстрировать значительную разницу в чувствительности к АКК: например, 14,8% при определении методом CLSI и 55% – методом EUCAST [21].
Интересно проанализировать данные по чувствительности штаммов E. coli, выделенных в России к АКК, при использовании одновременно двух обсуждаемых выше методов – EUCAST и CLSI. Как видно из табл. 3, для штаммов E. coli, выделенных от пациентов с неосложненными ИМП, разница в относительном числе резистентных штаммов составляет около 25%: доля резистентных штаммов при использовании критериев CLSI и EUCAST составляет 9,2 и 35,7% соответственно. В связи с этим рост показателей устойчивости уропатогенов к АКК в определенной степени может объясняться переходом после 2010 г. на методики определения чувствительности по EUCAST.
Примечательно, что подобные изменения в использовании методик определения чувствительности, как правило, не привлекают внимания клиницистов, хотя важны с практической точки зрения. Именно эти нюансы определяют итоговое значение уровня популяционной резистентности и выбор антибиотика для эмпирической терапии и включения в клинические руководства. В данной ситуации правомерен вопрос: «А какой из методов в большей степени коррелирует с клиническими исходами при терапии ИМП?». Попытки на него ответить в настоящее время не дают четкого ответа. В немногочисленных исследованиях показано, что определение чувствительности методом как CLSI, так и EUCAST плохо коррелируют с успехом или неуспехом терапии ИМП с использованием АКК [21–23].
В сложившейся ситуации надо чрезвычайно осторожно разрабатывать рекомендации по использованию АКК при внебольничных ИМП и, на наш взгляд, не оправданно полностью отказываться от использования данного антибиотика только на основании выявления относительно высокого числа резистентных штаммов в отдельных исследованиях с использованием методологии EUCAST. Особенно принимая во внимание, что в своих документах EUCAST указывает на то, что пока не получено клинических данных, подтверждающих обоснованность текущих критериев интерпретации [23].
Крайне важным представляется анализ ситуации с чувствительностью уропатогенов к пероральным цефалоспоринам III поколения. Это связано с тем, что после формирования высокого уровня устойчивости к фторхинолонам за последние 10 лет цефалоспорины III поколения часто использовались для терапии ИМП в амбулаторных условиях [24]. Это обусловлено тем, что в клинической практике существует потребность в активных пероральных АМП, создающих бактерицидные концентрации не только в моче, но и в тканях почек, например, для проведения ступенчатой терапии при пиелонефрите. Этим требованиям удовлетворяет очень ограниченный круг АМК, к которым прежде всего относятся цефалоспорины III поколения.
Данные по динамике устойчивости уропатогенной E. coli в России (см. табл. 3) свидетельствуют о росте числа резистентных штаммов к цефалоспоринам III поколения. Популяционный уровень резистентности достигает 16–17% по данным исследований RESOURCE и DARMIS-18. На наш взгляд, уровень резистентности E. coli, выделенной от пациентов с внебольничными ИМП, к цефалоспоринам III поколения в России несколько завышен. Это можно объяснить несколькими причинами. Если проанализировать данные более ранних микробиологических исследований, очевидно, что существует разница в уровне резистентности к цефалоспоринам III поколения между штаммами, выделенными при неосложненных ИМП, и другими формами ИМП, которая составляет 6–8%. В исследовании RESOURCE (2017) частота выделения резистентных штаммов E. coli для цефотаксима составляет 17,2%, для цефиксима – 16,6%. Таким образом, для неосложненных форм ИМП этот показатель, вероятнее всего, составляет около 9–10% (см. табл. 3).
Одним из аргументов, приведенных в пользу ограничения использования цефалоспоринов III поколения в амбулаторной практике, является их потенциальная способность индуцировать рост устойчивости грамотрицательных бактерий. В целом подобное утверждение справедливо, но не в отношении внебольничных ИМП. Во-первых, способность сколь-либо заметно ускорять формирование устойчивости среди грамотрицательных бактерий была показана при увеличении использования цефалоспоринов III поколения только в стационарах, где количество назначаемых антибиотиков на порядок выше, чем в амбулаторных условиях. Во-вторых, в амбулаторных условиях объем потребления цефалоспоринов для терапии ИМП в разы ниже, чем для лечения респираторных инфекций. В связи с этим увеличение частоты использования цефалоспоринов при ИМП вряд ли сыграет заметную роль в развитии устойчивости грамотрицательных бактерий.
Согласно фармакодинамическим показателям, одним из наиболее активных пероральных антибиотиков, относящихся к β-лактамам, является цефиксим. На сегодняшний день в России этот препарат – единственный представитель цефалоспоринов III поколения, имеющий в показаниях терапию ИМП.
Наблюдаемый в последние 10–15 лет значительный рост уровня антибиотикорезистентности E. coli и к фторхинолонам заставил пересмотреть подходы к выбору антимикробной терапии ИМП. Если в 2001–2002 гг. в России, по данным исследований UTIAP, к фторхинолонам были чувствительны более 90–95% штаммов уропатогенной E. coli, то по прошествии 10 лет доля чувствительных штаммов снизилась до 80–90%, а по данным более поздних исследований – до 65–70% (см. табл. 3). Аналогичная ситуация с ростом резистентности уропатогенов к фторхинолонам наблюдается в США [25], странах Европы и в Азии [26].
Серьезные ограничения по использованию фторхинолонов при ИМП связаны с тремя основными свойствами этого класса антимикробных препаратов. Во-первых, на протяжении последних 20 лет наблюдается рост популяционной устойчивости грамотрицательных возбудителей, относящихся к возбудителям ИМП, ко всем фторхинолонам до 30% (см. табл. 3). Подразумевается, что это может приводить к снижению клинической эффективности фторхинолонов. Во-вторых, хорошо описана способность фторхинолонов вызывать неблагоприятные экологические эффекты, в частности быструю селекцию устойчивых уропатогенов, а также избыточное размножение Clostridium difficile и развитие антибиотик-ассоциированной диареи. В-третьих, использование фторхинолонов ассоциируется с довольно высокой частотой нежелательных реакций (кардиотоксичность, нейротоксичность, периферическая полинейропатия, гепатотоксичность и др.). Это способствовало формированию позиции о необходимости ограничения применения данного класса препаратов в амбулаторных условиях [27].
Представляют интерес данные по чувствительности уропатогенной E. coli к нитрофурантоину. Как видно из табл. 3, на протяжении последних 20 лет в России роста устойчивости E. coli к этому препарату не регистрируют. Максимальное значение популяционной резистентности (5,3%) выявлено в 2017 г. в исследовании RESOURCE. На наш взгляд, это несколько более высокое значение объясняется особенностью формирования популяции исследования RESOURCE, в которое включили все формы внебольничных ИМП. Безусловно, к уникальным качествам нитрофурантоина относятся его способность оказывать минимальный экологический вред от низкая скорость формирования устойчивости.
Так, выявлено, что у пациенток, получавших предшествовавшую терапию нитрофурантоином по поводу ИМП, устойчивость E. coli к антибиотикам, в частности к ко-тримоксазолу, ниже, чем у штаммов возбудителя, выделенного от пациенток, получавших АМП широкого спектра [28]. В то же время существует ряд недостатков, заметно ограничивающих использование данного АМП: невысокая клиническая эффективность (70–80%), возможность применения только при инфекциях нижних отделов мочевыводящих путей, узкий спектр действия, необходимость проведения более длительных курсов терапии, проблемы с переносимостью и безопасностью.
Обсуждаемые публикации микробиологических исследований, проведенных в России за последние 20 лет (см. табл. 3), не выявили заметного роста устойчивости E. coli к фосфомицина трометамолу (ФТ): частота выявления устойчивых штаммов не превышает 3–4%. Эти данные легли в основу российских клинических рекомендаций, в которых ФТ считается препаратом выбора при остром цистите [29, 30]. В то же время ситуация с ФТ ярко иллюстрирует противоречия, связанные с интерпретацией данных микробиологических исследований в клинической практике. Прежде всего это вызвано тем, что данные о низком уровне устойчивости к АМП in vitro, в частности к фосфомицину, нередко приводят к завышенной оценке прогнозируемой клинической эффективности.



