Введение. В 1928 г., английский ученый Александр Флеминг опубликовал статью, в которой сообщил о новом, выделенном из колоний плесени веществе, названном пенициллином. В 1942 г. применение нового препарата позволило спасти пациентку, умиравшую от стрептококкового сепсиса. Однако в своем интервью газете «Нью-Йорк Таймс» ученый, основатель эры антибиотикотерапии, предупреждал, что в скором времени появятся бактерии, которые сэволюционируют в новую форму с устойчивостью. «Наступит время, когда пенициллин можно будет свободно приобрести в аптеках. Человек, бездумно играющийся с пенициллином для лечения всего подряд, в конце концов окажется морально ответственным за смерть того, кто не смог побороть инфекцию, которая оказалась устойчивой к пенициллину».
Ежегодно в мире регистрируется более 150 млн инфекций, из них около 40% составляют госпитальные. Основным средством при лечении пациентов c инфекцией мочевыводящих путей (ИМП) являются антибактериальные препараты, однако в последние годы наблюдается изменение частоты встречаемости отдельных возбудителей и снижение чувствительности микроорганизмов к определенным антибактериальным препаратам [1–2].
Цель исследования: провести анализ встречаемости и резистентности микроорганизмов к антибактериальным препаратам, выделенных в посевах мочи пациентов с инфекцией мочевыводящих путей с 2012 по 2019 г.
Материалы и методы. В клинике урологии ГКБ № 1 им. Н. И. Пирогова и в ГКБ № 29 им. Н. Э. Баумана проведен ретроспективный анализ результатов 15 083 посевов мочи 12 554 стационарных больных.
Исследование включило выделение, идентификацию, определение уровня антибиотикорезистентности микробных культур диско-диффузионным методом оценки чувствительности бактерий к антимикробным препаратам [3].
Традиционный стандартизированный посев осуществлялся петлей в 10 мкл на следующие питательные среды: агар с добавлением 5% бараньей крови (Pronadisa, Испания), агар Левина (Pronadisa, Испания), агар Бигги (BD, США) с последующей инкубацией при 37°C в течение 18–24 ч.
Далее производился визуальный подсчет колоний. Интерпретацию результатов проводили согласно клиническим рекомендациям «Бактериологический анализ мочи» [4].
Положительным считали результат при выявлении:
- для первичных патогенов (E. coli, Enterococcus spp.) и
- для вторичных патогенов (Enterobacter spp., Klebsiella spp., P. mirabilis, Ps. aeruginosa, S. aureus, Acinetobacter spp.) 10*3 КОЕ/мл в моче, полученной от мужчин и 10*4 КОЕ/мл в моче, полученной от женщин.
- для нетипичных возбудителей (коагулазонегативные стафилококки, Streptococcus spp.) 10*5 КОЕ/мл.
 Оценка чувствительности выделенных микроорганизмов к антибиотикам производилась на бактериологическом анализаторе Phoenix (BD, США) и диско-диффузионным методом (диски производства [BD, США]). Оценка продуцентов β-лактамаз расширенного спектра (БЛРС) и карбапенемаз проводилась на бактериологическом анализаторе Phoenix (BD, США) методами «двойных дисков» и инактивации карбапенемов [5]. Исследование на продукцию карбапенемаз проводилось в лаборатории клинической микробиологии ГКБ № 1 и № 29 с 2012 по 2019 г. Статистическая обработка результатов исследования произведена с помощью программы Statistica, версия 10, качественные данные представляли собой абсолютные величины (значения) и относительные (частоты).
Оценка чувствительности выделенных микроорганизмов к антибиотикам производилась на бактериологическом анализаторе Phoenix (BD, США) и диско-диффузионным методом (диски производства [BD, США]). Оценка продуцентов β-лактамаз расширенного спектра (БЛРС) и карбапенемаз проводилась на бактериологическом анализаторе Phoenix (BD, США) методами «двойных дисков» и инактивации карбапенемов [5]. Исследование на продукцию карбапенемаз проводилось в лаборатории клинической микробиологии ГКБ № 1 и № 29 с 2012 по 2019 г. Статистическая обработка результатов исследования произведена с помощью программы Statistica, версия 10, качественные данные представляли собой абсолютные величины (значения) и относительные (частоты).
Результаты. Частота положительных посевов с выделенными культурами микроорганизмов составила 51,6%. Основную часть пациентов представляли больные осложненной ИМП (83,6%), неоднократно находившиеся на стационарном лечении, пациенты с временными или постоянными дренажами, нарушенным пассажем мочи по мочевыводящим путям.
Наиболее частыми возбудителями, как отражено на рис. 1, остаются Enterococcus faecalis (2012/2019, прирост – 5,2%), Escherichia coli (2012/2019, прирост – 6,4%), Klebsiella pneumoniaе (2012/2019, прирост – 12,2%); Proteus mirabilis (2012/2019, прирост – 0,3%) Частота встречаемости Pseudomonas aeruginosa уменьшилась на 1,3% (с 6,8 до 5,5%), Staphylococcus aureus на 0,6% (с 2,2 до 1,5%), P. mirabilis увеличилась на 0,3% (с 7,3 до 7,6%). Значительно снизилась частота встречаемости Enterobacter cloacae – на 3,7% (с 4,1 до 0,4%). Однако отмечается увеличение роста Acinetobacter baumannii на 2,7% (с 0,9 до 3,6%) и Staphylococcus haemolyticus на 0,4% (с 1,2 до 1,6%).
Кроме того, прослеживается увеличение частоты штаммов различных микроорганизмов, резистентных к определенным группам антибактериальных препаратов.
Methicillin (Oxacillin) Resistant S. аureus (MRSA) – устойчивы ко всем β-лактамам и обладают ассоциированной устойчивостью к аминогликозидам, линкозаминам, макролидам, тетрациклинам. Всего на метициллинорезистентность исследовано 352 штамма S. аureus. Доля MRSA в 2012 и 2019 гг. составила 35,0 и 39,0% (+4,0%) соответственно.
Согласно данным рис. 2, штаммы, вырабатывающие БЛРС и обусловливающие их резистентность почти ко всем β-лактамным антибиотикам, стали встречаться чаще у E. coli на 19,8% (с 3,2 до 23%), K. pneumoniae – на 34,7% (с 5,2 до 39,9%).
Первый штамм в России ванкомицин-резистентного энтерококка (VRE) зафиксирован в 2002 г. В 2019 г. в ГКБ № 1 им. Н. И. Пирогова было исследовано 264 штамма энтерококка и выделено 5 штаммов VRE (1,89%).
Также существенный рост выявлен среди продуцентов карбапенемаз. В 2012 г. исследовано 342 штамма, из которых продуцентами карбапенемаз оказались лишь 5 (1,5%). В 2018 г. исследовано 533 штамма, из которых 44 являлись продуцентами карбапенемаз (8,3%), а в 2019 г. из 550 исследованных штаммов выявлено 189, продуцирующих карбапенемазы (34,4%).
В когорте больных ИМП с выделенной E. faecalis (рис. 3) с 2012 по 2019 г. прослеживалось увеличение резистентности к ванкомицину на 1,89% (с 0 до 1,89 %), тигециклину на 0,6% (с 0 до 0,6%), нитрофурантоину на 4,6% (с 4 до 8,6%), имипенему на 4,3% (с 0 до 4,3%), увеличение резистентности к гентамицину на 5,8% (с 32,6 до 38,4%). Одновременно снизилась резистентность к ампициллину на 0,7% (с 12,2 до 11,5%), ципрофлоксацину на 31% (с 53,3 до 23,1%), левофлоксацину на 28% (с 48 до 20%).
У пациентов с выделенной E. coli (рис. 4) отмечено повышение резистентности микроорганизма к карбапенемам (меропенему) на 4,2% (с 0 до 4,2%), к амоксициллину/клавулоновой кислоте на 3,7 % (с 21,4 до 25,1%), амикацину на 3,9 % (c 7,3 до 11,2 %), цефтазидиму на 43,5 % (с 23,2 до 66,7%), ампициллину на 11,8% (с 73,9 до 85,7%), левофлоксацину на 18,4% (с 34,9 до 53,3%), ципрофлоксацину на 7,6% (с 46,5 до 54,1%), нитрофурантоину на 34,4% (с 8,5 до 42,9%), Ко-тримоксазолу (бисептолу) на 63,3% (с 36,7 до 100%).
У пациентов с выделенной K. pneumoniae (рис. 5) прослежено увеличение резистентности к амикацину на 11,8% (с 18,6 до 30,4%), меропенему на 27,1% (с 1,4 до 28,5%), имипенему на 23,3% (с 0 до 23,3%), цефтазидиму на 33,2% (с 12,8 до 46,0%), амоксициллину/клавулановой кислоте на 19,5% (с 41,8 до 61,3%), тигециклину до 100%, левофлоксацину на 19,2% (с 33,8 до 53%); снижение резистентности к ампициллину на 10,7% (с 85,7 до 75%), несущественно к ко-тримоксазолу на 0,7% (с 45,4 до 44,7%), ципрофлоксацину на 16,5% (с 76,5 до 60%).

Среди пациентов отделений реанимации и интенсивной терапии с генерализацией инфекционного процесса и развитием сепсиса прослежено увеличение резистентности данного возбудителя к амикацину на 31,5% (с 25 до 56,5%), меропенему на 52,4% (с 0 до 52,4%), цефтазидиму на 15% (с 85 до 100%), амоксициллину/клавулановой кислоте на 1% (с 79 до 80%), имипенему на 42,9% (с 0 до 42,9%), цефотаксиму/клавулановой кислоте на 2,5 % (с 30,8 до 33,3%), левофлоксацину на 1,2% (c 73,7 до 74,9%).
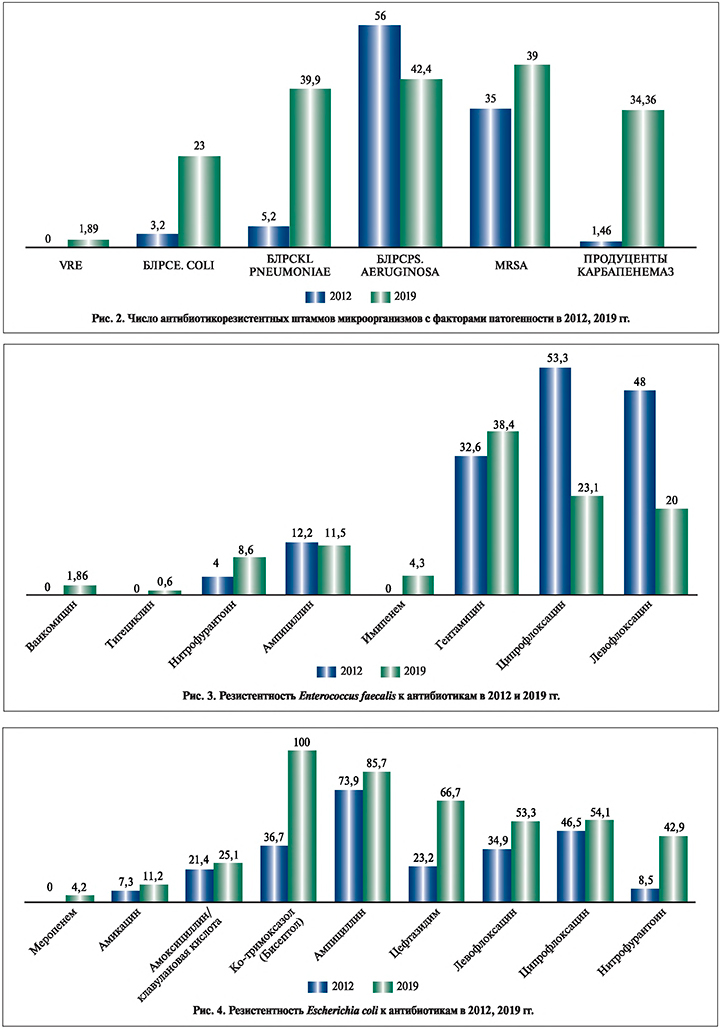
Анализ чувствительности P. mirabilis (рис. 6) продемонстрировал повышение резистентности к амикацину на 14,2% (с 6,7 до 20,9%), меропенему на 2,4% (с 0% до 2,4%), имипенему на 1,4% (с 0 до 1,4%), амоксициллину/клавулановой кислоте на 20,7% (с 17,1 до 37,8%), левофлоксацину на 5,6 % (с 23,4 до 29%), ципрофлоксацину на 39,4% (с 27,3 до 66,7%), ампициллину на 14,1% (с 60,9 до 75%), цефтазидиму на 12,5% (с 0,2 до 12,7%), Ко-тримоксазолу на 9,7% (с 59,9 до 69,6%).
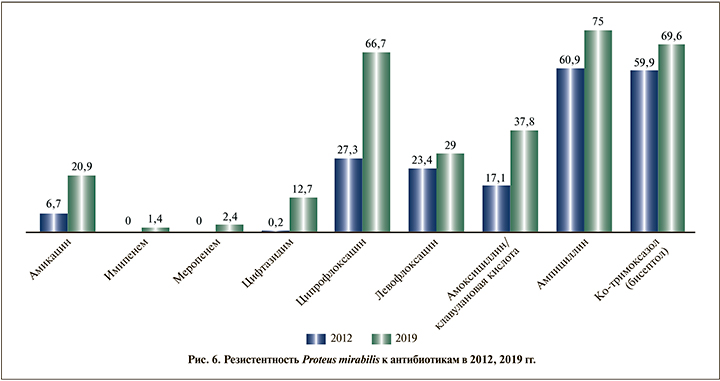
При анализе чувствительности P. aeruginosa (рис. 7) с 2012 по 2019 г. отмечено повышение резистентности к амикацину на 16,7% (с 30,2 до 46,9%), имипенему на 27,3% (с 11,6 до 38,9%), меропенему на 40,7% (с 9,3 до 50%), цефтазидиму на 10,7% (с 55,8 до 66,5%), ципрофлоксацину на 6,7% (с 60 до 66,7%), Ко-тримоксазолу на 11% (с 89 до 100%), полимиксину Е на 13,3% (с 0 до 13,3%).
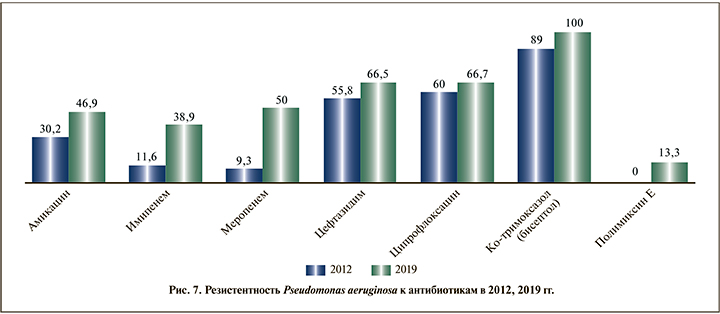
При исследовании резистентности пациентов реанимационного отделения с выделенными штаммами Acinetobacter baumannii (рис. 8) отмечено увеличение резистентности к амикацину на 61,6% (с 33,3 до 94,9%), цефтазидиму на 59% (с 41 до 100%), ампициллину на 12,4% ( с 87,6 до 100%), имипенему на 62,6% (с 29,7 до 92,3%), ципрофлоксацину на 45,9% (с 54,1 до 100%), полимиксину Е на 5,8% (с 5,3 до 11,1%).
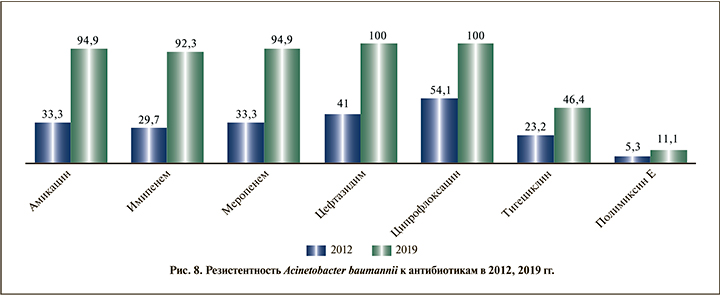
В группе пациентов с выделенной S. haemolyticus (рис. 9) прослежено появление резистентности к ванкомицину (6,3%), увеличение к амикацину на 24,3% (с 0,7 до 25,0%), амоксициллину/клавулановой кислоте на 24,5% (с 0,5 до 25%), Ко-тримоксазолу на 1,2% (с 7,1 до 8,3%), оксациллину на 34,5% (с 15,5 до 50%), эритромицину на 4% (с 31 до 35%), клиндамицину на 11,5% (с 30 до 41,5%). При этом отмечено снижение резистентности к левофлоксацину на 3,8% (с 12,5 до 8,7%).
При анализе штаммов S. aureus (рис. 10) имело место увеличение резистентности к амикацину на 28,9% (с 14 до 42,9%), цефуроксиму на 35,8% (с 7,1 до 42,9%), левофлоксацину на 17,4% (с 14,3 до 31,7%), оксациллину на 26,8% (с 35,7 до 62,5%), эритромицину на 5,6% (с 38,8 до 44,4%). Снижение резистентности отмечено к амоксициллину/клавулановой кислоте на 7,1% (с 21,4 до 14,3%), Ко-тримоксазолу на 12,2% (с 24,7 до 12,5%).
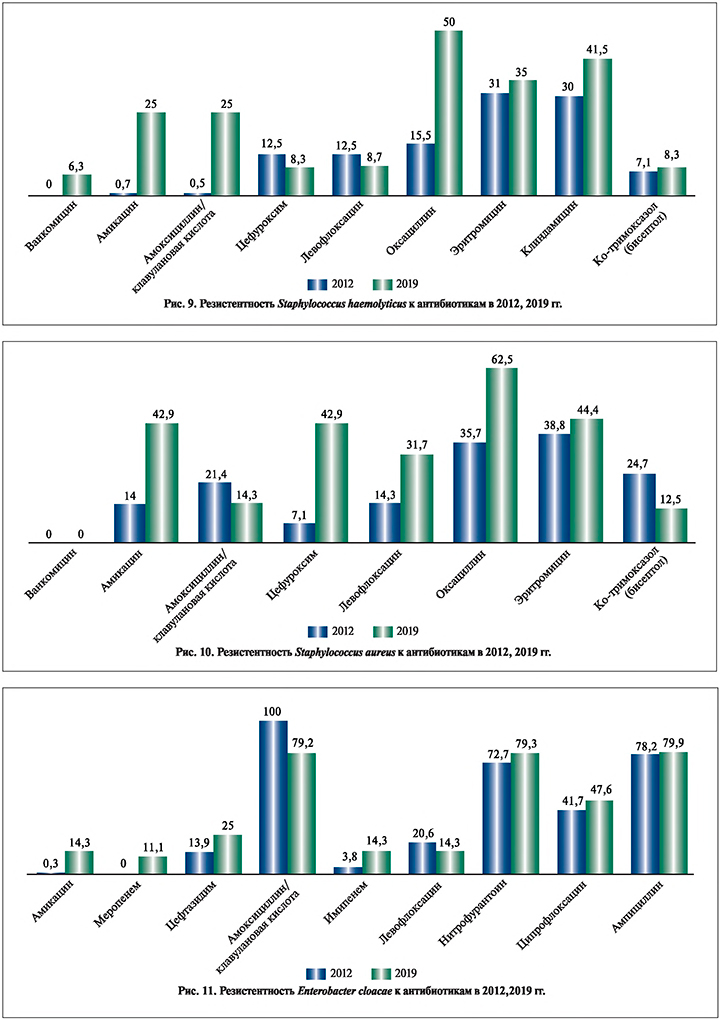
Анализ чувствительности Enterobacter cloacae (рис. 11) демонстрирует появление резистентности к меропенему (11,1%), увеличению к имипенему на 10,5% (с 3,8 до 14,3%) амикацину на 14% (с 0,3 до 14,3%), нитрофурантоину на 6,6% (с 72,7 до 79,3%), ципрофлоксацину на 5,9% (с 41,7 до 47,6%), ампициллину на 1,7% (с 78,2 до 79,9%). Отмечается снижение резистентности к амоксициллину/клавулановой кислоте на 20,8% (с 100 до 79,2%), левофлоксацину на 6,3 % (с 20,6 до 14,3%).
Обсуждение. Согласно проведенному исследованию, к концу 2019 г. среди пациентов, поступивших и проходивщих лечение в урологических стационарах, превалирующее место в возникновении осложненной ИМП заняли E. faecalis (41%), E. coli (36,4%), K. pneumonia (23,4%) и P. mirabilis (7,6%). Кроме того, увеличилось количество штаммов, резистентных к определенным группам антибактериальных препаратов: мецитиллин-резистентных стафилококков (на +4%), продуцентов β-лактамаз (на +19,8% [для E. coli и на +34,7% [для K. рneumoniae]), ванкомицин-резистентных энтерококков (на +1,89%), продуцентов карбапенемаз (на +32,9%).
Выявлен высокий уровень резистентности среди штаммов E. faecalis к ципрофлоксацину (23,1%) и гентамицину (38,4%). Среди штаммов E. coli отмечено повышение резистентности к ампициллину (85,7%), цефтазидиму (66,7%), ципрофлоксацину (54,1%) и нитрофурантоину (42,9%). Отмечено появление карбапенем-резистентных штаммов. Среди штаммов K. pneumonia замечен значительный прирост резистентности ко всем используемым антибактериальным препаратам. Отдельно можно отметить резкий (27,1%) прирост резистентности к карбапенемам. Высокий уровень резистентности выявлен у P. mirabilis к ципрофлоксацину (66,7%), ампициллину (75%). Прослежено увеличение резистентности у P. aeruginosa к ципрофлоксацину (66,7%), меропенему (50%). Имел место высокий уровень резистентности Acinetobacter baumannii к амикацину (94,9%), имипенему (92,3%), цефтазидиму (100%), ципрофлоксацину (100%), тигециклину (53,6%). Относительно высокая чувствительность сохранялась к полимиксину Е (88,9%).
Сопоставимые результаты продемонстрировало многоцентровое исследование «ДАРМИС-2018» [6], по данным которого наиболее частыми видами микроорганизмов у пациентов с ИМП были E. coli (71,3%) и K. pneumoniae (11,7%). Доля E. faecalis в популяции пациентов с ИМП составила 6,2%. Из парентеральных антибактериальных препаратов наибольшей активностью в отношении E. coli обладали меропенем (из карбапенемов) и амикацин (99,4 и 97,9%), чувствительность к ципрофлоксацину составила 60,6%. Частота продукции БЛРС среди изолятов E. coli составила 32,6% в субпопуляции пациентов с осложненной ИМП. По сравнению с предыдущим исследованием «ДАРМИС» (2010–2011) статистически значимо выросло количество штаммов, продуцирующих БЛРС, – с 8,5 до 27,0%. Таким образом, согласно данным исследования, особую настороженность вызывают высокая частота резистентности к фторхинолонам и резкий рост продукции БЛРС у энтеробактерий.
Согласно проведенному нами исследованию по встречаемости и резистентности микроорганизмов к антибактериальным препаратам, выделенных в посевах мочи пациентов, находившихся на стационарном лечении с инфекцией мочевыводящих путей с 2012 по 2019 г., широкое применение антибактериальной терапии, использование резервных антибактериальных препаратов в качестве эмпирической терапии привели к появлению штаммов, таких как K. pneumoniae, A. baumannii, которые обладают панрезистентностью, а также увеличению штаммов, продуцирующих карбапенемазы (на 32,9%). В связи с этим для замедления темпа резистентности микроорганизмов к антибактериальным препаратам в каждом стационаре и на этапе амбулаторного звена необходим постоянный надзор за спектром чувствительности микроорганизмов. До назначения эмпирической терапии необходим забор материала для бактериологического исследования, а также как можно раннее избавление пациентов от дренажей и катетеров. Придерживаясь стратегии рациональной антибиотикотерапии, необходимо дальнейшее мониторирование проблемы антибиотикорезистентности, выявление резистентных штаммов, широкое введение в практику ускоренной лабораторной диагностики маркеров резистентности бактерий.
Заключение. Результаты нашего анализа демонстрируют стремительный рост резистентности к большинству антибактериальных препаратов среди внутрибольничных штаммов. Исходя их этого, результаты локального мониторинга чувствительности уропатогенов должны лежать в основе схем эмпирической терапии урологических отделений. Регулярный пересмотр последних, жесткий контроль за назначением антибактериальной терапии в стационаре и соблюдение национальных стандартов в отношении проведения антибиотикопрофилактики помогут затормозить распространение резистентности уропатогенов к АБП, тем самым улучшить результаты лечения пациентов с ИМП.



