Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) – самое распространенное пролиферативное заболевание предстательной железы (ПЖ) среди мужчин пожилого возраста [1–3].
В запуске пролиферативных процессов в ткани ПЖ важную роль играет инфекционно-воспалительный процесс, при этом возможна гистиолимфоцитарная и/или лейкоцитарная инфильтрация. Некоторые представители лимфоцитарного звена характеризуются высокой миогенной активностью за счет способности продуцировать факторы роста фибробластов [4–6]. Кроме того, длительный хронический инфекционно-воспалительный процесс в ПЖ приводит к значительному ухудшению метаболических процессов в ней и ускоряет процессы пролиферации, что обусловливает прогрессивный рост гиперплазированной ткани ПЖ [7].
Клинически ДГПЖ проявляется так называемыми симптомами нижних мочевыводящих путей (СНМП). Однако следует помнить, что СНМП служат неспецифическими симптомами ДГПЖ, они могут иметь место и при других заболеваниях репродуктивных органов и мочевых путей, в том числе и при хроническом бактериальном простатите (ХБП), поэтому важно, чтобы назначаемая медикаментозная терапия влияла на все факторы патогенеза заболевания [8, 9].
Симптомы нижних мочевыводящих путей при ДГПЖ подразделяют на обструктивные (симптомы опорожнения) – затрудненное мочеиспускание и/или прерывистое мочеиспускание; ирритативные (симптомы накопления) – учащенное мочеиспускание небольшими порциями (поллакиурия), в том числе ночная поллакиурия, императивные позывы к мочеиспусканию, ургентное недержание мочи; постмиктурические – подкапывание мочи и/или ощущение неполного опорожнения мочевого пузыря после мочеиспускания [8]. Наличие СНМП диктует необходимость включения в комплекс лечения лекарственных препаратов, влияющих как на обструктивные, так и на ирритативные и постмиктурические симптомы [7].
Накопленный за последние годы опыт лечения ДГПЖ, уточнение патогенетических особенностей заболевания позволяют врачам, занимающимся данной проблемой, назначать лечение, когда симптомы заболевания невыраженные (легкие, умеренные) и нет функциональных нарушений мочевых путей [9].
Современная фармакотерапия ДГПЖ включает различные лекарственные препараты, влияющие на различные звенья патогенеза ДГПЖ. Лекарственную терапию получают 85–90% пациентов с ДГПЖ, и только 10–15% из них подвергаются оперативному вмешательству в связи с прогрессирующим течением заболевания [10].
В настоящее время медикаментозная терапия ДГПЖ включает традиционно два основных класса препаратов: α-адреноблокаторы (доксазозин, альфузозин, теразозин, тамсулозин и силодозин) и ингибиторы 5α-редуктазы (финастерид, дутастерид), которые не всегда устраивают пациентов вследствие негативного влияния на различные составляющие сексуальной функции или обусловливают развитие ряда других нежелательных эффектов [9, 10].
В связи с этим часто для лечения ДГПЖ с легкой или умеренной симптоматикой широко используют растительные средства (экстракты различных растений), которые воздействуют как на пролиферативный, так и на инфекционный компартамент гиперплазированной ткани ПЖ, что особенно актуально при ДГПЖ, ассоциированной с ХБП [8].
На рынке Европейского Союза зарегистрировано множество растительных лекарственных препаратов на основе экстрактов Serenoa repens, которые отличаются друг от друга не только по происхождению, но и по содержанию в них различных стеролов, флавоноидов, свободных жирных кислот и др. [11].
В ходе многочисленных исследований in vitro установлено, что все экстракты Serenoa repens снижают активность 5α-редуктазы вне зависимости от способа их получения [12, 13]. Причем Serenoa repens снижает активность 5α-редуктазы как в эпителиальных, так и в стромальных клетках ПЖ [13, 14]. Эффективность Serenoa repens повышается в комбинации с Urtica dioiccus, так как при этом суммируются антипролиферативный и противовоспалительный эффекты на ткань ПЖ. Известно, что инфекционно-воспалительный процесс в ткани ПЖ играет важную, а зачастую ведущую роль в процессе прогрессирования ДГПЖ, поэтому одним из значимых патогенетических направлений является действие на воспалительный процесс в простате. Доказано, что Urtica dioiccus у оказывает более выраженное по сравнению с другими растительными препаратами, применяемыми для лечения ДГПЖ, ингибирующее влияние на циклооксигеназу, что приводит к снижению уровня медиаторов воспаления: простагландинов, простациклинов. Кроме того, Urtica dioiccus ингибирует лейкоцитарную эластазу, которая вызывает деградацию протеина (А-кофактора местной противовоспалительной и антимикробный защиты), расщепляет иммуноглобулины, снижает миграцию в зону воспаления Т-лимфоцитов [14].
Все вышеперечисленное делает обоснованным совместное назначение комбинации Serenoa repens и Urtica dioiccus, реализованное в препарате Простагут форте, для лечения ДГПЖ с легкой или умеренной симптоматикой, ассоциированной с ХБП.
Цель исследования: оценить эффективность Простагут-форте для лечения СНМП у пациентов с ДГПЖ, ассоциированной с хроническим воспалением в ПЖ.
Материалы и методы. Обследованы 102 пациента в возрасте 45–80 лет с диагнозом ДГПЖ, ассоциированной с ХБП. Всем пациентам выполняли физикальное обследование, пальцевое ректальное исследование, лабораторные тесты (общеклинические исследования крови и мочи, микроскопическое и бактериологическое исследование секрета ПЖ, ПСА, тестостерон крови, урофлометрия, трансректальное УЗИ (ТРУЗИ). Для оценки симптомов заболевания использовали шкалу IPSSВ. В зависимости от проведенной терапии пациенты были разделены на две группы по 51 человеку. В 1-й группе пациенты получали терапию Serenoa repens в комбинации с Urtica dioiccus в дозе 160/120 мг 2 раза в сутки, во 2-й группе – Serenoa repens в дозе 320 мг 1 раз в сутки. Курс лечения в обеих группах составил 3 мес.
В целом группы были сопоставимы по результатам обследования и характеру жалоб (табл. 1, 2).
Результаты лечения оценивали через 1 и 3 мес. после лечения.
Задачами исследования были:
- Оценить влияние препарата на динамику СНМП у пациентов с ДГПЖ, ассоциированной с хроническим воспалением в ткани простаты.
- Оценить влияние Простагут форте на максимальную скорость потока мочи (Qmax).
- Оценить влияние препарата на объем ПЖ и остаточной мочи.
- Оценить влияние препарата на уровень лейкоцитов в СПЖ.
Критерии включения:
- амбулаторные пациенты с СНМП на фоне ДГПЖ, ассоциированной с ХБП;
- возраст пациента старше 45 лет;
- наличие легкой и умеренной симптоматики по IPSS;
- выраженность симптомов по шкале IPSS более 8 баллов;
- Qmax более 5 мл/с, менее 13 мл/с;
- объем остаточной мочи не более 100 мл;
- отсутствие признаков рака предстательной железы;
- отсутствие клинических признаков активации инфекционно-воспалительного процесса в ПЖ;
- наличие лабораторных признаков хронического воспаления в ПЖ;
Критерии невключения:
- оперативные вмешательства на органах малого таза;
- склероз шейки мочевого пузыря;
- онкологические заболевания;
- нейрогенные расстройства мочеиспусканий;
- почечная, печеночная недостаточность;
- прием препаратов, влияющих на качество мочеиспускания (α1–aдреноблокаторы, ингибиторы 5α-редуктазы, диуретики и др.);
- острый инфекционно-воспалительный процесс в ткани ПЖ.
Результаты исследования обрабатывали с использованием электронных таблиц Microsoft Excel из пакета программ Microsoft Office 2007. Для статистической обработки данных применяли статистический пакет STATISTICA 6.1 (StatSoft Inc., США). Проведение расчетов и интерпретацию результатов осуществляли согласно руководству О. Ю. Ребровой. Соответствие распределения признаков закону нормального распределения проводилось с применением критерия Шапиро–Уилка.
Качественные данные представлены как абсолютные и относительные частоты (проценты). Описательная статистика количественных признаков представлена в виде среднего и стандартного отклонений (M±s). Для изучения связей качественных признаков использовали метод построения таблиц сопряженности, знаков и заголовков с применением критерия χ2 и критерия χ2 с поправкой Йетса, при возможности использовался точный двусторонний критерий Фишера. Сравнение независимых переменных в двух группах осуществляли непараметрическим методом с применением критерия Манна–Уитни.
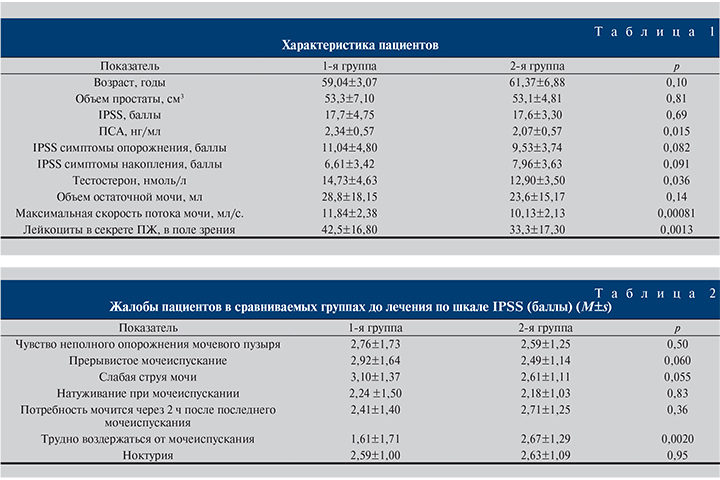
Результаты. За время наблюдения на фоне проводимого лечения отмечено снижение СНМП в обеих группах. Однако при оценке симптомов по шкале IPSS у пациентов, принимавших Serenoa repens в комбинации с Urtica dioiccus, отмечено более выраженное снижение симптоматики по шкале IPSS по сравнению с контрольной группой (p<0,005; рис. 1).
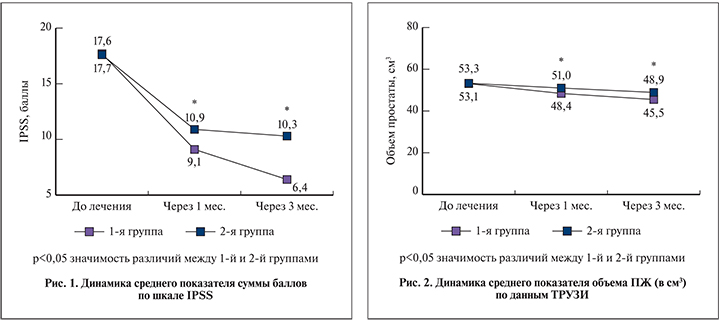
Статистически значимого изменения объема ПЖ по данным ТРУЗИ не выявлено. В то же время отмечено статистически значимое снижение объема остаточной мочи. При этом у пациентов 1-й группы получены достоверно лучшие результаты через 1 и 3 мес. лечения по сравнению с пациентами 2-й группы. Так, через 1 мес. отмечено снижение объема остаточной мочи в 1-й группе до 6,4±7,54 мл, а во 2-й – до 14,3±9,03 мл (p<0,005). Через 3 мес. данный показатель в соответствующих группах составил 4,3±6,48 и 12,00±11,42 мл (рис. 2, 3).
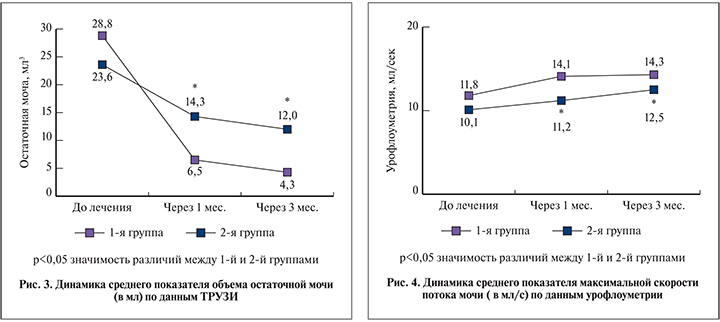
При оценке максимальной скорости потока мочи (Qmax) по данным урофлометрии исходно и через 1, 3 мес. лечения улучшение показателя было более выраженным у пациентов 1-й группы. Так, исходно в 1-й группе он был равен 11,8±2,38 мл/с, во 2-й – 10,1±2,13 мл/с, через 1 мес. – 14,1±2,13 и 11,2±2,04 мл/с, через 3 мес. – 14,3±2,13 и 12,5±1,95 мл/с соответственно (p<0,005; рис. 4).
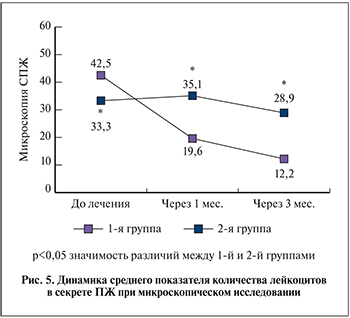 Среднее число лейкоцитов в секрете ПЖ до лечения в 1-й группе составило 42,5±16,8 х/, во 2-й группе – 33,3±17,3 х/. На фоне проведенной терапии снижение уровня лейкоцитов в секрете ПЖ через 1 мес. наблюдалось только в 1-й группе – 19,6±14,5 х/, тогда как во 2-й группе уровень лейкоцитов практически не изменился – 35,1±19,6 х/. Через 3 мес. данный показатель в 1-й группе практически соответствовал нормативным значениям – 12,2±14,58 х/, а во 2-й группе оставался высоким – 28,9±21,10 х/(p<0,005; рис. 5).
Среднее число лейкоцитов в секрете ПЖ до лечения в 1-й группе составило 42,5±16,8 х/, во 2-й группе – 33,3±17,3 х/. На фоне проведенной терапии снижение уровня лейкоцитов в секрете ПЖ через 1 мес. наблюдалось только в 1-й группе – 19,6±14,5 х/, тогда как во 2-й группе уровень лейкоцитов практически не изменился – 35,1±19,6 х/. Через 3 мес. данный показатель в 1-й группе практически соответствовал нормативным значениям – 12,2±14,58 х/, а во 2-й группе оставался высоким – 28,9±21,10 х/(p<0,005; рис. 5).
Обсуждение. ДГПЖ – одно из наиболее часто встречаемых заболеваний у мужчин. Клиническими проявлениями заболевания являются СНМП. Поэтому основная цель терапии – уменьшение СНМП и в совокупности лечение должно улучшать качество жизни пациентов с СНМП на фоне ДГПЖ. Общепринятым стало консервативное лечение пациентов СНМП, обусловленными ДГПЖ, у которых нет абсолютных показаний к оперативному лечению. Альфа1-адреноблокаторы и ингибиторы 5α-редуктазы стали основой терапии СНМП при ДГПЖ. Но в настоящее время имеется немало работ, посвященных роли растительных препаратов, в частности Serenoa repens, в лечении гиперплазии ПЖ. Проведенный нами сравнительный анализ результатов лечения пациентов с гиперплазией простаты, ассоциированной с ХБП, доказал более высокую эффективность комбинированного Serenoa repens.
Результаты проведенного нами исследования отчетливо демонстрируют значительный терапевтический эффект препарата Простагут форте. Важным клиническим критерием эффективности лечения стало снижение выраженности как обструктивной, так и ирритативной симптоматики (рис. 6).

Данные изменения являются достоверными и статистически значимыми.
Хронический воспалительный процесс ткани служит пусковым механизмом пролиферативных процессов в ПЖ [15, 16]. А синергизм составляющих препарата Простагут форте способствует активному регрессу инфекционно-воспалительного процесса в ткани ПЖ по сравнению с терапией, включающей только Serenoa repens, что приводит к редукции пролиферативных реакций в простате, а следовательно, к уменьшению объема органа. В нашем исследовании объем предстательной железы в 1-й группе к концу периода наблюдения был меньше, чем во 2-й группе.
Увеличение Qmax и уменьшение объема остаточной мочи позволяют констатировать улучшение уродинамических показателей мочеиспускания.
Лабораторным критерием эффективности лечения пациентов с ДГПЖ, ассоциированной с хроническим воспалением ткани простаты, в нашем исследовании была динамика уровня лейкоцитов в секрете ПЖ. Применение Serenoa repens в комбинации с Urtica dioiccus (Простагут форте) в течение 3 мес. позволило практически нормализовать данный показатель, при том что влияние монотерапии оказалось гораздо менее выраженным. Этот факт подтверждает обоснованность назначения комбинации Serenoa repens и Urtica dioiccus (Простагут форте), обладающей наряду с антипролиферативным и противовоспалительным эффектом.
Подводя итог, следует отметить, что, несмотря на отсутствие убедительных доказательств эффективности лекарственных препаратов растительного происхождения в международных клинических исследованиях, фитотерапия ДГПЖ остается популярной методикой лечения. Сложный механизм действия фитопрепаратов труден для детального понимания, что требует дальнейшего изучения и исследования. Однако точно известно, что хронический инфекционно-воспалительный процесс часто является инициатором развития пролиферативных процессов в ткани железы.
Заключение. Serenoa repens является эффективным препаратом для терапии СНМП на фоне ДГПЖ, ассоциированной с ХБП, что проявляется уменьшением СНМП, увеличением Qmax, снижением объема остаточной мочи и интенсивности воспалительного процесса в ткани ПЖ.
Однако при ДГПЖ, ассоциированной с хроническим воспалением, предпочтительно использование Serenoa repens в комбинации с Urtica dioiccus.



