Введение. Нарушения семяизвержения являются одной из главных проблем в группе относительно молодых (35–60 лет) пациентов с наличием инфравезикальной обструкции, которая является следствием гиперплазии или склероза предстательной железы. Несмотря на развитие и широкое внедрение в клиническую практику в последние годы лазерных технологий, позволивших снизить общую частоту осложнений оперативного лечении гиперплазии предстательной железы (ГПЖ), частота эякуляторных нарушений по-прежнему остается высокой [4–7]. Применяющиеся на сегодняшний день методы оперативного лечения ГПЖ приводят к нарушениям эякуляции, по разным данным, в 62–75% наблюдений [2]. На наш взгляд, столь высокий процент послеоперационных нарушений семяизвержения требует изучения, оценки и коррекции. При этом имеющиеся в литературе сведения о нарушениях семяизвержения и качестве сексуальной жизни больных, оперированных по поводу ГПЖ, крайне немногочисленны и противоречивы. Большинство публикаций посвящено ретроградному семяизвержению, отсутствуют исследования по изучению других видов эякуляторных дисфункций. В ряде работ развитие ретроградного семяизвержения после оперативного лечения ГПЖ подвергается сомнению, уступая предположению о развитии анэякуляции вследствие повреждения musculus ejaculatorius [8].
У больных ГПЖ после оперативного лечения встречаются следующие виды нарушений семяизвержения: ранняя эякуляция, задержка эякуляции (затрудненная эякуляция), ретроградная эякуляция, анэякуляция, снижение скорости (интенсивности) эякуляции и объема эякулята, боль во время эякуляции и гематоспермия. Утрата естественной эякуляции может приводить к расстройствам оргазма, развитию эректильной дисфункции, сопровождается психосоциальной дезадаптацией и невозможностью деторождения естественным образом [3]. Помимо риска кровотечения и развития других интраи послеоперационных осложнений утрата возможности естественной эякуляции остается основной причиной отказа пациентов от выполнения операции, несмотря на наличие у них показаний к ее выполнению [26].
Цель исследования – изучить характер нарушений семяизвержения у больных ГПЖ после оперативного лечения. В нашей работе мы не ставили целью сравнить влияние на семяизвержение различных методик и техник оперативного лечения больных ГПЖ. Нами выбраны наиболее широко применяемые в ежедневной урологической практике операции и оценены наличие и развитие нарушений эякуляторной дисфункции у одних и тех же больных до и после операции. Мы хотим подчеркнуть, что определяли возникавшие нарушения у тех же пациентов, у которых мы оценивали эякуляторную функции до операции.
Материалы и методы. Проведено проспективное исследование эякуляторной функции 224 сексуально активных мужчин в возрасте от 49 до 84 лет с симптомам нарушенного мочеиспускания (СНМ) при ГПЖ (СНМ/ГПЖ) до и после оперативного лечения. В исследование не включались пациенты с гистологическими признаками рака простаты, с камнями в мочевом пузыре, со стриктурой уретры или рубцовой деформацией шейки мочевого пузыря, а также пациенты с тяжелой формой эректильной дисфункции (ЭД) и пациенты, не живущие половой жизнью. Критериями включения в исследование были больные с СНМ средней или тяжелой степени тяжести, обусловленной ГПЖ; наличие регулярной половой жизни; интеллектуальный уровень и образование, достаточные для понимания сексуальной дисфункции, согласие больных принять участие в исследовании и решение Этического комитета Сеченовского Университета (протокол решения Этического комитета № 01-21 от 22.01.2021).
За период с 2018 по 2021 г. 72 больным была выполнена эндоскопическая тулиевая лазерная энуклеация гиперплазии простаты (ThuLep), 136 больным – монои биполярная трансуретральная резекция (ТУР) простаты и 16 больным – открытая чреспузырная аденомэктомия (АЭ).
Оперативное лечение проводилось сертифицированными урологами, имеющими большой опыт оперативных вмешательств. Эндоскопическая тулиевая лазерная энуклеация гиперплазии простаты и традиционная ТУР простаты не носили эякуляторно-сберегающего характера.
Всем пациентам на предоперационном и послеоперационном этапах выполнено традиционное обследование больного с СНМ/ГПЖ: определялся балл по шкале IPSS; проводились урофлоуметрия с определением максимальной скорости потока мочи (Qmax), анализ крови на общий простатоспецифический антиген (PSAt), общий анализ мочи; выполнялись трансабдоминальное и трансректальное ультразвуковое исследования предстательной железы и определение объема остаточной мочи, эректильная функция оценивалась с помощью анкеты МИЭФ-5. Оценка функции семяизвержения проводилась путем анкетирования по шкале оценки семяизвержения – Male Sexual Health Questionnaire (MSHQ-EjD) в предоперационном этапе и в сроки через 3 и 6 мес. после оперативного лечения. Для диагностики раннего семяизвержения применяли анкетирование по опроснику КриПС (критерии преждевременного семяизвержения, Н.Д. Ахвледиани, 2008). С целью дифференциальной диагностики ретроградного семяизвержения и анэякуляции больным через 3 мес. после оперативного лечения проводили анализ посторгазменной мочи на наличие и количество сперматозоидов.
Статистический анализ проводился с использованием программы StatTech v. 2.8.8 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). Количественные показатели, имевшие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me), нижнего и верхнего квартилей (Q1–Q3). Направление и теснота корреляционной связи между двумя количественными показателями оценивались с помощью коэффициента корреляции Пирсона (при нормальном распределении сопоставляемых показателей).
Результаты. Нарушения семяизвержения до оперативного лечения по поводу ГПЖ. Различные нарушения семяизвержения выявлены у 61,6% исследуемых мужчин. У одного пациента могло быть сочетание нескольких нарушений: 108 (48,2%) опрошенных отметили уменьшение объема эякулята, 106 (47,3 %) – снижение интенсивности (скорости) семяизвержения. В 16,1% (36) наблюдений было выявлено приобретенное преждевременное семяизвержение, 17 % (38 человек) сообщили о боли/дискомфорте при семяизвержении, 11,6% (26 человек) указали на задержку эякуляции (ЗЭ) во время полового акта (вопрос № 5 MSHQ-EjD) (рис. 1). Пациентов с анэякуляцией исходно среди исследуемых не было. Раннее семяизвержение установлено анкетированием по опроснику КриПС, причем все пациенты указали на наличие периода половой жизни с нормальной продолжительностью коитуса. Болезненность/ дискомфорт при семяизвержении чаще всего локализовались в области полового члена, промежности и нижней части живота. Выраженность болевых ощущений варьировалась от незначительного дискомфорта до изнуряющих болей, снижающих сексуальное удовлетворение половым актом.
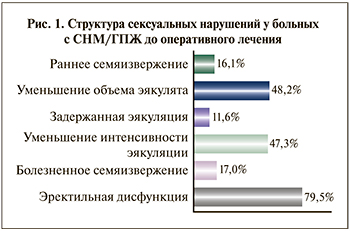
Согласно ответам на вопросы анкеты IPSS, у 224 больных ГПЖ до оперативного лечения нарушения мочеиспускания умеренной и тяжелой степеней были выявлены у 86 (38,4%) и 138 (61,6%) респондентов соответственно. Средний балл по шкале IPSS составил 21,5 балл.
Нами выявлена статистически значимая связь между степенью тяжести СНМ по опроснику IPSS и уменьшением интенсивности эякуляции (p=0,001), а также уменьшением объема эякулята (p<0,001). Так, пациенты с тяжелыми СНМ (балл по шкале IPSS – 20–35) в 3,7 раза чаще отмечали уменьшение интенсивности эякуляции (95% ДИ: 1,663–8,602) и в 4 раза чаще уменьшение объема эякулята (95% ДИ: 1,764 – 9,154), чем пациенты с умеренными СНМ (IPSS 8-19) (табл. 1).
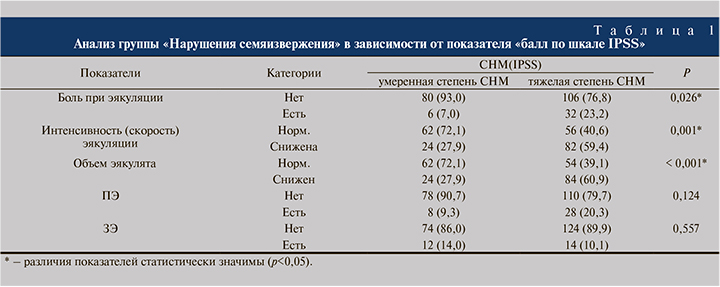
На боль при семяизвержении также чаще жаловались мужчины с более выраженными СНМ – IPSS >20 (p=0,026). Шансы на наличие боли при эякуляции в группе больных с СНМ тяжелой степени были выше в 4,025 раза по сравнению с группой больных с СНМ умеренной степени, различия шансов были статистически значимыми (95% ДИ: 1,097–14,764).
При анализе показателей «преждевременное семяизвержение» и «задержанное семяизвержение» в зависимости от показателя «тяжесть СНМ» нам не удалось выявить значимых различий (p=0,124, p=0,557 соответственно). Преждевременное семяизвержение среди обследованных встречалось почти с одинаковой частотой как у пациентов с умеренными СНМ, так и среди больных с тяжелыми СНМ (табл. 1).
Нарушения семяизвержения после оперативного лечения по поводу ГПЖ. Среди 224 больных через 3 мес. после оперативного лечения выявлены нарушения семяизвержения следующего характера: ретроградная эякуляция (РЭ) – у 78 (34,8%) и анэякуляция – у 90 (40,2%) больных. У остальных 56 (25%) больных после оперативного лечения антеградное семяизвержение было сохранено. Среди больных с сохраненным антеградным семяизвержением (56 человек) проводилось дополнительное анкетирование, которое показало снижение объема эякулята и снижение интенсивности семяизвержения у 46 (20,5%) и 36 (16,1%) больных соответственно. Также среди этих больных были те, кто отметил наличие боли при семяизвержении – 4 (1,8%) человека, больных с ранним семяизвержением и задержанной эякуляцией выявлено не было (рис. 2).
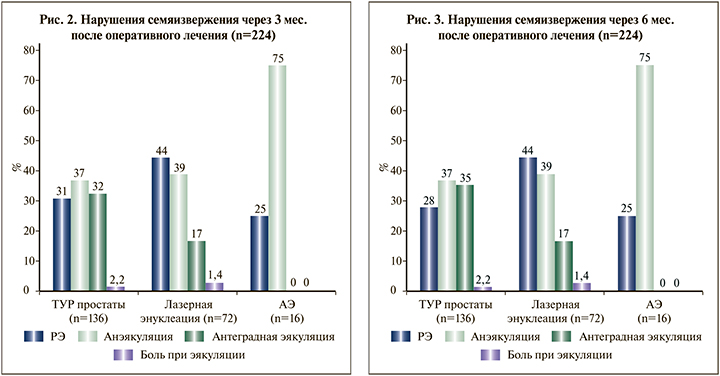
При оценке функции семяизвержения через 6 мес. в группе ТУР простаты РЭ была установлена у 38 (27,9%) больных, анэякуляция сохранялась также у 50 (36,8%) больных, а антеградное семяизвержение отметили 48 (35,3%) человек. Таким образом, у четырех больных в группе ТУР простаты наблюдалось восстановление антеградного семяизвержения. Среди больных, которым выполнялись ThuLep и открытая аденомэктомия (АЭ), различий в показателях через 3 и 6 мес. диагностировано не было (рис. 2 и 3).
Нами была проведена оценка зависимости вероятности возникновения нарушений семяизвержения от различных характеристик пациентов. Не было выявлено статистически значимых различий зависимости нарушений семяизвержения от возраста больных, оперированных по поводу ГПЖ. Проведена оценка вероятности развития нарушений семяизвержения (ретроградная эякуляция, анэякуляции) после оперативного лечения в зависимости от значения объема предстательной железы до оперативного лечения (табл. 2).
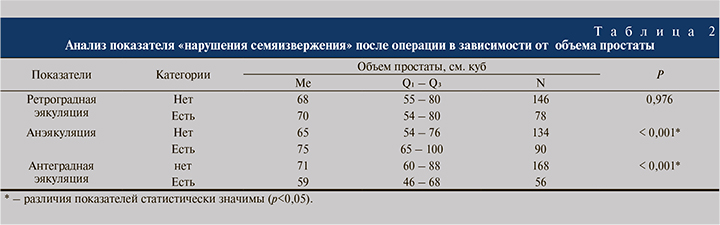
Были отмечены статистически значимые различия показателей «анэякуляция» и «антеградная эякуляция» в зависимости от показателя «объем простаты» (p<0,001). Чем больше был объем простаты/удаленной аденоматозной ткани, тем больше была вероятность развития анэякуляции и отсутствия антеградного семяизвержения. При оценке показателя «ретроградная эякуляция» в зависимости от показателя «объем простаты» не удалось выявить статистически значимых различий (p=0,976). Также при сравнении показателя «болезненное семяизвержение» в зависимости от показателя «объем простаты» не удалось выявить статистически значимых различий (p=0,912).
Нами был выполнен анализ показателя «нарушения эякуляции после операции» в зависимости от показателя «Q max» (максимальной скорости потока мочи) до оперативного лечения (табл. 3).
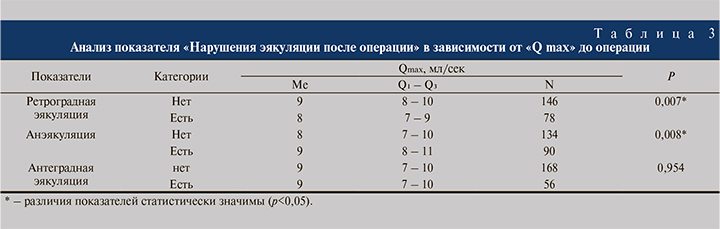
Исходя из полученных данных, при анализе показателей «ретроградная эякуляция» и «анэякуляция» в зависимости от показателя «Qmax» до оперативного вмешательства нами были установлены статистически значимые различия (p=0,007, p=0,008 соответственно). При оценке показателя «антеградная эякуляция» в зависимости от показателя «Qmax» не удалось выявить статистически значимых различий (p=0,954).
Обсуждение. В научной литературе приводятся различные данные о распространенности нарушений семяизвержения у мужчин, оперированных по поводу ГПЖ. Нарушения семяизвержения лучше всего изучены после ТУР простаты, которая до сих пор остается «золотым» стандартом лечения ГПЖ. Частота развития ретроградной эякуляции после ТУР простаты, по данным анализа 30 исследований, была равна 66,1% [10]. В нескольких исследованиях проводилась сравнительная оценка влияния биполярной и монополярной ТУР предстательной железы на эякуляторную функцию. Во всех этих исследованиях подтверждено отсутствие статистически значимой разницы по влиянию на процесс семяизвержения между монополярной и биполярной ТУР [13–15]. В других исследованиях ТУР простаты сравнивали с активным наблюдением, в каких-то работах проводилась оценка влияния объема резецированной ткани простаты и типа петли (электрода) на частоту нарушений семяизвержения. В то же время ни в одном исследовании не изучалась зависимость частоты эякуляторных нарушений от таких предоперационных данных, как возраст больных, скорость мочеиспускания по данным урофлоуметрии, объем остаточной мочи, объем предстательной железы или наличие хронического простатита.
В связи с тем что эндоскопическая лазерная энуклеация в последние годы занимает лидирующую позицию среди хирургических методов лечения ГПЖ и, по данным Европейской ассоциации урологов (EAU), является методом выбора при объеме предстательной железы более 80 см3, исследований, касающихся влияния гольмиевой и туливой лазерных энуклеаций на функцию семяизвержения и эректильную функцию стало больше. Согласно результатам большинства сравнительных исследований, частота эякуляторных нарушений после лазерной энуклеации сопоставима с ТУР предстательной железы [12, 16]. Мы не нашли работ, в которых проводилось бы изучение состояния функции семяизвержения после открытой аденомэктомии. Всего в одном проспективном исследовании оценивалась удовлетворенность сексуальной функцией до и после аденомэктомии, но семяизвержение отдельно не оценивалось ни в одном из исследований [11].
Заключение. У больных ГПЖ до оперативного лечения встречались такие нарушения семяизвержения, как уменьшение объема эякулята – 48,2%, снижение интенсивности эякуляции – 47,3%, болезненное семяизвержение – 17%, раннее семяизвержение – 16,1% и задержка эякуляции – 11,6%. На данном этапе выявлена значимая связь между жалобами на уменьшение объема семенной жидкости и жалобами на снижение интенсивности (скорости) семяизвержения. Кроме этого статистически значимая связь была выявлена между степенью тяжести СНМ, уменьшением интенсивности эякуляции и уменьшением объема эякулята. Так, например, пациенты с тяжелыми СНМ (балл по шкале IPSS – 20–35) в 3,7 раза чаще отмечали уменьшение интенсивности эякуляции и в 4 раза чаще уменьшение объема эякулята, чем пациенты с умеренными СНМ (IPSS 8–19). На боль при семяизвержении также чаще жаловались мужчины с более выраженными СНМ.
У тех же больных после оперативного лечения преобладали ретроградная эякуляция – 34,8% (78) и анэякуляция – 40,2% (90). Всего у четверти (56 человек) больных антеградное семяизвержение было сохранено. Наличие боли при семяизвержении отметили 4 (1,8%) больных, тогда как до оперативного лечения на боль при эякуляции жаловались 38 (17%) человек. Основными факторами, влияющими на развитие нарушений семяизвержения после операции, были объем предстательной железы, наличие хронического воспаления в простате и снижение скорости мочеиспускания до оперативного лечения, в то время как возраст больного и дооперационная степень тяжести СНМ не оказывали существенного влияния на частоту и структуру нарушений семяизвержения. Анэякуляция прогнозировалась при значении объема предстательной железы выше 89 см3 или равном ей. Интересно, что прогнозировать сохранение антеградного семяизвержения после оперативного лечения было возможно лишь при значении объема предстательной железы меньше 68 см3.
Была выявлена статистически значимая зависимость ретроградной эякуляции и анэякуляции от скорости мочеиспускания (p=0,007, p=0,008 соответственно). Ретроградная эякуляция после оперативного лечения прогнозировалась при значении Qmax ниже 8,8 мл/с. Анэякуляция прогнозировалась при значении Qmax выше 10 мл/с или равном ей.
Нарушения семяизвержения: ретроградная эякуляция, анэякуляция, болезненное и раннее семяизвержение у больных после различных наиболее широко применяемых методов оперативного вмешательства при аденоме/ГПЖ: трансуретральной аденомэктомии, лазерной и электрохирургической энуклеации и открытых операций, представляют значимые проблемы. Зачастую больные, особенно молодого возраста, для которых сохранение антеградной эякуляции является важным, отказываются от операции, направленной на восстановление нарушенного мочеиспускания. Поиск методов сохранения эякуляторной функции при оперативном лечении больных гиперплазией/аденомой простаты, применение малоинвазивных технологий: Urolift, Rezum, iTUND у больных, заинтересованных в сохранении эякуляторной функции, является перспективным направлением развития в урологии.



