Введение. В течение многих лет доброкачественная гиперплазия предстательной железы (ДГПЖ) и хронический простатит (ХП) считаются одними из наиболее частых причин развития симптомов нижних мочевыводящих путей (СНМП) и входят в число наиболее значимых урологических заболеваний [1–5]. ДГПЖ выявляют у 42% мужчин до 60 лет и у 90% в возрасте старше 90 лет. Более 30% из них переносят хирургические операции по поводу данного заболевания [6–9]. ХП диагностируется у 25% мужчин, страдающих заболеваниями органов мочевыделительной системы, что превышает 9% всей мужской популяции, а по некоторым данным, распространенность заболевания может быть даже выше [1–5]. При этом ДГПЖ и ХП имеют ряд общих патогенетических механизмов развития и зачастую являются составляющими патологических изменений предстательной железы.
Гиперплазия простаты часто протекает на фоне воспалительных изменений, которые обычно носят очаговый характер и ограничены парауретральной зоной. По данным морфологического исследования, у 96,7% мужчин с ДГПЖ в ткани простаты выявлены признаки хронического воспаления различной степени выраженности [10]. Согласно результатам ряда других исследований, ДГПЖ выявлена у 57,2% мужчин с ХП, ХП – у 38,7% пациентов с ДГПЖ [6–9, 11].
Кроме того, важно отметить, что ДГПЖ и ХП существенно влияют на качество жизни мужчин и могут приводить к таким серьезным осложнениям, как острая задержка мочи и поражение верхних мочевыводящих путей, а также к эректильной дисфункции и психоэмоциональным нарушениям [12–14]. При этом сочетание этих заболеваний увеличивает риск развития осложнений [13–15].
Воспалительные изменения в простате на фоне ДГПЖ могут усиливать как ирритативные, так и обструктивные симптомы нижних мочевыводящих путей. Очень часто недооценка симптомов простатита становится причиной низкой эффективности медикаментозной терапии, а также приводит к увеличению числа осложнений после хирургического лечения [15–17].
В настоящее время в нашем арсенале имеется широкий выбор медикаментозных и немедикаментозных методов лечения ДГПЖ и ХП. Препаратом первой линии в терапии мужчин с ДГПЖ являются α-адреноблокаторы. Терапия ХП может включать достаточно большое количество различных препаратов, основными среди которых можно выделить антибактериальные и противовоспалительные средства. Кроме того, активно применяются фитопрепараты и физиотерапевтические методы лечения [1, 2]. Однако выбор правильной тактики лечения мужчин с ДГПЖ и ХП продолжает вызывать массу вопросов. Преобладание ирритативной симптоматики, отсутствие стойкого эффекта от приема α1-адреноблокаторов, частые обострения ХП требуют использования дополнительных методов в лечении таких пациентов [18, 19].
В последнее время все шире применяется новая группа энтомологических препаратов, представляющих собой биологически активные субстанции с противовоспалительными и антиоксидантными свойствами, полученные из биомассы определенных насекомых [20–22].
Аденопросин® – это энтомологический препарат, который получен из личинок непарного шелкопряда (Lymantria dispar) с использованием современных биотехнологий. Биологически активные компоненты препарата снижают образование фосфолипазы А2 и высвобождение арахидоновой кислоты, активность провоспалительных факторов ИЛ-6 и ИЛ-8, оказывают антипролиферативное действие, при этом уменьшается проницаемость капилляров, улучшается микроциркуляция в предстательной железе, редуцируется отек простаты, что позволяет использовать его как вспомогательное средство в лечении пациентов с ДГПЖ и ХП [23–26].
Цель исследования: изучить эффективность применения энтомологического препарата Аденопросин® в составе комплексной терапии, а также оценить отдаленные результаты лечения пациентов с ДГПЖ и ХП.
Материалы и методы. Нами проведено обследование и лечение 60 пациентов с ДГПЖ в сочетании с хроническим бактериальным простатитом категории II в стадии обострения, согласно классификации Национального института здоровья США (National Institutes of Health, NIH, 1995). Диагноз был установлен на основании анамнеза, результатов пальцевого ректального исследования простаты (ПРИ), трансректального ультразвукового исследования (ТРУЗИ), урофлоуметрии, анализа крови на простатоспецифический антиген (ПСА), микроскопии и бактериологического исследования секрета предстательной железы (ПЖ).
Пациенты были включены в исследование согласно следующим критериям: суммарный балл по шкале IPSS от 8 до 19, объем остаточной мочи (Vом) от 30 до 100 мл, объем предстательной железы (Vпж) более 30 см3, уровень ПСА в крови не более 4 нг/мл, максимальная скорость потока мочи по данным урофлоуметрии (Qmax) менее 15 мл/с, бактериальный характер воспаления (микробное число >104 КОЕ/мл), отсутствие сопутствующей медикаментозной терапии, подписанное информированное согласие на участие в исследовании.
Критерии невключения: камни мочевого пузыря и мочеточников, гематурия, подозрение на рак простаты или мочевого пузыря, аллергические реакции на используемые препараты, оперативные пособия на органах малого таза, инфекции мочевыводящих путей, нейрогенная дисфункция мочевого пузыря, врожденные аномалии развития мочеполовой системы, онкологические и тяжелые сердечно-сосудистые заболевания, сахарный диабет, гипогонадизм.
Методом случайной выборки пациенты были распределены в две группы по 30 человек.
В группу сравнения (ГС) были включены пациенты, которым проводилась традиционная терапия препаратом из группы α1-адреноблокаторов (тамсулозин 0,4 мг 1 раз в день в течение всего периода наблюдения) и антибактериальным препаратом группы фторхинолонов (левофлоксацин 500 мг 1 раз в день в течение 4 нед.). В основной группе (ОГ) проводилась аналогичная традиционная терапия, но в сочетании с Аденопросином по 1 свече 1 раз в день в течение 6 мес.
Оценка эффективности лечения проводилась при обращении (визит 1), через 4 нед. (визит 2), 3 мес. (визит 3), 6 мес. (визит 4), 12 мес. (визит 5) от начала лечения. Оценивали частоту мочеиспусканий в дневное и ночное время (ноктурия), средний балл по шкалам Международной системы суммарной оценки заболеваний предстательной железы в баллах (International Prostate Symptom Score, IPSS), оценки качества жизни (Quality of Life, QoL), Индекс шкалы симптомов хронического простатита (National Institute Of Health Chronic Prostatitis Symptom Index, NIH-CPSI), максимальную скорость потока мочи (Qmax), объем предстательной железы (Vпж) и объем остаточной мочи (Vом), результаты микроскопического и бактериологического исследования секрета простаты.
Статистическую обработку результатов проводили с помощью программы MS Exсel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли методы параметрической (t-test Cтьюдента) статистики. При оценке достоверности выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5 % (р<0,05).
Результаты. Сравнительная характеристика результатов исследования, полученных в течение 12 мес. в двух группах, представлена в таблице.
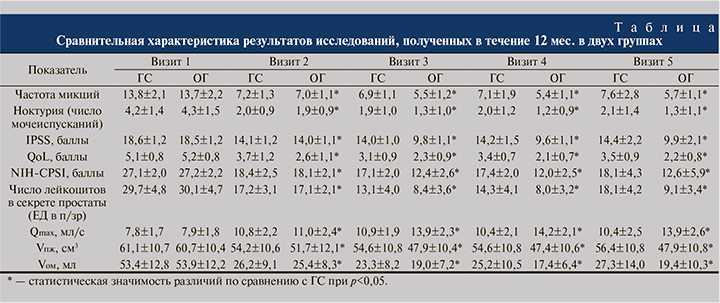
Согласно полученным в ходе исследования данным (см. таблицу), исходно группы были однородными, в исследуемых показателях не было выявлено достоверных различий. У всех пациентов, включенных в исследование, по результатам бактериологического исследования секрета простаты подтвержден бактериальный характер воспаления. В группе сравнения была выявлена E. coli, Ent. faecalis. В ОГ результаты были сопоставимыми: E. coli, Ent. faecalis, St. epidermidis. Все микроорганизмы были чувствительными к левофлоксацину.
Полученные в ходе визита 2 данные свидетельствуют об эффективности антибактериальной терапии, проведенной в обеих группах. По результатам бактериологического исследования секрета простаты у всех пациентов обеих групп не был выявлен рост микрофлоры.
За 12 мес. наблюдения зафиксировано 7 (23,3%) случаев рецидива ХП в группе сравнения и 1 (3,3%) – в основной. В обеих группах не было зафиксировано ни одного эпизода острой задержки мочи и случаев необходимости выполнения хирургического лечения. Кроме того, за весь период наблюдения не зарегистрировано нежелательных явлений, связанных с приемом препарата Аденопросин®.
Обсуждение. На сегодняшний день доказана роль воспаления в развитии ДГПЖ: клетки воспалительных инфильтратов (моноциты, макрофаги, нейтрофилы, лимфоциты, фибробласты и др.) продуцируют цитокины (IL-6, -8, -21), фактор роста фибробластов, что приводит к усилению пролиферации фибробластов и нарушению метаболических процессов в предстательной железе. Наличие простатита ускоряет рост гиперплазированной ткани простаты и усиливает выраженность клинической симптоматики заболевания [15, 16].
На фармацевтический рынок России Аденопросин® вышел в 2019 г., тем не менее он уже широко применяется в урологии при лечении ДГПЖ и ХП, а его эффективность подтверждена в ряде исследований, в которых были продемонстрированы противовоспалительные, антиоксидантные, ангиопротективные, иммуномодулирующие свойства препарата [20–26].
L. Olariu et al. выявили антиоксидантный эффект, связанный с уменьшением внутриклеточного пероксида водорода в клетках гиперплазии предстательной железы, а также значительное уменьшение активности внеклеточных IL-6 и IL-8, что подтверждает наличие противовоспалительного эффекта Аденопросина® [20].
В своем исследовании I. Dumbraveanu et al. назначали Аденопросин® мужчинам с хроническим простатитом и возникшей на его фоне эректильной дисфункцией. По результатам исследования у пациентов отмечено значительное уменьшение симптоматики хронического простатита [21].
Ghicavii V. et al. по результатам клинического исследования заключили, что Аденопросин® может уменьшать фиброзные изменения в простате и уменьшать ее объем при ДГПЖ. Данный препарат может быстро и эффективно влиять на устранение симптомов заболевания и улучшать уродинамические показатели уже в первые 3–4 нед. лечения. По мнению авторов, уменьшение объема предстательной железы происходит за счет как уменьшения парапростатического отека и венозной задержки в ткани предстательной железы, так и влияния на сосудистую фазу проницаемости капилляров при воспалении [23].
Согласно полученным в ходе нашего исследования данным, уже ко второму визиту были выявлены значимые различия между результатами в основной группе и группе сравнения. Так, количество дневных и ночных мочеиспусканий уменьшились, результаты по шкале IPSS, NIH-CPSI и QоL улучшились по сравнению с группой контроля (рис. 1). Через 3 и 6 мес. терапии от ее начала результаты в группе сравнения значимо не улучшились со времени визита 2, более того, выявлена отрицательная динамика по основным показателям на визите 4 по сравнению с визитом 3. В основной группе мы наблюдали положительную динамику, а результаты, полученные на визитах 3 и 4, также статистически значимо (p<0,05) отличались от показателей в группе сравнения.
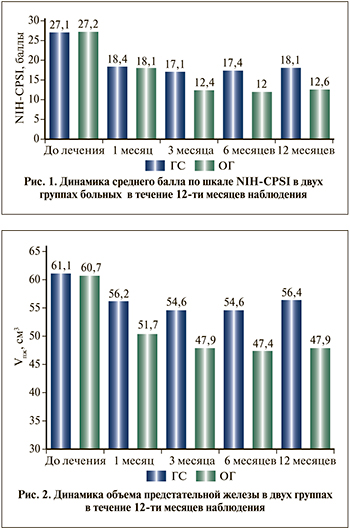
Результаты проведенного нами исследования согласуются с данными, представленными в литературе [24–26].
В другом исследовании проф. В. Л. Медведев и проф. М. Е. Ефремов в 2020 г. [25] продемонстрировали эффективность применения препарата Аденопросин® в комплексном лечении пациентов с хроническим бактериальным простатитом. В исследование были включены 60 пациентов, распределенных на 2 группы: 1-я – 30 пациентов, в лечении которых на фоне антибактериальной терапии применялся Аденопросин®, 2-я группа – 30 пациентов, в лечении которых использовали только антибактериальный препарат. Курс лечения составил 30 дней, общее время наблюдения за пациентами – 3 мес. По результатам исследования авторами зафиксировано уменьшение болевого синдрома, снижение общего балла простатических симптомов по NIH-CРSI, улучшение эректильной функции, снижение маркеров воспаления в железе в группе пациентов, получавших Аденопросин®.
В исследовании проф. Х. С. Ибишева и соавт. [26] оценивалась эффективность применения препарата Аденопросин® в лечении пациентов с ХРБП c множественной устойчивостью уропатогенов, выделенных из секрета предстательной железы, к антибиотикам. Были включены 58 пациентов с ХРБП, у которых верифицированные в секрете предстательной железы (СПЖ) уропатогены обладали множественной лекарственной устойчивостью к рекомендуемым антибактериальным препаратам (АБП). Для оценки клинико-лабораторных показателей на всех этапах исследования (до лечения, через 1, 3, и 6 мес. после терапии) анализировались результаты анкетирования: NIH-CPSI, IPSS, лабораторных и дополнительных методов обследования. Все пациенты получали Аденопросин® в качестве монотерапии (ректально по 1 суппозиторию 1 раз в сутки), но в зависимости от длительности терапии были разделены на 2 группы: 1-я (n=41) – длительность терапии составила 30 дней, 2-я группа (n=17) – 90 дней. Согласно полученным результатам, проводимая терапия в обеих группах сопровождалась достоверным (p<0,05) снижением выраженности симптоматики во всех периодах наблюдения, согласно опросникам NIH-CPSI и IPSS, и улучшением лабораторных показателей микроскопического, бактериологического и иммунологического исследований СПЖ. При общей положительной динамике большинство показателей во 2-й группе значимо (p<0,05) отличались от таковых в 1-й.
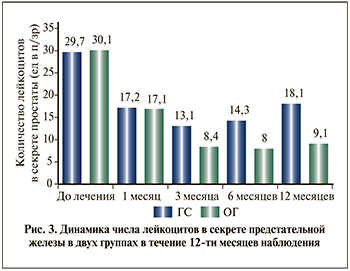
Несмотря на достаточно большое количество исследований, подтверждающих эффективность Аденопросина в лечении пациентов с ДГПЖ и ХП, в литературе, к сожалению, недостаточно широко представлены отдаленные результаты терапии данным препаратом. В ходе проведенного нами исследования все пациенты находились под наблюдением в течение 12 мес. Результаты, полученные в основной группе на визите 5, были статистически значимо лучше, чем в группе сравнения (p<0,05). Количество дневных и ночных мочеиспусканий были меньше на 25 и 38% соответственно, по шкале NIH-CPSI средний балл был меньше на 5,5, по шкале IPSS – на 4,5 балла, а качество жизни по данным шкалы QоL было лучше на 1,3 балла. Qmax в основной группе была выше на 25,2%, Vпж был меньше на 15,1%, Vом – был меньше 28,9%, а количество лейкоцитов – на 49,7% (рис. 3). При этом в группе сравнения отмечена отрицательная динамика по всем показателям по сравнению с визитом 4, которая, на наш взгляд, может быть связана с дальнейшим увеличением предстательной железы и сопутствующим усилением СНМП. Кроме того, необходимо отметить, что в основной группе зарегистрировано меньше на 85,7% наблюдений обострений ХП за период наблюдения.
Заключение. По результатам проведенного исследования применение препарата Аденопросин® позволило более эффективно купировать симптомы нижних мочевыводящих путей и признаки воспаления в предстательной железе в основной группе в течение 6 мес. после окончания терапии. Полученный эффект сохранялся в течение следующих 6 мес. наблюдения до года, о чем свидетельствует динамика исследуемых показателей и частота рецидивов хронического простатита. Энтомологические препараты, в частности Аденопросин, с учетом их противовоспалительной, антиоксидантной активности и антипролиферативного эффекта в отношении клеток гиперплазии предстательной железы могут стать новым направлением в комплексной терапии пациентов с ДГПЖ и ХП.



