Введение. Острая задержка мочи (ОЗМ) является распространенным и частым осложнением доброкачественной гиперплазии предстательной железы. Согласно популяционным исследованиям, частота возникновения ОЗМ составляет от 5 до 25 на 1000 человеко-лет, или от 0,5 до 2,5% в год [1–5]. Острая задержка мочи служит одной из самых частых причин экстренной госпитализации пациентов в урологические стационары.
В настоящее время «золотым» стандартом при ОЗМ считают тактику TWOC (англ.: Trial without catheter) – катетеризацию мочевого пузыря уретральным катетером с последующей попыткой восстановления самостоятельного мочеиспускания после удаления катетера. В случае невосстановления самостоятельного мочеиспускания большинству пациентов накладывают временный или постоянный цистостомический дренаж [6]. Подобная тактика в России подразумевает госпитализацию пациента и его пребывание в стационаре в течение 4–6 дней, что не только оказывает негативное влияние на качество жизни пациента, но и значительно повышает нагрузку на коечный фонд урологических стационаров. В связи с изложенным поиск и изучение эффективности и безопасности альтернативных методов купирования ОЗМ, позволяющих снижать число госпитализаций, сокращать время пребывания пациента в стационаре и повышать качество его жизни, таких как интермиттирующая катетеризация мочевого пузыря, остаются актуальной проблемой. Цель исследования: оценить эффективность и безопасность купирования ОЗМ посредством интермиттирующей катетеризации и выявить факторы, влияющие на вероятность восстановления самостоятельного мочеиспускания и развития нежелательных явлений.
В рамках цели сформулированы следующие задачи:
- оценить сравнительную эффективность метода интермиттирующей катетеризации (ИК);
- оценить безопасность ИК, проанализировав частоту развития нежелательных явлений (ирритативные симптомы нижних мочевыводящих путей, эпизоды гипертермии, макрогематурия, уретроррагия);
- выявить факторы, влияющие как на вероятность восстановления самостоятельного мочеиспускания, так и на развитие нежелательных явлений;
- оценить сроки восстановления самостоятельного мочеиспускания при ИК.
Материалы и методы. Проспективное мультицентровое сравнительное рандомизированное исследование проведено с августа 2021 по январь 2022 г. на базе урологических отделений пяти лечебно-профилактических учреждений: московских городских клинических больниц (ГКБ) им. С. И. Спасокукоцкого, им. Н. И. Пирогова, им. С. С. Юдина, им. В. В. Виноградова и им. В. М. Буянова.
В исследование включены пациенты, госпитализированные в урологические стационары с ОЗМ, обусловленной гиперплазией предстательной железы.
Критерии невключения:
- тяжелое состояние пациента и его неспособность к самообслуживанию;
- указания на оперативные вмешательства на уретре и/или предстательной железе в анамнезе;
- наличие установленного диагноза "стриктура уретры";
- указания на травмы уретры и промежности в анамнезе;
- указания на трансуретральные оперативные вмешательства в анамнезе;
- уретроррагия на момент госпитализации;
- повышение температуры тела более 37°С на момент госпитализации;
- попытки катетеризации мочевого пузыря в течение 15 сут. до эпизода ОЗМ;
- признаки острой инфекции мочевыводящих путей;
- нейрогенная дисфункция нижних мочевыводящих путей;
- признаки хронической задержки мочи или атонии мочевого пузыря (объем содержимого мочевого пузыря на момент обращения более 1 литра);
- признаки билатеральных ретенционных изменений верхних мочевыводящих путей на фоне ОЗМ;
- признаки гемотампонады мочевого пузыря.
Пациенты рандомно распределялись на две группы. В группе I применялась классическая тактика TWOC (дренирование мочевого пузыря катетером Фолея в течение 3 сут.), в группе II пациентам проводилась ИК в течение 3 сут.
Всем пациентам назначался α1-адреноблокатор (Тамсулозин). После удаления катетера фиксировали результаты попыток восстановления самостоятельного мочеиспускания. Во II группе фиксировали не только факт восстановления мочеиспускания на 3-и сутки, но и день восстановления самостоятельного мочеиспускания, если оно восстанавливалось раньше.
Положительным исходом считали не только восстановление самостоятельного мочеиспускания, но и наличие в мочевом пузыре не более 150 мл остаточной мочи (контрольное ультразвуковое исследование) через 12–24 ч после восстановленного мочеиспускания.
На 7-е сутки врачи-координаторы, принимавшие участие в исследовании, связывались с каждым пациентом и фиксировали наличие или отсутствие у них рецидива ОЗМ.
Рандомизацию пациентов проводили следующим образом: дежурные врачи-урологи ранее упомянутых стационаров были также поделены на две группы: сотрудники первой группы предлагали пациентам в качестве лечения классическую тактику TWOC (формирование группы I). Вторая группа сотрудников формировала группу II, предлагая пациентам метод ИК (группа II). В дальнейшем врачи, вовлеченные в исследование, заполняли на каждого пациента специально разработанную анкету, состоявшую из 22 вопросов.
В ней фиксировали все нежелательные явления:
- технические сложности и возникновение уретроррагии при первичной катетеризации;
- гематурия;
- ирритативные симптомы за период от момента первичной катетеризации до попытки восстановления самостоятельного опорожнения мочевого пузыря — более 2 ургентных позывов к мочеиспусканию в сутки;
- гипертермия, минимум два эпизода повышения температуры тела более 37,5°С;
- выраженные болевые ощущения в промежности, паховой и надлобковой областях, потребовавшие применения обезболивающих препаратов.
Из-за технической невозможности выполнить катетеризацию мочевого пузыря (после фиксации числа неудачных попыток) пациентам накладывали цистостому и их в исследование не включали.
Первичную обработку данных выполняли с использованием пакета OpenOffice®, а статистический анализ – с помощью программы R® x64, версия 4.1.3. Вычисляли как средние значения (M±m), так и минимальные, максимальные, медиану, первый и третий квартили (min.; Q1; Me; Q3; max.). Проводили тесты Шапиро–Уилка, Фишера, вычисляли t-критерий Стьюдента. Для анализа вероятностей наступления событий (уретроррагия, макрогематурия и др.), а также для оценки отношений шансов (odds ratio) использовали метод многофакторного логистического регрессирования с построением ROC (Receiver Operator Characteristic)-кривых и вычислением площадей под ними – AUC (Area Under Curve). Различия считали достоверными при р<0,05.
Все пациенты, согласно требованию Локального этического комитета, одобрившего данное исследование, подписали добровольное информированное согласие.
Результаты исследования. Сто тридцать семь пациентов соответствовали критериям включения и дали письменное согласие на включение в исследование. Технические сложности при первичной катетеризации (невозможность ее выполнения или необходимость применения эндоскопической ассистенции) имели место у 8 (5,8%) пациентов. После исключения указанных пациентов в исследование включены 129 пациентов:70 – в группу I и 59 – в группу II. Группы были сопоставимыми по возрасту, объему предстательной железы и наличию «средней доли» (табл. 1).
Средний возраст пациентов в общей когорте был равен 68,8±8,9 года, средний объем простаты – 80,3±40,3 см3. Выраженная средняя доля была выявлена у 59 (45,7%) пациентов (табл. 1).
На момент развития ОЗМ α1-адреноблокаторы принимали 53 (41%) пациента (в том числе 30–42,8% I группы, 23–39% – II); из всей когорты ингибиторы 5-α-редуктазы получали 5 (4%) мужчин (3–4,3% и 2–3,4% соответственно).
Ранее отмечали эпизоды ОЗМ 25 (19,4%) пациентов (в том числе 14–20% – в I группе, 11–18,6% – во II).
Нежелательные явления были зафиксированы в общей группе у 39 (30,2%) пациентов (29–41,4% – в I группе, и 10–16,9% – во II).
Уретроррагия при катетеризации зафиксирована у 7 (5,4%) пациентов (у 4 I группы, 5,7%, и у 3 II, 5%); макрогематурия – у 5 (3,9%) (у 3 I группы, 4,3%, у 2 II, 3,4%) соответственно.
Только у 1 (0,8%) пациента II группы имело место повышение температуры тела более 37,5°С.
Ирритативные симптомы: частые (2 и более в сутки) ургентные позывы к мочеиспусканию отмечали 23 (17,8%) пациента: 21 I группы, 30%, и 2 II, 3,4%); различия между группами статистически достоверны (р<0,001).
Выраженные болевые ощущения, потребовавшие медикаментозного обезболивания, беспокоили 3 (2,3%) пациентов: в 1 (1,4%) и 2 (3,4%) случаях соответственно.
По состоянию на 3-и сутки от первичной катетеризации самостоятельное мочеиспускание восстановилось у 25 (35,7%) пациентов I группы и у 26 (44%) – II (в общей группе в 51 [39,5%] наблюдении соответственно).
При этом среди пациентов с восстановившимся мочеиспусканием во II группе у 1 (3,8%) пациента самостоятельное мочеиспускание восстановилось в течение 1-х суток, у 12 (46,2%) – в течение 2-х, и у 13 (50%) – к окончанию 3-х суток. На 7-е сутки рецидив ОЗМ имел место у 3 (2,3%) пациентов (2 [2,8%] и 1 [1,7%] соответственно).
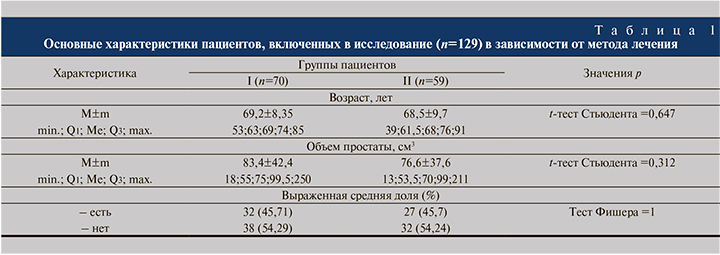
По результатам логистического регрессионного анализа выявлены статистически значимые связи между вероятностью развития макрогематурии и возрастом пациента (рис. 1), а также между возможной уретроррагией и эпизодами ОЗМ в анамнезе (рис. 2). Увеличение возраста пациента на 1 год повышает шанс возникновения макрогематурии в 1,15 раза (p=0,037 при 95% доверительном интервале [ДИ], равном 1–1,34), а при наличии в анамнезе эпизодов ОЗМ шанс развития уретроррагии возрастает в 8,7 раза (p=0,044; при 95% ДИ, равном 0,012–0,933).
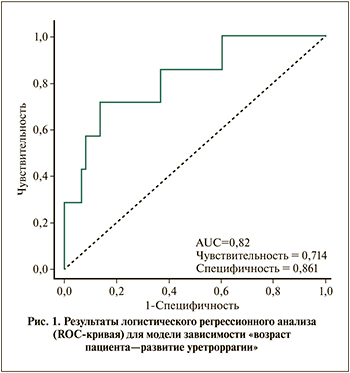

Результаты применения многофакторного логистического регрессирования для выявления факторов, статистически значимо влияющих на вероятность восстановления самостоятельного мочеиспускания при ИК, приведены в табл. 2. Как видно из табл. 2, увеличение возраста пациента на 1 год приводит к снижению шансов восстановления самостоятельного мочеиспускания в 1,07 раза, а прием α1-адреноблокаторов на момент развития ОЗМ увеличивает эти шансы в 2,8 раза.
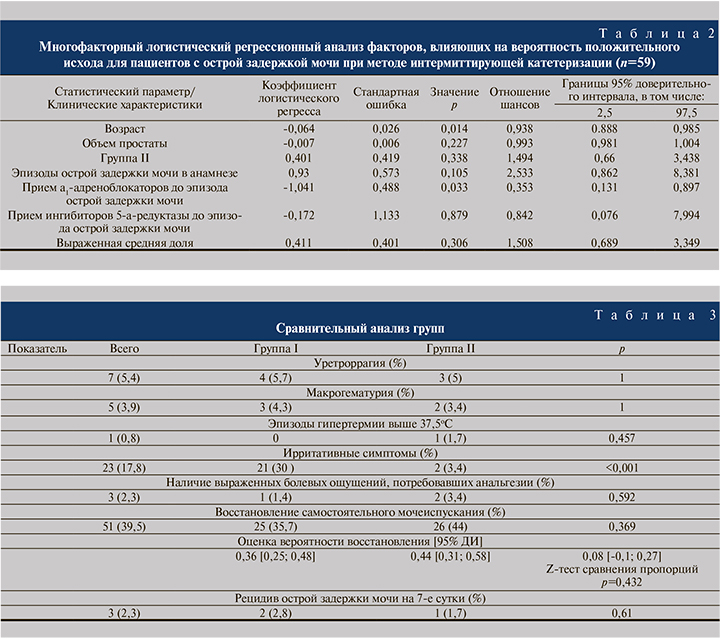
Как уже было упомянуто ранее, ирритативные симптомы – частые (более 2 в сутки) ургентные позывы к мочеиспусканию отмечали 21 (30%) пациент I группы и 2 (3,4%) – II; различия между группами статистически достоверны (р<0,001). Шансы возникновения ирритативных симптомов были в 12 раз выше у пациентов I группы (статистически значимо по тесту Фишера).
Статистически значимых различий между группами по другим параметрам выявлено не было (табл. 3).
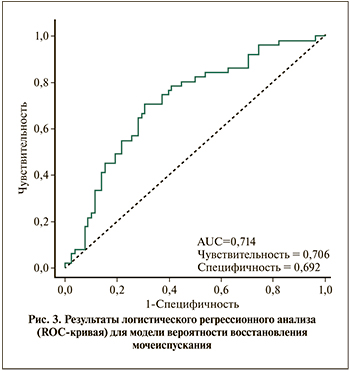
Для оценки вероятности восстановления самостоятельного мочеиспускания построена модель многофакторного логистического регресса. Точечная оценка вероятности восстановления мочеиспускания на 3-и сутки терапии во II группе выше, чем в группе I в 1,5 раза. Однако разница между этими оценками статистически не значима, следовательно, нельзя определить статистически значимое преимущество в клинической эффективности для какого-либо из этих методов. Тем не менее на основании результатов статистического анализа можно сделать вывод о неменьшей эффективности метода интермиттирующей катетеризации по сравнению с дренированием мочевого пузыря катетером Фолея.
Качество выбранных параметров модели анализировалось путем расчета AUC (площадь под кривой) для ROCкривой. На рис. 3 приведена ROC-кривая для модели вероятности восстановления мочеиспускания. AUC для такой ROC-кривой равна 0,714, что говорит о приемлемом качестве модели.
Обсуждение. Согласно литературным данным, при ОЗМ в настоящее время наиболее часто применяют классическую тактику TWOC. Сроки дренирования мочевого пузыря могут варьироваться, но большинство исследователей оптимальным сроком считают дренирование продолжительностью трое суток [7]. Эффективность пролонгированного (более 3 сут.) дренирования мочевого пузыря до настоящего времени остается предметом дискуссий [8–11]. По данным одного из крупнейших международных исследований, дренирование мочевого пузыря более 3 сут. приводит к значительному росту частоты осложнений (33,8 против 19,7%) [12]. В нашей работе восстановление самостоятельного мочеиспускания во всей когорте зафиксировано у 39,5% пациентов, что несколько ниже данных современной литературы, согласно которым применение тактики TWOC позволяет разрешить ОЗМ в 43–61% случаев [6, 8, 12, 13].
В нашем исследовании выявлены также два фактора, существенно влияющих на вероятность восстановления самостоятельного мочеиспускания: возраст и прием α1-адреноблокаторов на момент развития ОЗМ, что согласуется с данными литературы по исходам TWOC [8, 9, 12]. К другим факторам, влияющим на эффективность TWOC, относят и объем выведенной мочи, наличие эпизодов ОЗМ в анамнезе, объем предстательной железы и уровень простат-специфического антигена в крови [8, 9, 12, 13]. Дизайн нашей работы исследования не подразумевал определения последнего из упомянутых параметров, а объем выводимой мочи был изначально лимитирован критериями включения пациентов в исследование. Обнаружено также, что возраст пациента был ассоциирован с повышенным риском развития макрогематурии, а наличие в анамнезе эпизодов ОЗМ – с более высоким риском развития уретроррагии.
К сожалению, в современной литературе имеется крайне мало рандомизированных исследований, напрямую сравнивающих эффективность и безопасность исследуемых методик. По данным Ko и соавт. их эффективность сопоставима [14]. Результаты, полученные Patel et al., свидетельствуют о более высокой эффективности ИК: 56 против 25% [15]. Наряду с этим, по мнению некоторых авторов, применение ИК позволяет добиваться восстановления самостоятельного мочеиспускания в более короткие сроки [16, 17]. Результаты нашего исследования подтверждают этот тезис: так, восстановление самостоятельного мочеиспускания было в 1,5 раза выше в группе ИК (35,7 против 44,1%). Вместе с тем различия статистически не значимы, что не дает нам возможности с уверенностью утверждать о преимуществе ИК в клинической эффективности. Тем не менее результаты статистического анализа позволяют сделать вывод о неменьшей эффективности ИК по сравнению с TWOC.
К преимуществам ИК следует отнести тот факт, что в этой группе самостоятельное мочеиспускание на 2-е сутки лечения было восстановлено у 50% пациентов; кроме того, этот метод можно применять длительно – вплоть до момента хирургического лечения. Некоторые исследования свидетельствуют, что ИК вызывает менее выраженные изменения мочевыводящих путей и связан с более благоприятными результатами оперативного вмешательства [15, 18]. В связи с изложенным особо актуальным остается определение профиля безопасности этого метода (возникновение нежелательных эффектов). Этот вопрос также служит предметом дискуссий: по мнению Patel et al., ИК имеет более благоприятный профиль безопасности с точки зрения развития мочевой инфекции и воспалительных изменений в предстательной железе на фоне постоянного катетера [15]. В то же время результаты рандомизированного исследования, выполненного P. Jenjitranant et al., не выявили статистически значимой разницы в части развития мочевой инфекции, макрогематурии и болевых ощущений [15, 19]. Наше исследование не выявило статистически значимых различий в части частоты эпизодов гипертермии, макрогематурии и выраженных болевых ощущений, исключение составили ирритативные симптомы нижних мочевыводящих путей. Пациенты группы TWOC достоверно (р<0,001) чаще отмечали ирритативные симптомы (ургентные позывы к мочеиспусканию) – 21 (30%) против 2 (3,4%).
Таким образом, полученные нами результаты коррелируют с данными мировой литературы, имеющимися к настоящему моменту. Согласно полученным нами результатам, ИК обладает сопоставимой эффективностью с методом TWOC.
Заключение. ИК является эффективным методом лечения ОЗМ. Его главные преимущества заключаются в возможности амбулаторного ведения пациента, сохранении пациентом возможности жить сексуальной жизнью, более раннем восстановлении самостоятельного мочеиспускания и значительно менее выраженными катетер-ассоциированными симптомами нижних мочевыводящих путей.



