Введение. Андрогены играют критическую роль в поддержании метаболизма. У мужчин в возрасте 40–79 лет частота биохимического дефицита тестостерона и симптоматического гипогонадизма составляет 2,1–5,7% [1]. К наиболее распространенным жалобам пациентов с гипогонадизмом относятся снижение полового влечения, уменьшение количества эякуляций, слабость, раздражительность, проявления дисфории [2, 3]. Чаще дефицит тестостерона диагностируется у пациентов при их обращении к специалистам неурологического профиля. Важные факторы, которые необходимо учитывать при диагностике гипогонадизма, – это ожирение, сахарный диабет 2 типа, метаболический синдром, системные заболевания, способные влиять на концентрацию тестостерона в крови [4, 9]. Кроме того, необходимо учитывать факт приема лекарств, изменяющих концентрацию тестостерона, таких как статины, стероиды, опиоиды, антигонисты дофаминовых рецепторов и ингибиторы 5α-редуктазы [5, 7]. Избыточное потребление алкоголя, каннабиноидов и других наркотических веществ также снижает концентрацию тестостерона в крови [6, 8]. Приоритетной задачей при лечении гипогонадизма служит восполнение дефицита тестостерона в крови за счет использования экзогенного аналога. Планирование работы опиралось на то, чтобы подчеркнуть необходимость продемонстрировать связь между гипогонадизмом и доброкачественной гиперплазией предстательной железы (ДГПЖ), чтобы констатировать влияние дефицита тестостерона на течение и проявления аденомы предстательной железы.
В данной статье представлены результаты исследования, сравнивающего эффективность монотерапии доброкачественной терапии предстательной железы (ДГПЖ) α1-адреноблокаторами и комбинированной терапией ДГПЖ (α1-адреноблокаторы в сочетании с заместительной терапией тестостероном).
Цель исследования: сравнить эффективность монотерапии α1-адреноблокаторами и комбинированной терапии α1-адреноблокаторами в сочетании с Андрогелем для пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ) в сочетании с гипогонадизмом.
Материалы и методы. Набор пациентов для исследования осуществляли последовательно с марта 2013 по сентябрь 2017 г. в процессе амбулаторного приема в отделении урологии ГБУЗ «Городская поликлиника № 134» ДЗМ. Согласно разработанному дизайну исследования, определены критерии включения и исключения.
Критерии включения:
- возраст от 49 до 70 лет;
- уровень общего тестостерона <12,1 нмоль/л;
- объем предстательной железы >40 см3;
- показатель максимальной скорости потока мочи (Qmax) по данным урофлоуметрии менее 15 мл/с.
Критерии исключения:
- уровень общего ПСА более 4 нг/мл;
- иные противопоказания к назначению препаратов тестостерона;
- отсутствие опыта системного применения препаратов тестостерона, 5-АРИ, α1-адреноблокаторов на протяжении последних 12 мес.
Из 521 пациента, первично обратившегося в отделение урологии в течение указанного периода, 184 соответствовали критериям включения. Шестьдесят пациентов согласились на участие в исследовании и подписали форму информированного согласия.
Все пациенты, вошедшие в исследование, имели андрогенный дефицит в сочетании с ДГПЖ и были поделены случайным образом на 2 группы по 30 человек в каждой.
В первую группу вошли пациенты, получавшие в монорежиме препарат группы селективных α1-адреноблокаторов (силодозин 8 мг/сут). Пациенты второй группы получали комбинированное лечение, включившее силодозин 8 мг/сут и трансдермальную гелевую форму тестостерона (Андрогель 1 % по 5 г/сут). Продолжительность терапии составила 6 мес.
Обследование пациентов проводили до начала терапии и во время визитов к врачу каждые 2 мес. в полном объеме в течение полугода (в целом 4 визита). Комплексное обследование включило сбор жалоб пациентов, анамнеза, физикальное обследование с измерением массы тела, окружности талии, определением индекса массы тела (ИМТ), заполнение анкет IPSS и МИЭФ, измерение уровня общего тестостерона, общего ПСА, ТРУЗИ предстательной железы с определением объема остаточной мочи, урофлоуметрию. На каждом визите все пациенты получали устные и письменные рекомендации по изменению пищевого поведения и усилению физической активности.
Общая характеристика пациентов представлена в таблице.

Статистический анализ выполнен на основе данных, зафиксированных в регистрационных картах пациентов, и обработан на персональном компьютере с применением пакета стандартных прикладных программ Microsoft Office Excel 2007, Statistica Biostatv. 6.3., а также с помощью программного пакета SPSS.
Результаты и обсуждение. Исследование закончили все пациенты. В результате комбинированной терапии к окончанию исследования пациентов с гипогонадизмом в сочетании с ДГПЖ по опроснику IPSS/Qol выявлено количественное снижение (в баллах) выраженности симптомов нижних мочевыводящих путей (СНМП) с 25/4,2 до 8,9/2,6 соответственно. По опроснику МИЭФ-5 зарегистрировано повышение балльной оценки сексуальной функции (с 6,3 до 26,8). Кроме того, выявлено изменение следующих показателей: снижение ПСАобщ (с 2,25 до 1,8 нг/мл), повышение уровня общего тестостерона (с 7,8 до 18,2 нмоль/л), уменьшение холестерина (с 5,0 до 4,5 моль/л), снижение глюкозы (с 4,9 до 4,5 ммоль/л), увеличение объема предстательной железы (с 55,1 до 61,3 см3), значительное снижение объема остаточной мочи (с 72 до 19 мл), повышение Qmax (с 13,34 до 21,1 мл/с), уменьшение ОТ (с 116 до 103,2 см), снижение ИМТ (с 35,4 до 27,2 кг/м2). Анализ ряда показателей (глюкоза, холестерин) нами не вынесен в результаты исследования по причине низкой практической значимости в части патологии предстательной железы. В группе монотерапии по ряду показателей также наметилось некоторое улучшение (УФМ, ИМТ). Оно не носило выраженного отличия и было закономерным в связи с применением α1-адреноблокаторов и соблюдением основ здорового образа жизни.
Следует отдельно остановиться на изменениях показателя ПСАобщ. Установлено, что к концу 3-го месяца наблюдения уровень ПСАобщ в группе пациентов, получавших лечение с включением препаратов тестостерона, снизился, тогда как в группе монотерапии значительных изменений данного параметра не наблюдалось. В целом содержание ПСАобщ в группе комбинированной терапии снизилось на 20% (рис. 1). Статистически значимые различия между группами были зафиксированы только на 3-м и 4-м визитах после начала лечения.
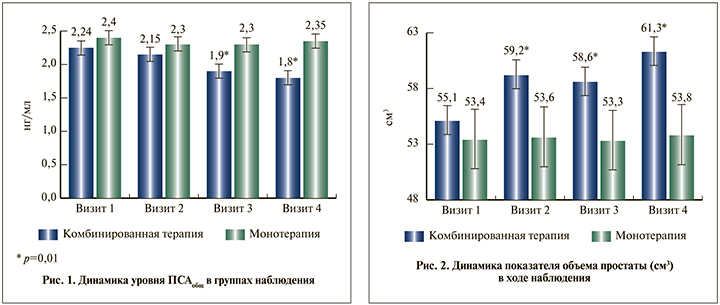
Что касается объема предстательной железы, то результаты лечения пациентов с гипогонадизмом и ДГПЖ в обеих группах оказались вполне ожидаемыми. В группе, где пациенты получали только α1-адреноблокатор, значимых изменений не произошло. В группе комбинированной терапии, напротив, зафиксировано увеличение данного показателя в среднем на 6,2 см3 (на 11,3 %) (рис. 2).
Итоговые результаты урофлоуметрического исследования свидетельствовали о повышении скорости мочеиспускания у пациентов обеих групп (рис. 3). К 4-му визиту в группе комбинированной терапии показатель в среднем составил 22 мл/с, в то время как у пациентов, получавших только α1-адреноблокатор, 18 мл/с.
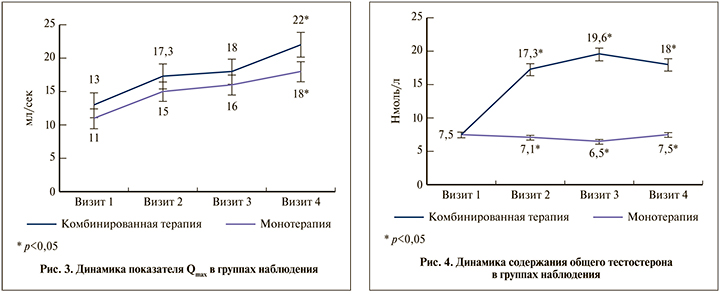
Анализ содержания общего тестостерона выявил следующее. Как и предполагалось на начальном этапе исследования в группе комбинированной терапии имело место увеличение или нормализация уровня общего тестостерона, который оказался в 2,2 раза выше, чем в группе монотерапии, где значимых изменений зарегистрировано не было (рис. 4).
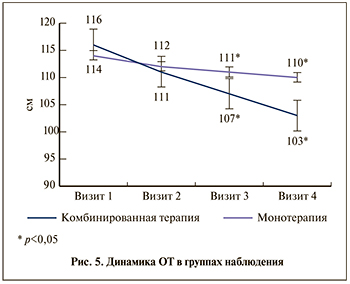 Сравнительный анализ изменения ОТ позволил заключить, что в группе комбинированной терапии к концу наблюдения лечение в отношении данного параметра оказалось на 8 % эффективнее, чем в группе монотерапии (рис. 5). Положительную динамику в обеих группах, вероятно, можно объяснить тем, что пациентам обеих групп давали единые рекомендации по ведению здорового образа жизни (рациональное питание, дозированные физические нагрузки, отказ от вредных привычек и пр.).
Сравнительный анализ изменения ОТ позволил заключить, что в группе комбинированной терапии к концу наблюдения лечение в отношении данного параметра оказалось на 8 % эффективнее, чем в группе монотерапии (рис. 5). Положительную динамику в обеих группах, вероятно, можно объяснить тем, что пациентам обеих групп давали единые рекомендации по ведению здорового образа жизни (рациональное питание, дозированные физические нагрузки, отказ от вредных привычек и пр.).
Результаты нашего исследования сопоставимы с известными зарубежными работами и могут быть использованы в повседневной практике [7, 8, 10]. Несмотря на массу исследований, посвященных изучению проблемы влияния гипогонадизма и метаболического синдрома на качество мочеиспускания, до сих пор непонятна патофизиологическая составляющая данных ассоциаций. Принято считать, что дефицит тестостерона – это одно из проявлений метаболического синдрома, которое при этом является одним из самых ранних проявлений этого заболевания. Связь гипогонадизма с СНМП доказана в многочисленных исследованиях [7, 8]. Влияние тестостерона на предстательную железу также служит предметом дискуссий. Считается, что тестостерон – промоутер роста железы, но с учетом результатов массы исследований, в которых не была доказана достоверная связь интенсивности роста предстательной железы и концентрации тестостерона, вопрос остается открытым. Связь между уровнем тестостерона, метаболическим синдромом и выраженностью СНМП по-прежнему не понятна. С уверенностью можно говорить только о безопасности и эффективности назначения заместительной терапии тестостероном пациентам с ДГПЖ и гипогонадизмом.
Заключение. Поскольку органы урогенитальной сферы у мужчин напрямую андрогенозависимы, влияние дефицита тестостерона на их функционирование очевидно и неоспоримо. И это несет под собой патогенетическую основу. На сегодняшний день ДГПЖ следует рассматривать не как обособленную урологическую проблему, а как системную патологию, возникновение которой обусловлено общими гормонально-метаболическими сдвигами, возникающими после определенного возраста. Урология современности должна нести в основе своей привентивный (холистический, системный, интегративный) подход в части диагностики, профилактики и лечения профильных заболеваний. Делать это нужно, чтобы не только устранять неприятные симптомы, но и действовать предупреждающе в части возникновения и развития тех или иных заболеваний. По нашему мнению, ранняя диагностика и своевременная коррекция возрастного дефицита тестостерона сработает предупреждающе в отношении развития ДГПЖ, в частности. Данная работа показывает, что тестостеронзаместительная терапия пациентов с ДГПЖ безопасно и закономерно способствует улучшению качества жизни. А именно, симптоматическая терапия ДГПЖ селективным препаратом группы α1-адреноблокаторов на фоне коррекции дефицита тестостерона приводит к уменьшению баллов по шкале IPSS на 24,5%, увеличению объема простаты – на 11,3%, снижению уровня общего простатоспецифического антигена в среднем на 22,5 %, повышению общего балла по шкале МИЭФ-5 в среднем на 4,85 балла и повышению Qol в среднем на 0,87 балла, уменьшению окружности талии на 8% по сравнению с контролем.



