Введение. Хронический простатит (ХП, или синдром хронической тазовой боли, СХТБ) определяется как хроническая боль или дискомфорт в области таза в течение минимум 3 из последних 6 мес., часто сопровождающиеся симптомами нижних мочевыводящих путей, психосоциальными нарушениями и сексуальной дисфункцией [1]. Четкого и однозначного понимания эпидемиологии, этиологии и патогенеза простатита у медицинской общественности до сих пор нет. Согласно Международной классификации болезней (МКБ) 10-го пересмотра (mkb-10.com), воспалительные болезни предстательной железы (N41) кодируются следующим образом: N41.0 – Острый простатит, N41.1 – Хронический простатит, N41.2 – Абсцесс предстательной железы, N41.3 – Простатоцистит, N41.8 –
Другие воспалительные болезни предстательной железы, N41.9 – Воспалительная болезнь предстательной железы неуточненная. При необходимости идентифицировать инфекционный агент используют дополнительный код (B95-B98). Если по первой и третьей категориям принципиальных возражений нет, остальные вызывают много вопросов. Классификация МКБ-10 никак не согласуется с классификацией простатита, предложенной The National Institutes of Health [2], а именно на этой классификации основываются все научные статьи и национальные, европейские, азиатские и прочие рекомендации с начала этого тысячелетия.
Заболеваемость и болезненность ХП официальной статистикой не учитываются. Есть ряд работ, посвященных распространенности этого заболевания. Так, в пяти исследованиях, охвативших 10 617 мужчин, обратившихся за амбулаторной помощью, 873 (8,2%) предъявляли жалобы, характерные для ХП [3–7]. В целом симптомы простатита встречались с частотой от 2,2% [4] до 9,7% [6]. Ранее мы установили, что доля ХП в структуре амбулаторных инфекционно-воспалительных заболеваний органов мочеполовой системы колеблется от 5,6% в муниципальной поликлинике до 41,2% в частном медицинском центре [8]. М. И. Коган и соавт. [9] также подчеркивают, что истинные заболеваемость и распространенность бактериального простатита в различных регионах мира не определены.
Не лучше обстоит дело и с диагностикой этого заболевания, особенно с так называемой абактериальной его формой. Один из основоположников мировой простатологии, Meares, в конце прошлого века был уверен, что в структуре простатита преобладает его абактериальная форма (до 90%), однако уже тогда предостерегал от чрезмерного увлечения антибиотиками, подчеркивая, что лечение таких больных с использованием противомикробных препаратов неэффективно и неоправданно [10–11]. Природа абактериального простатита (простатодинии, синдрома хронической тазовой боли) уже долгое время занимает умы исследователей, тем не менее проблема все еще не решена [12].
В диагностический алгоритм ХП настойчиво внедряли 4-стаканную пробу [13–14], хотя дальнейшие исследования показали ее избыточность [15–17], и широко известный профессор Nickel подчеркивал, что достоверность и специфичность 4-стаканной пробы никем не доказаны, хотя этот тест до сих пор считается «золотым» стандартом [18].
С учетом постоянного развития медицинских технологий подвергаются пересмотру алгоритмы обследования пациентов и целесообразность использования новейших лабораторных методик, необходимых для успешной верификации диагноза [9]. Воспалительные изменения в лабораторных анализах при ХП не отражают в полной мере состояния простаты и не дают полной информации о сущности воспалительного процесса в ткани железы [19]. Патоморфологическая картина воспаления простаты не коррелирует с клиническими и микробиологическими данными [20].
Неоптимальный подход к диагностике ХП закономерно выливается в неудовлетворительные результаты лечения.
В Кокрановском системном обзоре, посвященном изучению клинических данных по эффективности медикаментозной терапии больных хроническим простатитом/синдромом хронической тазовой боли (ХП/СХТБ) авторы делают вывод об удручающе низком качестве исследований по этой проблеме и заключают, что некоторые методы лечения могут приносить в лучшем случае лишь небольшую и, возможно, клинически незначительную пользу для пациентов [21]. Больные ХП/СХТБ представляют собой клинически неоднородную группу с различными механизмами заболевания, спектром клинических симптомов и параметрами физикального обследования. Определение различных клинических фенотипов по принципу системы UPOINT, включающей шесть доменов: Urinary, Psychosocial, Organ-Specific, Infection, Neurologic/Systemic and Tenderness (мочевой, психосоциальный, органоспецифический, инфекционный, неврологический/системный и болезненность) позволяет индивидуализировать подход к терапии на основе мультимодальности [22]. Ряд исследователей полагают необходимым дополнить эту систему пунктом «S» – сексуальный, считая сексуальную дисфункцию важным симптомом простатита [1].
Комплексный подход позволяет добиваться успеха в лечении более чем 80% пациентов [22–24], однако рецидивы после пероральной антимикробной терапии являются обычным явлением [25] – отчасти из-за роста устойчивости к противомикробным препаратам [26–28] и неспособности достигать элиминации патогенов из простаты в силу образования биопленок [29].
В недавней литературе описаны различные варианты лечения хронического бактериального простатита, резистентного к обычным противомикробным препаратам, включая использование альтернативных препаратов, таких как фосфомицин, прямые инъекции противомикробных препаратов в простату, хирургическое удаление инфицированной ткани предстательной железы, терапия с использованием бактериофагов для борьбы с устойчивыми к антибиотикам бактериями. Лечение хронического бактериального простатита, особенно рецидива после перорального лечения антимикробными препаратами, остается сложной задачей [23]. Классификация UPOINTS определяет индивидуальный клинический профиль пациента, дает рекомендации по необходимым диагностическим шагам и служит основой адаптированной мультимодальной, симптомно-ориентированной и персонализированной концепции лечения [1].
Изменения микробиома мочевыводящих путей могут нарушать микроэкологический баланс мочевыделительной системы, что приводит к развитию ХП – даже в отсутствие общепризнанных уропатогенов. Истинными возбудителями простатита могут оказаться непрокариотические или эукариотические микроорганизмы [30]. С появлением новых технологий высокопроизводительного секвенирования мы получили более глубокое понимание сложных и разнообразных взаимодействий микробиома в организме человека. Концепция стерильности мочи давно отвергнута. Дисбаланс микробиома, по-видимому, оказывает существенное влияние на патогенез как злокачественных, так и доброкачественных состояний [31].
Цель исследования: сопоставить частоту основных симптомов (боль, дизурия, сексуальная дисфункция) у больных хроническим бактериальным и абактериальным простатитом, а также туберкулезом предстательной железы; определить частоту латентного инфекционного простатита в структуре абактериального простатита.
Материал и методы. В исследование включили 73 мужчин в возрасте от 32 до 56 лет (в среднем 41,2±6,7), которые в течение минимум 2 лет наблюдались у врача по поводу ХП и имели в анамнезе не менее трех обострений в год. Основными критериями включения были суммарное количество баллов по шкале симптомов ХП National Institute of Health Chronic Prostatitis Symptom Index (NIH-CPSI) 15 и более, число лейкоцитов в нативном мазке секрета предстательной железы 15 и выше в поле зрения.
Критерии исключения: любые сопутствовавшие инфекционно-воспалительные заболевания любой локализации в стадии активного воспаления, декомпенсация сопутствовавших соматических заболеваний, злокачественные опухоли любой локализации, клинически значимая доброкачественная гиперплазия предстательной железы, нейрогенный (незаторможенный) мочевой пузырь, наличие инородных тел в мочевом пузыре.
Все пациенты проходили стандартное обследование. На первом визите – опрос с обязательным уточнением наличия туберкулеза в прошлом или контакта с туберкулезной инфекцией, осмотр, включая пальцевое ректальное исследование, световая микроскопия секрета предстательной железы, заполнение шкалы симптомов ХП NIH-CPSI. Пациенты, перенесшие и излеченные от туберкулеза любой локализации, имевшие тесный контакт с больными туберкулезом, отмечавшие гемоспермию, находившиеся в бесплодном браке, имевшие неудовлетворительные результаты от проводимой ранее стандартной терапии по поводу ХП, углубленно обследовались на туберкулез предстательной железы. Им дополнительно выполняли рентгенографию органов дыхания, уретрографию, иммунологические тесты и провокационную пробу с 50 ТЕ туберкулина.
Микроскопическое исследование проводили при помощи микроскопа CarlZeiss (Германия) при увеличении 7х40, при этом оценивали следующие параметры: количество лецитиновых зерен (липоидных телец), лейкоцитов, эритроцитов и клеток эпителия. Воспаление предстательной железы регистрировали при обнаружении в нативном мазке секрета простаты 15 и более лейкоцитов в поле зрения.
Проводили микробиологическое исследование секрета простаты. Микробиологические исследования выполняли посредством времяпролетной масс-спектрометрии на масс-спектометре Microflex (Германия Bruker). Для части культур видовая идентификация и определение антибиотикорезистентности проводились на комбинированных панелях BD PhoenixTM для грамотрицательных, грамположительных микроорганизмов и стрептококков с применением автоматической системы идентификации микроорганизмов и определения антибиотикочувствительности Phoenix 100 США Becton Dickinson. Для стандартизированного диско-диффузионного метода использовали диски, импрегнированные антибиотиками, агар Мюллера–Хинтона и диспенсеры для нанесения дисков Bio-Rad США.
Внутренний контроль качества определения чувствительности к антибиотикам осуществляли с использованием контрольных штаммов (ATCC – American Type Culture Collection), рекомендованных МУК 4.2.1890-04 МЗ РФ, серия LyfoCults Plus, Франция bioMérieux. Внешний контроль качества осуществлен путем регулярного участия в соответствующих циклах Федеральной внешней оценки качества.
Также для идентификации патогенных микроорганизмов и количественной оценки видового состава микробиоты в образцах биоматериала (секрет простаты) использованы молекулярно-генетические методы: ПЦР в реальном времени (ПЦР-РВ) с помощью набора реагентов «Андрофлор» (регистрационное удостоверение на медицинское изделие NРЗН 2016/4490 от 25.07.2016, производитель – ООО «ДНК-Технология ТС», Россия). При проведении ПЦР-РВ использовали детектирующий амплификатор ДТ-96 (ООО «НПО ДНК-Технология», Россия). Количественные результаты исследования представлены в числе геномномного эквивалента в 1 мл (ГЭ/мл), значения которых пропорциональны микробной обсемененности урогенитального биотопа. Идентификацию вирусов простого герпеса типов 1, 2 и вируса папилломы человека (ВПЧ) проводили методом полимеразной цепной реакции (ПЦР) в формате R-time с реагентами фирмы «ДНК-технология».
Культуральные исследования на M. tuberculosis выполняли на комплексе плотных питательных сред с разным солевым составом (среда Левенштейна–Йенсана, производитель Becton Dickinson, США и среда Финн-II), также проводили посев в жидкие питательные среды MGIT с применением микробиологических анализаторов Bactec MGIT.
Молекулярно-генетические методики для вывления M. tuberculosis выполняли по «картриджным» технологиям GeneXpert MTB/RIF (производитель: Cepheid, США).
Через 2 дня пациенты приходили на второй визит. Тем, у кого были идентифицированы патогены, назначали комплексную этиопатогенетическую терапию. Тем, у кого результат микробиологического исследования был отрицательным, назначали препарат лонгидаза в ректальных суппозиториях по одному введению в прямую кишку через день, с повторным визитом через 3 дня и повторным получением секрета простаты для микробиологического исследования, по результатам которого уже назначали терапию.
Статистическая обработка результатов проведена на персональном компьютере с помощью пакетов статистических программ Мicrosoft Eхсе1 2007 и Statistiсa for Windows 6.0.
Результаты. По результатам первичного обследования 27 (37,0%) пациентам диагностирован хронический бактериальный простатит (ХБП). Среди выявленных патогенов преобладала кишечная палочка – 10 (37,0%) случаев. У 9 (33,3%) пациентов одновременно было выявлено несколько патогенов. У 8 (29,6%) выявлены вирусы: вирус простого герпеса – у 3 (11,1%) и вирус папилломы человека (ВПЧ) – у 5 (18,5%). Лекарственно устойчивыми оказались 36,7% штаммов микроорганизмов.
У 46 (63%) пациентов микрофлора на первом визите выявлена не была, т.е. они соответствовали критериям хронического абактериального простатита (ХАП) – пропорция, не вступающая в противоречие с классическими представлениями.
Углубленное обследование позволило среди 27 больных ХБП диагностировать туберкулез предстательной железы (ТПЖ). Таким образом, в общей когорте пациентов только у 17 (23,3%) был изолированный ХБП и еще у 10 (13,7%) – ХБП в сочетании с ТПЖ.
Все пациенты с ХАП получали ректальные суппозитории препарата лонгидаза с диагностической целью; основная гипотеза – пролонгированный протеолитический фермент расщепляет гнойно-некротический детрит, образующийся в результате хронического воспаления и обтурирующий выводные протоки железок простаты, тем самым облегчая отток секрета из очага воспаления, была нами подробно аргументирована в предыдущем исследовании [29].
В секрете простаты, полученном на втором визите, только у 23 (31,5% от всей когорты) пациентов по-прежнему не был идентифицирован какой-либо патоген; у двоих был диагностирован также ТПЖ. Таким образом, изолированный ХАП подтвердили только у 21 (28,8% от всей когорты) пациента. Вместе с тем диагностическое введение препарата лонгидаза привело 23 (50,0% от больных ХАП) пациентов к появлению в секрете простаты патогенной микрофлоры: E. coli – у 9 (39,1%), Enterobacter spp. – у 6 (26,1%), у 2 (8,7%) – Proteus spp., еще у 2 (8,7%) – Klebsiella spp., у 4 (17,4%) была обнаружена ассоциация микробной флоры с вирусами. Резистентность к антибактериальным препаратам в этой группе была зафиксирована в 56,9% случаев. У пяти пациентов этой группы был также диагностирован ТПЖ, 18 (24,6%) имели не выявленный стандартными методами инфекционный простатит.
Следовательно, каждый второй больной в группе ХАП фактически имел не диагностированный при стандартном подходе ХБП. Поскольку среди обнаруженных возбудителей присутствовали не только бактерии, но и вирусы, правильно будет определить диагноз этой группы больных как латентный хронический инфекционный простатит (лХИП). Среди 46 больных ХАП у 7 (15,2%) также был диагностирован ТПЖ, причем у пяти из них ТПЖ сопровождался лХИП. Всего специфическое воспаление простаты найдено у 17 (23,3%) пациентов.
Наглядно спектр ХБП и ХАП представлен на рис. 1 и 2.
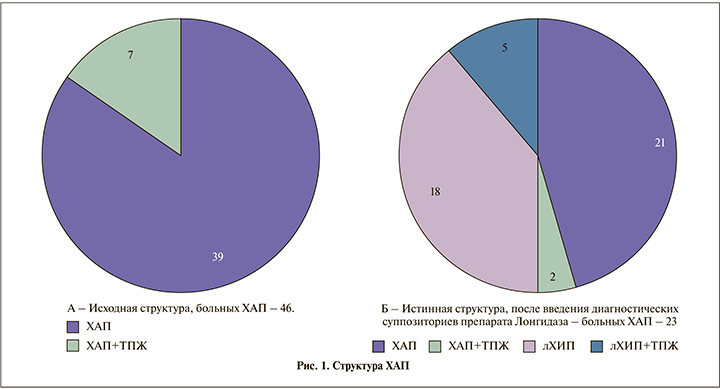
Таким образом, детальный анализ показал, что деление больных на ХБП и ХАП весьма условно, эти две большие группы включают несколько подгрупп, пренебрегать которыми нельзя. В целом когорта больных ХП распределилась следующим образом (рис. 3).
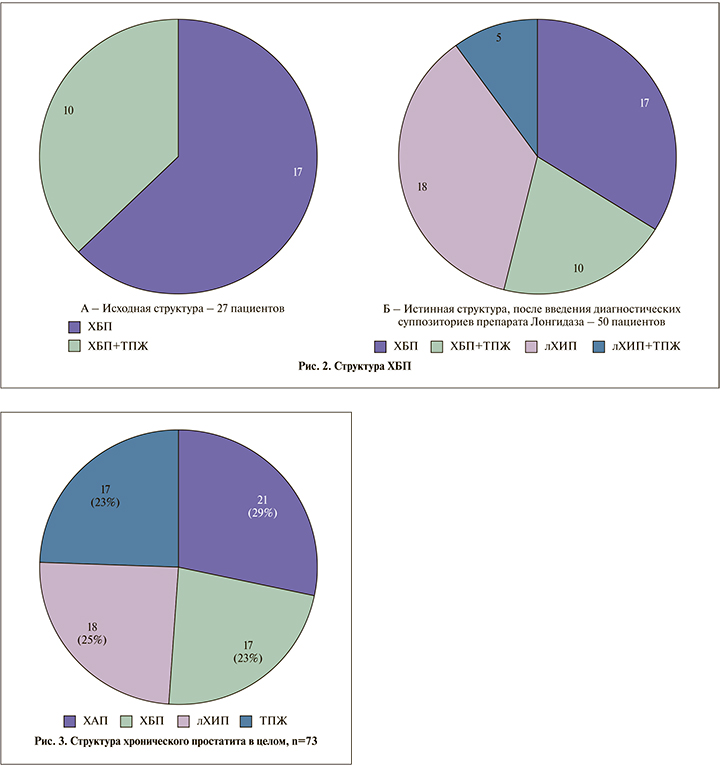
Как видно на рис. 3, только 29% пациентов не удалось верифицировать инфекционную этиологию заболевания, у 23% больных уже при первичном обращении был диагностирован ХБП, у 25% – после провокации ректальным введением суппозиториев препарата лонгидаза, при стандартном обследовании патогены у них обнаружены не были.
У 23% пациентов под маской ХП протекал ТПЖ.
Одной из целей нашего исследования было обнаружить симптомы, характерные для того или иного вида простатита, что позволило бы ускорить постановку верного диагноза. Сравнительная характеристика клинических проявлений представлена в таблице.
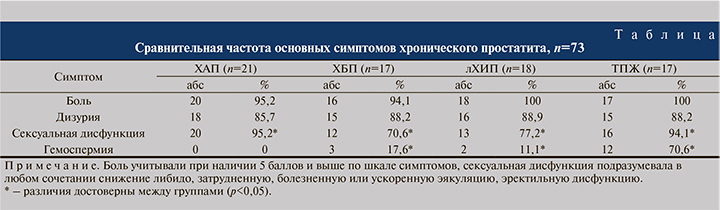
Как следует из таблицы, в частоте боли и нарушений мочеиспускания статистически значимых различий не выявлено. Однако сексуальная дисфункция чаще развивалась у больных ХАП и ТПЖ (р<0,05); гемоспермия же была не характерной для пациентов с ХАП, встречалась в единичных случаях при ХБП и лХИП, но присутствовала у двух третей пациентов с ТПЖ.
Обсуждение. В настоящее время отсутствуют биомаркеры или процедуры клинических исследований для окончательного диагноза [1]. Диагностика пациентов с подозрением на простатит должна проводиться в соответствии с алгоритмом, рекомендованным Российским обществом урологов, Европейской урологической ассоциацией и Стандартом первичной медико-санитарной помощи при ХП (Приложение к приказу Минздрава России № 775н от 09.11.2012) [32]. К сожалению, в повседневной практике эти алгоритмы обычно не соблюдаются [33–34]. Детальное изучение анамнеза жизни и заболевания, эпидемического анамнеза в массе случаев позволило бы заподозрить верный диагноз уже на этапе опроса пациента. Но у врача не всегда есть достаточно времени (а иногда и желания или соответствующей настороженности) плюс мы находимся под магическим влиянием ранее установленного диагноза. К чему рассматривать пациента как первичного и проводить все диагностические процедуры, если он уже год-два–десять наблюдается по поводу простатита/цистита/мочекаменной болезни? Но в такой ситуации и врач, и пациент становятся заложниками возможной ошибки, допущенной при первом обращении больного за медицинской помощью. И может быть, именно в этом причина частых рецидивов, неудовлетворительных результатов терапии, в конечном итоге – запущенных случаев туберкулеза и рака?
Инфекционный фактор – этиологический предиктор возникновения воспаления в простате [35]. Но если использовать только рутинные методы микробиологических исследований, этот фактор может быть и не установлен – и пациент будет получать лечение как больной абактериальным простатитом. Вместе с тем использование расширенного набора селективных сред и специальных условий культивирования позволило суммарно верифицировать в секрете простаты до 28 видов/родов микроорганизмов у больных ХП, причем многие из них находились в состоянии ассоциации [35].
В Руководстве Европейской ассоциации урологов (EAU Guidelines) за 2020 г. бактериальный и абактериальный простатиты описаны в разных главах: бактериальный – в главе «Urological Infections» (урологические инфекции) [36], абактериальный простатит, интерпретируемый как синдром хронической тазовой боли, или синдром болезненной простаты, – в главе Chronic Pelvic Pain (хроническая тазовая боль) [37].
Следует отметить, что почти все рекомендации имеют низкий уровень достоверности и слабую степень рекомендаций, что мы выше также отметили при анализе литературы. Алгоритм обследования больного простатитом включает заполнение анкеты симптомов (CPSI); однако ее полезность в клинической практике сомнительна [38].
Предлагается выполнять 4-стаканную пробу мочи [13], но сравнительное исследование с высоким уровнем достоверности (2b) показало, что 2-стаканный тест имеет аналогичную диагностическую чувствительность, но значительно проще в исполнении [16]. Ранее было аргументированно показано преимущество трехстаканной пробы мочи в скрининге и на первичном этапе диагностики простатита [15]. Трансректальное УЗИ может выявлять эндопростатические абсцессы, кальциноз предстательной железы и расширение семенных пузырьков; тем не менее он не надежен в качестве диагностического инструмента для простатита [39].
Частота обнаружения патогенной микрофлоры в эякуляте не превышает 50% у больных хроническим бактериальным (!) простатитом. Рекомендуют отправлять на посев среднюю порцию струи мочи и секрет простаты [13, 40].
Уровень простатоспецифического антигена (ПСА) может быть повышен во время обострения простатита и снижается после антибактериальной терапии (что наблюдается примерно у 40% пациентов), коррелируя с клиническим и микробиологическим улучшением [41]. Измерение свободного и общего ПСА не добавляет практической диагностической информации при простатите [42].
Из всего списка рекомендаций сильную степень имеет лишь отказ от массажа простаты при остром простатите, поскольку это может вызывать бактериемию и сепсис, а также выполнение 2- или 4-стаканной пробы. Радует, что Европейский гайдлайн рекомендует пиоспермию и гемоспермию мужчинам в эндемичных регионах или с туберкулезом в анамнезе обследовать на урогенитальный туберкулез.
В главе «Хроническая тазовая боль» [37] подчеркивают важность изучения анамнеза и данных физикального обследования. Специфического диагностического теста для СХТБ также не существует, поэтому процедуры, с одной стороны, направлены на выявление и исключение конкретных заболеваний, связанных с тазовой болью, с другой – могут использоваться для фенотипического описания.
В этой главе характеризуют 4-стаканную пробу как чрезмерно громоздкий тест [43] и рекомендуют ограничиться 2-стаканной пробой. Наше сравнительное исследование показало большую информативность 3-стаканной пробы [17]. У 8% пациентов с предполагаемым синдромом болезненной простаты были обнаружены положительные посевы простаты, что аналогично проценту здоровых мужчин [44]. Диагностический алгоритм основан на принципе UPOINT, описанном выше.
Заключение. Проблема ХП далека от своего разрешения. В немалой степени этому способствует отсутствие унифицированной международной классификации; классификация прошлого тысячелетия, предложенная NIH, устарела. Под маской абактериального простатита скрывается как латентный инфекционный простатит, так и туберкулез предстательной железы. Несмотря на то что по ряду параметров есть статистически значимые различия в клинических проявлениях ХБП, ХАП, лХИП и ТПЖ, патогномоничных симптомов для этих подгрупп хронического простатита не выявлено. Поскольку половина пациентов с ХАП в действительности имеет лХИП, необходимо применять в диагностических целях ректальные суппозитории препарата лонгидаза с повторным исследованием секрета простаты. Для идентификации патогенов следует применять наряду с рутинными методы молекулярно-генетической диагностики. ТПЖ может протекать под маской/сочетаться как с бактериальным, так и с абактериальным простатитом. Необходимо тщательно изучать историю пациента, его эпидемический анамнез и при наличии показаний проводить соответствующее обследование для исключения ТПЖ.



