Камни предстательной железы (КПЖ) – слабоизученный патофизиологический феномен, довольно широко распространенный среди мужчин разного возраста, служит результатом отложения солей кальция в местах значительного повышения его локальной концентрации [1]. И хотя первые упоминания об этом явлении относятся к XVI в., сегодняшний интерес исследователей и врачей к этому феномену обусловлен достижениями и возможностями трансректального УЗИ и компьютерной томографии [2].
Характеризуясь бессимптомным течением, КПЖ обнаруживаются у пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ), синдромом хронической тазовой боли (СХТБ), хроническим простатитом (ХП) и в случаях лучевой терапии злокачественных новообразований простаты. В физиологических условиях секрет простаты является неблагоприятной средой для камнеобразования, так как содержит очень высокие концентрации цитрата – эффективного ингибитора кальцификации. Содержание цитрата резко падает при наличии инфекции, и тогда этот «продукт» становится практически маркером – предшественником воспаления или показателем рецидива [3].
Нозологические границы КПЖ не определены, синдромальная картина и особенности терапии не обозначены, классификация не стандартизирована. Однако установлено, что кальцификация предстательной железы у пациентов с ХП связана с: а) интенсивным хроническим воспалением (высокий уровень лейкоцитурии), б) положительными микробиологическими пробами простатической жидкости и в) более продолжительным периодом клинических жалоб и симптомов [4].
Несмотря на то что КПЖ встречаются в урологической практике довольно часто, публикаций на эту тему очень мало, а исследования их связи с иными состояниями предстательной железы и особенностей лечения, несомненно, сохраняют свою актуальность, в т.ч. в контексте коморбидной патологии, например в сочетании с ДГПЖ [5, 6].
Клиническое наблюдение
В сентябре 2019 г. в Региональный медико-диагностический центр обратился пациент М. 36 лет с жалобами на периодически выраженные боли в промежности, оценив их на 5 баллов из 10 по шкале боли. Из анамнеза: с 2015 г. пациент наблюдался у урологов по поводу частых (3–4 раза в год) обострений хронического бактериального простатита. Нынешнее обострение связывал с переохлаждением.
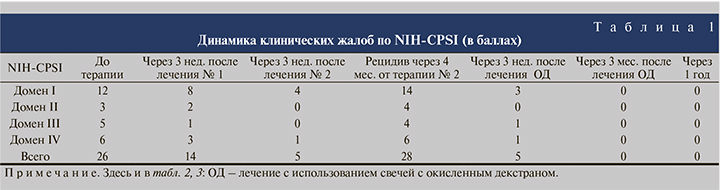
Пациенту проведено анкетирование по шкале NIH-CPSI (индекс шкалы симптомов хронического простатита и синдрома тазовых болей у мужчины) по версии Национального института здоровья США (табл. 1). Показатели общего анализа мочи и общего анализа крови в пределах референтных значений. Микроскопическое исследование соскоба из уретры: лейкоциты 3–5 в поле зрения, эритроциты 0–1–2 в поле зрения; фибрин, гонококк, трихомонада и грибы отсутствуют, микрофлора обильная, обнаружены нити фибрина, слизь +, эпителий – 5–10 в поле зрения. Секрет простаты: лейкоциты до 10 скопления, слизь +++. Данные ПЦР: Chlamydia trachomatis (качественно), Ureaplasma urealyticum (полуколичественно), Ureaplasma parvum (полуколичественно), Trichomonas vaginalis (качественно), Mycoplasma genitalium (качественно) не обнаружены. Гормоны крови: ТТГ – 1,26 мЕД/л, ФСГ – 6,21 мМЕД/мл, тестостерон общий – 15,87 нмоль/л, пролактин – 307 мЕД/л.
Аnti-Tr. pallidum IgG+IgM отрицательные.
С учетом полученных результатов и определения чувствительности к антибактериальным препаратам проведено лечение № 1: ципрофлоксацин 500 мг 1 таблетка 2 раза в день, 10 дней (табл. 1–3). Контрольное обследование после лечения включило анкетирование по шкале NIH-CPSI, исследование эякулята на условно-патогенную микрофлору и микроскопическое исследование секрета предстательной железы (табл. 1–3). Проведен повторный курс терапии офлоксацином 400 мг 1 таблетка 1 раз в день, 10 дней – лечение № 2 (табл. 1–3), и через 3 нед. вновь проведена оценка эффективности лечения. После второго курса антибиотикотерапии клиническая и лабораторная ремиссия была достигнута.
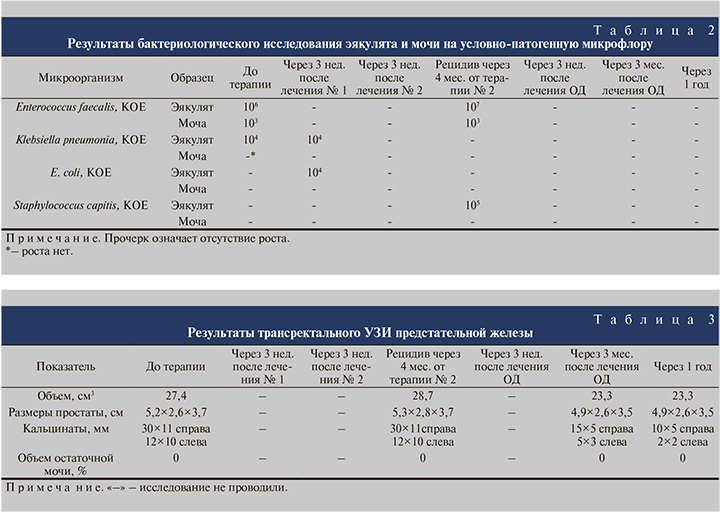
Через 4 мес. (март 2020 г.) пациент вновь обратился с жалобами на дискомфорт в промежности и при мочеиспускании, на наличие слизи в моче. Проведена антибактериальная терапия с учетом чувствительности – ципрофлоксацин 500 мг 2 раза в день 10 дней. Впервые в терапию включили свечи с окисленным декстраном – на ночь ректально по 1 свече 10 дней, далее через день по 1 свече на ночь, 20 свечей. Через 3 нед. и через 3 мес. после курса лечения достигнута клиническая и лабораторная ремиссия. С учетом анамнеза пациента – частые обострения хронического простатита на протяжении 5 лет и смешанная условно-патогенная микрофлора эякулята в периоды обострения, рекомендовано провести профилактическое лечение обострения простатита через 3 мес.: свечи с окисленным декстраном ректально по схеме 1 свеча на ночь через день, всего 10 свечей.
В феврале 2021 г. пациент приглашен в клинику РМДЦ для контрольного обследования. Возобновления жалоб за весь период наблюдения пациента не было. Впервые за 5 лет достигнута стойкая клиническая и лабораторная ремиссия на длительный период (около 1 года). По результатам трансректального УЗИ простаты отмечено уменьшение размеров кальцифицированных участков предстательной железы.
Использование ректальных свечей с окисленным декстраном в комплексной терапии хронического бактериального простатита характеризуется положительным влиянием на ткань простаты, уменьшает размер кальцифицированных участков, способствует стойкой элиминации условно-патогенной микрофлоры и достижению длительной ремиссии заболевания. Использование ректальных свечей с окисленным декстраном представляется весьма перспективным для лечения особо тяжелых форм коморбидной патологии, например бактериального простатита, осложненного кальцинатами, и ДГПЖ.



