Репродуктивная функция играет особую роль в жизнедеятельности организма, поскольку обеспечивает воспроизводство потомства, необходимое для эволюционного процесса и существования любого вида. Изучение факторов, детерминирующих репродуктивную функцию человека, является одной из фундаментальных проблем современной репродуктивной биологии и медицины.
В прошлом столетии в экономически развитых странах мира человеческие популяции после экспоненциального роста перешли к ограниченному воспроизводству и формированию малодетных семей, что стимулировало глобальный «демографический переход» [1]. Снижение рождаемости является общемировой тенденцией и отмечается во всех развитых странах. В большинстве европейских стран, включая Россию, семьи, как правило, имеют одного ребенка, т.е. меньше, чем необходимо (2,2 ребенка) для простого воспроизводства населения [2]. В России суммарный коэффициент рождаемости в 2016 г. составил 1,76, в 2018 г. – 1,6, а в 2019-м – только 1,5. Прогнозы не утешительные.
В 2020 г. низкий вариант прогноза составляет 1,5, высокий – 1,7, через 10 лет, т.е. в 2030 г. низкий вариант прогноза составит 1,5, высокий – 1,8 [3]. В европейских странах, несмотря на высокие доходы и уровень жизни, суммарный коэффициент рождаемости в 2018 г. во Франции составил 1,9, в Норвегии и Германии – 1,6, в Италии и Испании – 1,3. Самые высокие показатели традиционно наблюдаются в африканских странах – 3,0–3,5 [3].
В нашей стране ситуация с низкой рождаемостью в большей степени обусловлена социальными факторами, в частности длительным периодом обучения, стремлением женщин к финансовой независимости, их вовлечением в производственный процесс, непредсказуемостью рынка труда, доступностью контрацептивов, малой эффективностью государственных программ планирования рождаемости и финансовой поддержки многодетных семей [4]. Из-за тенденции к откладыванию родов на более поздний возраст ограничивается число последующих рождений.
В настоящее время существенный вклад в низкую рождаемость вносят значительное количество абортов, наблюдаемый экономический спад и снижение доли молодых женщин детородного возраста как последствие низкого уровня рождаемости в 1990-х гг.
Однако в процессах демографических преобразований существенную роль играют биологические детерминанты фертильности. Важнейшей детерминантой является бесплодие, которое приводит к снижению репродуктивного потенциала популяций человека. Высокая доля бесплодных браков служит проблемой многих индустриальных государств и признается одной из приоритетных задач национальных программ. Распространенность бесплодного брака в западном мире варьирует в пределах от 12 до 15% в зависимости от региона и не имеет тенденции к снижению [5]. В России наблюдается аналогичная ситуация – каждая 7-я супружеская пара на протяжении жизни сталкивается с проблемой нарушения фертильности, причем число таких пар неуклонно растет, а количество бесплодных супружеских пар достигает 16% [6].
Причины такого явления остаются невыясненными, но имеющиеся факты высвечивают глобальную проблему сохранения и повышения репродуктивного потенциала человеческой популяции. Изучение причин снижения репродуктивного здоровья населения, которое является базисом демографических процессов, имеет не только научную, но и социально-экономическую значимость, так как определяет уровень рождаемости и здоровье потомства. В настоящее время отсутствует единая концепция адаптивности и модификации репродуктивного потенциала человеческих популяций в условиях деградации окружающей среды, урбанизации, метисации, изменения образа жизни и питания, что обусловливает актуальность и своевременность популяционного изучения фертильности. Многочисленность факторов, влияющих на фертильность и репродуктивную функцию, их вариабельность и взаимодействие делают эту проблему труднорешаемой.
Мужская фертильность вносит весомый вклад в суммарный коэффициент рождаемости. В зависимости от региона распространенность бесплодия, обусловленного мужским фактором, варьируется от 20 до 70%, доля бесплодных мужчин – от 2,5 до 12%. Показатели бесплодия самые высокие в Африке и Центральной/Восточной Европе. Показатели мужского бесплодия в Северной Америке, Австралии, Центральной и Восточной Европе варьируют от 4 до 5–6%, 9% и 8–12% соответственно [7]. По самым осторожным подсчетам, по крайней мере 30 млн мужчин в мире бесплодны. В России наиболее высокие показатели мужского бесплодия регистрируют на Северном Кавказе и на Урале. В 2018 г. в нашей стране бесплодие было зарегистрировано только у 0,1% мужского населения детородного возраста, что значительно ниже, чем в других странах и может быть обусловлено недостаточностью данных [8].
Некоторые исследователи считают, что нормальная продукция сперматозоидов служит адекватным прогностическим маркером общего здоровья мужчины [9, 10]. Доказано, что мужчины с низкими показателями спермограммы с большей вероятностью имеют повышенную массу тела и артериальное давление, измененный липидный профиль по сравнению с мужчинами с нормальными показателями. Более того, такая категория мужчин характеризуется более высокой частотой метаболического синдрома, диабета, гипогонадизма, остеопороза, а также более высокой смертностью.
Учитывая возрастающие риски, связанные с воспроизводством населения, в различных странах мира стали проводить популяционные исследования мужской фертильности. Скрининг и мониторинг мужской фертильности становятся важнымм компонентами профилактики и охраны мужского репродуктивного здоровья, позволяют прогнозировать его изменения в будущем. Исследование причин мужского бесплодия и субфертильности необходимо для оценки репродуктивного и общего здоровья населения.
Целью настоящего обзора был анализ популяционных исследований мужской фертильности для выявления возможных региональных и/или этнических различий. Рассмотрены традиционные методы популяционных исследований мужской фертильности, на основе которых изучаются временные, региональные и/или этнические тренды мужского репродуктивного потенциала. Они включают спермограмму, уровень репродуктивных гормонов и иногда анализ фрагментации ДНК сперматозоидов, что позволяет получать адекватную информацию о структуре мужской фертильности в популяции и прогнозировать ее изменения в будущем.
Методы популяционных исследований мужской фертильности
Под термином фертильность следует понимать биологическую «фертильность», т.е. способность дать потомство в отсутствие контрацепции, в противоположность демографической фертильности, т.е. реальному количеству имеющихся детей. На уровне отдельного индивидуума фертильность может рассматриваться как биологический процесс, оценить который помогают определенные маркеры. Популяционные исследования мужской фертильности ведутся с использованием классических маркеров сперматогенеза (показатели спермограммы), параметров гормонального статуса, оценки целостности ДНК сперматозоидов, что позволяет высвечивать сложные процессы модификационной и наследственной изменчивости мужской фертильности.
Спермограмма. Поскольку мужскую фертильность нельзя измерить напрямую, используется ряд косвенных маркеров [11]. К наиболее простым и неинвазивным биомаркерам фертильности мужчин относятся показатели спермограммы, свидетельствующие о качестве спермы, которые применяются как в клинической андрологии, так и в популяционных исследованиях [12]. Референсные интервалы значений основных параметров спермограммы (объем эякулята, концентрация, доля подвижных и морфологически нормальных сперматозоидов в эякуляте) представлены в последнем, 5-м издании ВОЗ [12]. Стоит отметить, что референсные значения ВОЗ не являются постоянными величинами, а постоянно подвергаются пересмотру, о чем свидетельствует последовательное их снижение за последние 100 лет. Так, в 1921 г. нормальной концентрацией сперматозоидов в эякуляте считалась цифра 100 млн/мл, через 30 лет – 40, в 1992 г. – 20, в 2010 г. – всего 15 млн/мл [12].
Качество спермы играет важную роль в формировании мужской фертильности, так как положительно связано с временным интервалом, требуемым для достижения беременности, являясь предиктором оплодотворения и определяя ее благополучное течение [13, 14]. Опираясь на референсные интервалы показателей спермограммы, можно различить фертильных, субфертильных и бесплодных мужчин. Спермограмма дает важную информацию о таких серьезных формах нарушения сперматогенной функции, как, например, азооспермия или тяжелая олигозооспермия. В этом отношении спермограмма по-прежнему считается «золотым» стандартом, позволяя диагностировать 40–45% случаев мужского бесплодия [15]. Хотя спермограмму постоянно критикуют за несовершенство, вводят все новые протоколы и референсные значения параметров эякулята, она остается самым распространенным методом оценки мужской фертильности. Некоторые андрологи считают этот метод даже устаревшим, но признают его важность как начального этапа исследования мужской фертильности. В клинической практике анализ эякулята может быть использован для прогнозирования фертильности, а также для контроля качества и успешности лечения, например при заместительной гормональной терапии. Понятно, что классические параметры спермограммы не всегда обладают достаточной информативностью, поскольку не оценивают оплодотворяющую способность сперматозоидов. В действительности мужская фертильность определяется не столько концентрацией или общим количеством сперматозоидов в эякуляте, сколько их функциональной компетентностью. Кроме того, предложенные в Руководстве ВОЗ (2010) [12] референсные значения качества спермы не являются пороговыми для наступления зачатия, т.е. параметры спермы в пределах референсного интервала не гарантируют фертильности, а значения вне этих пределов не обязательно указывают на мужское бесплодие. Другими словами, мужчины, у которых показатели спермограммы ниже нормальных значений по сравнению с референсными значениями ВОЗ, могут быть фертильными, а мужчины с нормальными показателями качества спермы могут страдать бесплодием [16].
Оставаясь классическим методом оценки мужской фертильности в репродуктивной медицине, спермограмма имеет несколько важных ограничений при использовании в популяционных исследованиях. Ее выполнение относительно трудоемко, а показатели имеют диагностические погрешности [17]. Об этом свидетельствует тот факт, что определенная доля мужчин с нормальными параметрами спермограммы (до трети обследованных мужчин из бесплодных пар) все-таки бесплодны. К существенным недостаткам спермограммы относятся значительная вариабельность результатов, отсутствие ясных референсных границ и четкой стандартизации, что негативно влияет на качество научных и эпидемиологических исследований, может приводить к неправильной классификации участников исследования по статусу фертильности и ухудшать клинические методы диагностики, поскольку они требуют точной информации о качестве спермы [18]. Снизить вероятность лабораторных ошибок при анализе спермы помогают тщательное соблюдение методов, описанных в Руководстве по исследованию и обработке спермы человека [12], применение внешнего контроля качества и соответствующей подготовки лабораторного персонала. Это особенно важно при выполнении мультицентровых исследований, а также при длительном мониторинге показателей спермограммы. В эпидемиологических исследованиях большое число участников может компенсировать влияние случайных ошибок в каждом индивидуальном анализе при расчете средних значений для популяции [18].
В клинической андрологии рекомендуется несколько раз получать эякулят и анализировать спермограмму мужчин из бесплодных пар, что уменьшает вариабельность параметров качества спермы и позволяет более точно классифицировать мужчин по фертильности. Такой подход практически исключается в популяционных исследованиях, при проведении которых практикуется однократный забор эякулята и анализ спермограммы от каждого индивидуума [19–22]. Помимо дополнительных затрат времени и средств на повторную спермограмму, мужчины, особенно из общей популяции, менее охотно сдают второй эякулят, что приводит к уменьшению размера выборки. При этом показано, что у здоровых мужчин общей популяции показатели качества спермы в первом и втором образцах эякулята достоверно не различались, т.е. один эякулят является достаточным индикатором при популяционной оценке мужской фертильности [23, 24]. В то же время не следует отказываться от повторного определения параметров спермограммы у субфертильных мужчин из-за более высокой индивидуальной вариабельности и ограниченной воспроизводимости результатов.
Репродуктивные гормоны. Сперматогенез зависит от целого ряда гормонов, действующих эндокринными и паракринными путями. Тестостерон, фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны, определяют судьбу половых клеток и в их отсутствии половые клетки подвергаются апоптозу [25, 26]. В клинической практике для выявления возможных эндокринных причин субфертильности и бесплодия в дополнение к анализу эякулята проводят гормональные тесты, включающие определение ФСГ и ЛГ, а также тестостерона и ингибина В, что существенно расширяет возможности оценки мужской репродуктивной функции и помогает выявлять предполагаемую специфическую эндокринопатию [26, 27]. Например, определение уровня ЛГ, ФСГ и тестостерона помогает идентифицировать у мужчин дефицит гонадотропинов (низкий тестостерон, ЛГ и ФСГ), первичную тестикулярную недостаточность (низкий тестостерон, повышенный ЛГ и ФСГ), сперматогенную недостаточность (нормальный тестостерон и ЛГ, повышенный ФСГ) или андрогеновую резистентность (высокий тестостерон, повышенный ЛГ). Однако у бесплодных мужчин с азооспермией содержание данных гормонов может быть в норме.
Тестостерон считается основным андрогеном семенника, поддерживающим сперматогенез; кроме этого, существенную роль в развитии органов репродуктивной системы, половом созревании и сексуальном поведении играют андрогены, которые секретируются клетками Лейдига семенников при стимулирующем воздействии ЛГ. Тестостерон, имея своей классической мишенью сперматогенез, стимулирует развитие сперматоцитов и ингибирует апоптоз, тогда как в отсутствие тестостерона сперматогенез не идет дальше стадии мейоза [25]. Несмотря на то что стимулирующий эффект на сперматогенез оказывает внутритестикулярный тестостерон, содержание которого в 25–100 раз выше в семенниках, чем в периферической крови, у бесплодных мужчин отмечали сниженный уровень общего тестостерона и повышенный уровень ЛГ, что указывает на сниженную функцию клеток Лейдига параллельно ослабленному сперматогенезу [28]. На большой выборке молодых мужчин из общей популяции установлено, что уровень общего тестостерона не связан с параметрами спермограммы, включая концентрацию, подвижность и морфологию сперматозоидов, но снижение качества спермы сопровождалось повышенным уровнем ЛГ, указывая на компенсаторное снижение функции клеток Лейдига при ослабленном сперматогенезе [29].
Фолликулостимулирующий гормон необходим для индукции, качественного и количественного поддержания сперматогенеза, признается прямым маркером сперматогенеза [26, 27]. Тем не менее нормальный уровень ФСГ еще не гарантирует успешного сперматогенеза из-за широкой вариабельности и недостаточно высокой диагностической точности, что ставит под сомнение его предиктивную способность [30].
Ингибин В – тестикулярный полипептидный гормон – по принципу отрицательной обратной связи регулирует гипофизарную секрецию ФСГ, подавляя ее. Он продуцируется преимущественно клетками Сертоли семенника, которые располагаются на базальной мембране семенных канальцев и имеют рецепторы для ФСГ и тестостерона. Ингибин В служит прямым маркером функции клеток Сертоли и непрямым – сперматогенеза [31]. Считается доказанной положительная связь между уровнем ингибина В и концентрацией/общим количеством сперматозоидов в эякуляте [32, 33]. Уровни ингибина В и ФСГ отрицательно взаимосвязаны в самых различных клинических случаях, являясь взаимодополняющим способом диагностики тестикулярной дисфункции [32, 34]. Интересно отметить, что в ряде работ установлена тенденция к более выраженной взаимосвязи между уровнем ингибина В и концентрацией сперматозоидов у мужчин с ослабленным сперматогенезом [33, 35, 36]. Показано, что уровень ингибина В значительно ниже, а уровень ФСГ, наоборот, значительно выше у бесплодных мужчин по сравнению с мужчинами с доказанной либо с неизвестной фертильностью из общей популяции, однако значительное перекрывание уровней ингибина В и ФСГ у бесплодных мужчин и мужчин общей популяции не позволяет с достаточной точностью выделить мужчин с бесплодием только на основании результатов измерения уровней этих гормонов [30].
В популяционных исследованиях прогностическую роль гормональных маркеров сперматогенеза (тестостерон, ЛГ, ФСГ, ингибин В) следует интерпретировать с осторожностью, потому что средние популяционные уровни репродуктивных гормонов не всегда отражают региональную изменчивость в показателях сперматогенеза. В работе [36] между популяциями молодых мужчин, проживающих в урбанизированных регионах Западной Сибири, установлены достоверные различия по общему количеству, концентрации и доле морфологически нормальных сперматозоидов в эякуляте, однако не было обнаружено региональных различий по уровню ЛГ, ФСГ и общего тестостерона. Аналогичные результаты получены при исследовании выборки молодых мужчин общей популяции во Фландрии [35]. Обобщая сказанное, можно заключить, что для оценки мужского репродуктивного потенциала популяции определение уровня репродуктивных гормонов (в том числе общего тестостерона, ЛГ, ФСГ и ингибина В) играет вспомогательную роль и не может заменить спермограмму.
Фрагментация ДНК сперматозоидов. В последние десятилетия проводился интенсивный поиск новых маркеров мужского бесплодия и субфертильности, которые оперировали бы за пределами, объясняемыми параметрами спермограммы. Стимулирующим фактором явилось широкое распространение вспомогательных репродуктивных технологий (ВРТ), где для повышения шансов беременности необходимы более точные предикторы мужской фертильности, а успешность оплодотворения служит принципиально важным критерием оценки качества ВРТ. Поиск привел к пониманию, что целостность ДНК сперматозоидов является критическим фактором поддержания высокого репродуктивного потенциала, а повреждение ДНК сперматозоидов связано с серьезными репродуктивными последствиями [17, 37]. Среди различных повреждений ДНК, которые могут присутствовать в сперматозоиде, фрагментация ДНК является наиболее частой, особенно среди бесплодных мужчин. В арсенал методов лабораторной диагностики и в популяционные исследования мужской фертильности все чаще включается анализ фрагментации ДНК сперматозоидов, поскольку спермограмма не идентифицирует дефекты в структуре хроматина сперматозоидов.
Для оценки фрагментации ДНК сперматозоидов применяют несколько методов, наиболее популярные из которых TUNEL, COMET, Halosperm, SCSA (структурный анализ хроматина сперматозоидов). Особенности и характеристики этих методов, опыт применения в репродуктивной медицине и при ВРТ подробно освещены в отечественной и зарубежной литературе [17, 38–41]. Результаты, получаемые всеми методами, хорошо коррелируют между собой. Анализ фрагментации ДНК сперматозоидов довольно широко используется в некоторых репродуктивных центрах, но вызывает споры относительно его прогностической мощи применительно к оценке фертильности и исхода ВРТ [42]. В нашей стране данный метод все еще не включен в базовую диагностическую схему обследования бесплодных и субфертильных мужчин [43].
Имеющиеся данные указывают на значительную роль фрагментации ДНК сперматозоидов в формировании мужского фактора бесплодия [44]. Так, было убедительно доказано, что сперматозоид, содержащий фрагментированную ДНК, может быть живым, подвижным, морфологически нормальным и способным оплодотворить яйцеклетку [37, 41]. Повышенный уровень фрагментации ДНК в сперматозоидах ассоциирован с пониженным уровнем оплодотворения и качеством эмбрионов, более высокой частотой невынашивания беременности [42, 44] и влияет на исход беременности после ВРТ [39, 41, 44]. Показана отрицательная взаимосвязь между степенью фрагментации ДНК сперматозоидов, их концентрацией в эякуляте, подвижностью и морфологическими характеристиками. Следовательно, нарушение целостности ДНК сперматозоидов и нарушение сперматогенеза в ряде случаев могут вызываться одними и теми же причинами, однако анализ на фрагментацию ДНК сперматозоидов следует рассматривать как отдельный этап исследования мужской фертильности, не заменящий спермограмму [45, 46].
Целый ряд этиологических факторов ассоциирован с фрагментацией ДНК в сперматозоидах: курение, радиация, химиотерапия, загрязнение окружающей среды, а также патофизиологические состояния [17, 37, 47, 48]. Целостность ДНК в сперматозоидах может нарушаться в результате сбоев дифференцировки мужских гамет при переходе от нуклеосомной организации хроматина к протаминовой, что ведет к нерепарированным разрывам ДНК [44]. Фрагментация ДНК в дифференцирующихся половых клетках может быть следствием незавершенного апоптоза [37], оксидативного стресса, вызванного избыточной продукцией свободных радикалов [17]. Многие авторы рассматривают оксидативный стресс как главный механизм, приводящий к появлению в эякуляте сперматозоидов с фрагментированной ДНК [17, 37, 42, 44].
Для популяционных исследований наиболее приемлем метод структурного анализа хроматина сперматозоидов (SCSA), он прекрасно дополняет спермограмму и дает дополнительную прогностическую информацию о репродуктивном потенциале как отдельного индивидуума, так и исследуемой когорты мужчин [45, 48]. К несомненным преимуществам данного метода можно отнести быструю оценку большого количества сперматозоидов, возможность хранить сперматозоиды в замороженном виде и измерять одномоментно много образцов, а высокая чувствительность и воспроизводимость результатов делают его незаменимым в долгосрочных популяционных исследованиях. Наличие референтных значений индекса фрагментации ДНК сперматозоидов (ИФД), важных для прогноза фертильности, характеризует наиболее важную особенность этого метода [38].
Временные тренды снижения мужской фертильности
В последние несколько десятилетий в различных регионах мира отмечено снижение мужского репродуктивного потенциала. Многочисленные исследования и несколько мета-анализов дают основание считать доказанным негативный временной тренд параметров спермограммы, в первую очередь концентрации и общего количества сперматозоидов в эякуляте у мужчин вне зависимости от географического положения и возраста. Основное число исследований проведено в Западной Европе и США.
Впервые такое заключение сделано в работе [49], где авторы, анализируя данные 61 статьи, установили, что концентрация сперматозоидов за последние 50 лет снизилась с 113 млн/мл в 1940 г. до 66 млн/мл, а объем эякулята уменьшился с 3,4 до 2,8 мл. В последующих исследованиях был подтвержден временной тренд снижения качества спермы в течение последних десятилетий. В одноцентровом исследовании популяции парижских мужчин (n=1350) с доказанной фертильностью также выявлено временное снижение качества спермы [50]. В этой работе с 1973 по 1992 г. исследовалась когорта мужчин – доноров спермы, которые на момент проведения исследования имели по крайней мере одного ребенка. Концентрация сперматозоидов уменьшилась от 89 до 60 млн/мл, что составило 2,1% в год. В тот же период доля подвижных и морфологически нормальных сперматозоидов уменьшалась соответственно на 0,6 и 0,5% ежегодно. Изменений в объеме эякулята обнаружено не было.
В одноцентровом исследовании шотландских мужчин с неизвестной фертильностью применен другой принцип: группа молодых мужчин (средний возраст – 27 лет) была разделена на четыре подгруппы в соответствии с датой рождения [51]. Группы с более поздней датой рождения имели более низкую концентрацию и число подвижных сперматозоидов. Медианная концентрация сперматозоидов снижалась с 98 млн/мл у мужчин с датой рождения до 1959 г. до 78 млн/мл у рожденных после 1970 г. Общее число сперматозоидов снижалось с 301 до 214 млн, а подвижных – с 169 млн до 106 млн. Таким образом, авторы заключили, что качество спермы ухудшается, причем более поздний год рождения связан с уменьшением числа сперматозоидов у взрослых мужчин.
Негативный временной тренд снижения качества спермы обнаружен у жителей южной части Индии из штатов Карнатака, Керала и Гоа [52]. В данной работе изучалась когорта мужчин, обратившихся в клинику по поводу бесплодия. Концентрация сперматозоидов в 2004–2005 гг. составила 26,61±0,71 млн/мл, а в более ранний период, 1993–1994 гг., – 38,18±1,46 млн/мл. Аналогичный негативный тренд наблюдался в отношении подвижности и нормальной морфологии сперматозоидов.
На бразильской популяции бесплодных мужчин в ретроспективном когортном исследовании [53] анализировали помимо обычных параметров спермограммы распространенность олигозооспермии и азооспермии, сравнивая два временных отрезка: 2000–2002 и 2010–2012 гг. Обнаружено снижение концентрации сперматозоидов с 61,7 до 26,7 млн/мл, общего количества сперматозоидов в эякуляте – с 183,0 до 82,8 млн/эякулят, доли морфологически нормальных форм – с 4,6 до 2,7%. Распространенность тяжелой олигозооспермии возросла с 15,7 до 30,3%, азооспермии – с 4,9 до 8,5%.
Многоцентровое исследование популяции французских мужчин (n=26 609), партнеров бесплодных женщин, направленных для проведения ВРТ из 126 центров ЭКО [54], позволило установить снижение концентрации сперматозоидов на 1,4 млн/мл за год и на 32,2% за период с 1989 по 2005 г. (от 73,6 до 49,9 млн/мл, коррекция на возраст в 35 лет). Доля морфологически нормальных сперматозоидов также уменьшалась. Так как мужчин направляли на обследование без учета показателей спермограммы, полученные результаты можно считать близкими к величинам, характеризующим общую популяцию французских мужчин.
Параметры спермы с 1993 по 2012 г. были изучены на 5739 норвежских мужчинах, поступивших в Репродуктивный центр Северной Норвегии для лечения или обследования по поводу бесплодия [55]. Установлено постепенное снижение объема эякулята (с 4,0 до 2,9 мл), концентрации (с 53,1 до 37,9 млн/мл) и общего количества (с 189,9 до 103,9 млн/эякулят) сперматозоидов. В то же время между первой и второй декадами исследования наблюдалось увеличение доли азооспермии – с 6,3 до 13,2% и олигозооспермии – с 26,4 до 28,9%.
В США была изучена группа мужчин (n=936), обратившихся в Общий госпиталь Массачусетса по поводу бесплодия в браке в 2000–2017 гг. [56]. Анализировали объем эякулята, концентрацию, общее количество, подвижность и морфологию сперматозоидов, согласно Рекомендациям ВОЗ (2010) [12]. Концентрация и общее количество сперматозоидов уменьшались на 2,62 и 3,12% в год соответственно, что соответствовало общему снижению на 37 и 42% соответственно (от 72.8 до 49.0 млн/мл; от 168 до 122 млн/эякулят соответственно). Негативные тренды были отмечены для подвижности и морфологически нормальных форм сперматозоидов. Эта работа подтвердила значительное временное снижение качества спермы, установленное в более ранних работах.
В последние два десятилетия опубликовано два крупных мета-анализа, посвященных изучению временных изменений качества спермы у мужчин, проживающих в разных регионах мира. В первом мета-анализе, включившем 101 публикацию, подтвержден временной тренд снижения концентрации сперматозоидов у жителей Европы и США [57]. Во второй мета-анализ вошло 185 публикаций и 42 935 мужчин с исключенной субфертильностью или бесплодием [58]. Мета-анализ также выявил значительное снижение концентрации и общего количества сперматозоидов в эякуляте мужчин за период с 1973 по 2011 г. (на 0,75% в год и 28,5% в целом для обоих показателей). Авторы отметили, что негативные изменения более выражены у мужчин Западной Европы.
Несмотря на массу данных, выявивших временной секулярный тренд мужской фертильности в разных регионах мира, есть работы, в которых данное утверждение не нашло подтверждения. В основном это ранние работы, например работа [59], исследующая финскую популяцию мужчин, работы [60–64], выполненные на выборках французов, японцев, датчан, американцев, шведов, в которых не было выявлено временных изменений параметров спермограммы.
Региональные и этнические различия мужского репродуктивного потенциала
Анализ результатов популяционных исследований мужской фертильности свидетельствует о значительных региональных и этнических различиях в продукции и качестве сперматозоидов и профиле репродуктивных гормонов, предполагая, что регион проживания и этническая принадлежность остаются важной детерминантой мужской фертильности (см. таблицу). Например, в Балтийском регионе у мужчин с доказанной фертильностью более низкая концентрация и доля сперматозоидов с нормальной морфологией установлены для датчан по сравнению с эстонцами или финнами [65]. В Северной Европе самые высокие значения концентрации сперматозоидов отмечены у жителей Литвы, Эстонии и Финляндии, самые низкие – у датчан, немцев и жителей Швейцарии [19; 66–68].
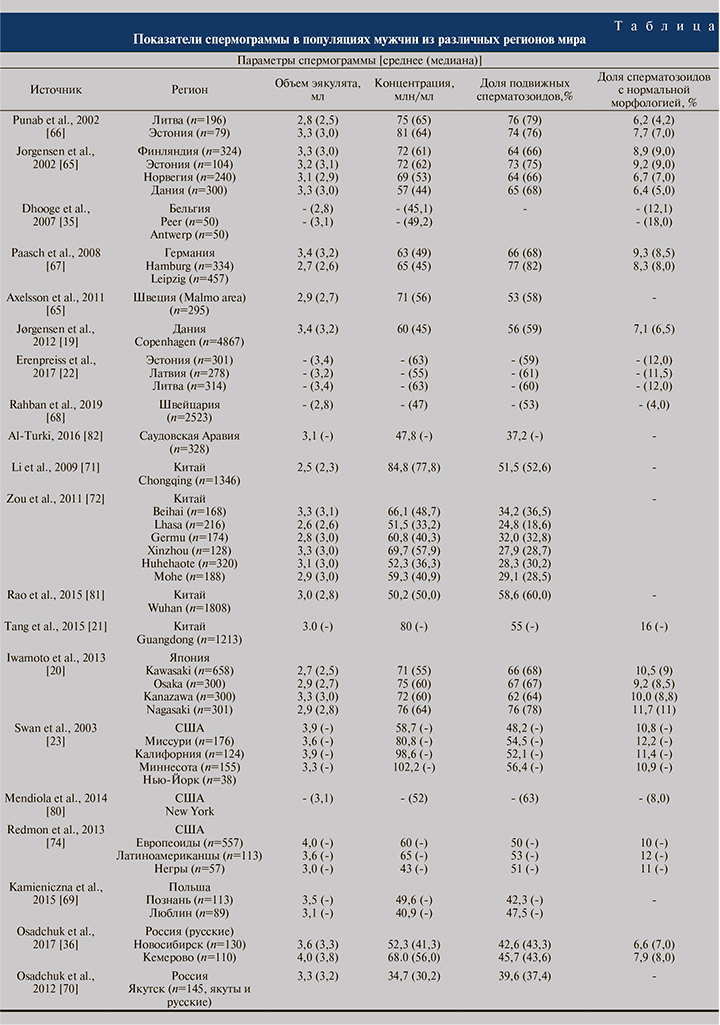
У представителей славянской этнической группы – поляков [69] и русских [36] – отмечены близкие показатели объема эякулята и подвижности сперматозоидов, однако их концентрация была очевидно выше у русских мужчин. В то же время сравнение русских и якутов, проживающих в Якутске, не выявило значительных различий в показателях спермограммы и уровне репродуктивных гормонов, что ясно указывает на ведущую роль эколого-климатических факторов в формировании мужской фертильности [70].
У японских мужчин концентрация сперматозоидов оказалась явно ниже, чем у китайцев, что позволяет предположить наличие региональных различий в качестве спермы среди азиатских мужчин [20, 71, 72]. В то же время у китайских мужчин установлены различия в концентрации, подвижности и морфологии сперматозоидов в зависимости от провинции проживания, предположительно из-за различий в климате, экологической обстановке и питании [72].
В США концентрация сперматозоидов в эякуляте у мужчин города Колумбия оказалась ниже, чем в Нью-Йорке, Миннеаполисе и Лос-Анджелесе [73]. У американцев негроидной расы объем эякулята и концентрация сперматозоидов были достоверно ниже по сравнению с мужчинами европеоидной расы или латиноамериканцами [74].
В исследовании, проведенном в Калифорнии, сравнивали качество спермы у мужчин европеоидной и монголоидной рас [75]. Установлено, что мужчины европеоидной расы характеризовались большим объемом эякулята, но меньшей концентрацией и общим числом сперматозоидов в эякуляте по сравнению с представителями монголоидной расы. Субоптимальное качество спермы отмечено у меньшей доли азиатских мужчин по сравнению с белыми, однако распространенность азооспермии выше у белых мужчин.
У жителей Катара качество спермы (концентрация, подвижность и морфология) было значительно ниже, а распространенность олигозооспермии, астенозооспермии и тератозооспермии выше у резидентов, родившихся на Ближнем Востоке и в Северной Африке по сравнению с резидентами, прибывшими из других регионов, хотя различий по индексу фрагментации ДНК сперматозоидов не выявлено [76].
Несмотря на большое число проведенных исследований, глобальные тренды региональных и этнических изменений мужской фертильности еще не обозначены, а причины региональных различий в репродуктивных параметрах, включая качество спермы, все еще остаются неизвестными. Предполагают, что в региональную изменчивость мужской фертильности вносят вклад эколого-климатические факторы (загрязнение окружающей среды), особенности индивидуального образа жизни и генетические факторы [77–79].
Популяционные исследования мужской фертильности характеризуются существенными методологическими недостатками, такими как отсутствие стандартизации клинических и лабораторных анализов, различные принципы формирования выборок или отсутствие соответствующего контроля. Средние значения или медианы для параметров спермограммы у выборок из одного и того же региона могут значительно различаться, например, у мужчин из Нью-Йорка концентрация сперматозоидов в эякуляте отличается почти в 2 раза [73, 80]. Различия могут быть обусловлены методическими погрешностями, разным возрастом, питанием и физическими нагрузками, а также разным статусом фертильности. В ряде случаев региональные различия в качестве спермы могут быть обусловлены различной методологией подбора испытуемых лиц. Например, в некоторых европейских исследованиях [65–67] выборки из общей популяции состояли из молодых мужчин в возрасте 18–20 лет, призванных в армию. Такой методический прием имеет свои преимущества, так как в этом случае подбираются испытуемые, как правило, не знающие о своих репродуктивных проблемах. Однако в эту выборку попадают исключительно молодые мужчины, что не позволяет оценивать репродуктивный потенциал мужчин активного репродуктивного возраста (30–50 лет). В ряде эпидемиологических исследований изучалось качество спермы мужчин с «доказанной фертильностью», партнерши которых были беременными на момент обследования [21, 73], либо доноров спермы [81]. В этом случае нельзя считать, что выборка репрезентативна общей популяции мужчин данного региона, поскольку не включала инфертильных и субфертильных мужчин. В других эпидемиологических исследованиях изучаемые выборки состояли, как правило, из пациентов репродуктивных центров и клиник, обратившихся по поводу бесплодия в паре [76, 82]. В этом случае интерпретация результатов исследования существенно ограничена из-за значительной доли мужчин с идиопатическим бесплодием. Исследования репродуктивных показателей мужчин, проводимые по единому протоколу в различных регионах, отличающихся климатом, уровнем загрязнения природной среды и образом жизни населения, могли бы помочь выявить факторы, модифицирующие состояние мужской репродуктивной системы. В то же время такие исследования могли бы стать отправной точкой для многолетнего мониторинга мужского репродуктивного здоровья.
Для получения объективных сведений о мужском репродуктивном потенциале данной популяции необходим адекватный подход к формированию выборки обследуемых лиц. Наиболее информативным представляется метод случайных выборок из общей популяции. Преимуществом такого подхода является возможность оценить репродуктивную функцию у лиц, которые не имеют сведений о своей фертильности; среди них могут быть как клинически здоровые мужчины, так и мужчины, имеющие нарушения в репродуктивной сфере, что повышает размах популяционной изменчивости мужской фертильности и репрезентативность данной выборки общей популяции. Такой подход позволяет прогнозировать структуру мужской фертильности, оценивать распространенность репродуктивных нарушений и изучать их патогенез, выявлять временные тренды и проводить мониторинг репродуктивного потенциала данной популяции. Следует подчеркнуть, что в настоящее время существует значительный пробел в наших знаниях относительно мужского репродуктивного потенциала различных российских регионов, между тем они становятся особенно актуальными в связи с повышенным вниманием к демографической ситуации в стране и усилением профилактики репродуктивных нарушений.
Заключая, можно выделить следующее. Классическими индикаторами мужской фертильности в популяционных исследованиях являются концентрация, подвижность и морфологические характеристики сперматозоидов, гормональные маркеры сперматогенеза, в последние годы пополненные анализом фрагментации ДНК сперматозоидов. По приблизительным оценкам, почти 30 млн мужчин во всем мире страдают от бесплодия, и количество мужчин, обращающихся за медицинской помощью, неуклонно растет. В парах, не способных к зачатию, бесплодие частично или полностью приписывается мужскому фактору примерно в 50% случаев. Результаты популяционных исследований свидетельствуют о наличии временного тренда снижения мужского репродуктивного потенциала, в первую очередь концентрации и общего количества сперматозоидов в эякуляте у мужчин вне зависимости от географического положения и возраста. На мужской репродуктивный потенциал влияет много средовых и генетических факторов, которые могут действовать как поодиночке, так и совместно, усиливая действие друг друга. Регион проживания и этнические особенности являются важным детерминантом мужского репродуктивного потенциала и вносят существенный вклад в формирование негативного тренда его изменений.



