Введение. Спермограмма является основным методом диагностики мужского бесплодия, который позволяет оценивать мужской репродуктивный потенциал. В течение последних 40 лет эксперты ВОЗ пытаются стандартизировать методику исследования эякулята. За это время выпущено уже шесть обновлений этого руководства, в каждом из которых делалась попытка интерпретировать имевшиеся на момент публикации статистические данные для разделения популяции фертильных и бесплодных мужчин [1].
Авторы шестого издания отдельно подчеркнули значимость исследования уровня оксидативного стресса и посвятили отдельный подраздел этому исследованию. С учетом большого числа публикуемых исследований, говорящих о влиянии избыточной продукции активных форм кислорода на мужскую фертильность, а также выделения многими авторами мужского бесплодия, вызванного оксидативным стрессом как отдельной клинической группы [2], исследование уровня окислительного стресса может стать в отдельных клинических ситуациях рутинным.
Sulagna Dutta и соавт. в 2019 г. опубликовали научную работу, включившую 46 обзоров, 1 мета-анализ и 18 оригинальных исследований по проблеме оксидативного стресса. Авторы нашли связь окислительного стресса с патоспермией, выявили, что в физиологических условиях уровень активных форм кислорода определяет процессы созревания сперматозоидов, нормальной конденсации хроматина и оплодотворения [3].
Zahra Beygi и соавт. в 2021 г., изучая роль окислительного стресса в развитии инфертильности, обнаружили, что почти у 50% всех бесплодных мужчин отмечались дисбаланс в уровне активных форм кислорода и повреждения ДНК сперматозоидов [4].
Общеизвестно, что у инфертильных мужчин помимо правильного спермиологического диагноза необходимо определить верный клинический диагноз. И мероприятия по лечению бесплодия в идеале должны начинаться с устранения клинических предпосылок их инфертильности.
Однако, говоря о мужском бесплодии, ассоциированном с повышенным уровнем активных форм кислорода (АФК), этот подход не всегда приемлем. Не рекомендовано оперировать пациентов с варикоцеле старше 40 лет из-за невысокой эффективности оперативного лечения. Много дискуссий относительно лечения хронических воспалительных процессов органов репродуктивной системы мужчин из-за репротоксичности антибиотиков и длительности подобного лечения [5].
Именно поэтому остается актуальной проблема поиска эффективных лекарственных препаратов с антиоксидантным действием.
Все антиоксиданты разделяют на антиоксиданты опосредованного и направленного действий. Первые способны снижать интенсивность свободно-радикального окисления только в биологических объектах, но неэффективны in vitro. Механизмы их действия различны: активация (реактивация) антиоксидантных ферментов; подавление в организме реакций, приводящих к образованию активных форм кислорода; сдвиг реакций свободно-радикального окисления в сторону образования менее реакционноспособных соединений; нормализация обмена веществ и т.д. Антиоксиданты направленного действия, наоборот, обладают непосредственными антирадикальными свойствами, которые можно обнаружить в тестах in vitro [6].
В подавляющем большинстве случаев используемые в клинике антиоксиданты – это гидрофобные соединения, способные к взаимодействию с радикалами, локализованными в основном в гидрофобной зоне мембран и липопротеинов. Однако первая острая фаза воспалительных заболеваний проходит в условиях гиперпродукции активных форм кислорода, локализованных в водной фазе, где наибольшей эффективностью обладают гидрофильные вещества, оказывающие влияние на концентрацию ионов двухвалентного железа [6].
Поэтому наибольшее распространение получили L-карнитины, токоферол, коэнзим Q10, производные 3-оксипиридина (мексидол), производные янтарной кислоты и некоторые другие [7].
Среди новых классов препаратов с антиоксидантной активностью можно выделить регуляторные пептиды, так как появляется все больше публикаций об их благоприятном воздействии на оксидативный стресс [8].
Нами было проведено исследование по изучению антиоксидантной активности препарата Суперлимф, который представляет собой комплекс противомикробных пептидов и цитокинов.
Препарат стимулирует функциональную активность клеток фагоцитарного ряда (моноцитов и нейтрофилов): активирует фагоцитоз, выработку цитокинов (ИЛ-1, ФНО), индуцирует противоопухолевую цитотоксичность макрофагов, способствует гибели внутриклеточных паразитов, регулирует миграцию клеток в очаг воспаления, увеличивает активность естественных киллеров. Препарат обладает антиоксидантной активностью, снижает развитие воспалительных реакций и предназначен для комплексного лечения воспалительных заболеваний урогенитального тракта, в том числе осложненных бактериальными и вирусными инфекциями [9].
Цель исследования: оценка эффективности применения комплекса противомикробных пептидов и цитокинов Суперлимф® в лечении мужского бесплодия, ассоциированного с высоким уровнем оксидативного стресса.
Материалы и методы. Проведено открытое проспективное многоцентровое исследование с включением 30 пациентов с инфертильностью, ассоциированной с повышенным уровнем активных форм кислорода, которым исследователями в рамках рутинной практики был назначен препарат Суперлимф в комплексной терапии. Длительность курса Суперлимф® – 25 ЕД/сут. (1 суппозиторий) ректально на ночь, 60 дней. Комплексная терапия назначалась исходя из клинических рекомендаций, утвержденных МЗ РФ. В ходе исследования пациентам по показаниям назначались антибиотики (левофлоксацин в дозировке 1000 мг в 2 приема в сутки), витамин Д в дозировке 4000 МЕ. Двенадцати пациентам с идиопатическим бесплодием назначались карнитин-содержащие БАДы.
Включались пациенты в возрасте от 18 до 45 лет с нарушением репродуктивной функции в форме олиго-, и/или астено-, и/или тератозооспермии, и/или повышенной фрагментацией ДНК сперматозоидов на фоне повышения уровня активных форм кислорода.
Средний возраст участников составил 32,4±3,27 года. Диапазон колебался от минимального в 21 год до максимального – 44 года. Поэтому демографические характеристики пациентов на ход исследования влияния оказать не могли.
Клинические диагнозы у пациентов с повышенным уровнем АФК: хронический бактериальный простатит – 11 человек; варикоцеле (при отказе пациента от оперативного лечения) – 7; идиопатическое бесплодие – 12 человек.
В исследование не включались пациенты со следующими сопутствовавшими заболеваниями: врожденные аномалии развития половых органов; острые воспалительные заболевания органов мочевыделительной системы; нейрогенные дисфункции мочевого пузыря, склероз шейки мочевого пузыря, стриктура уретры, ДГПЖ. Также исключалось участие пациентов с аутоиммунными заболеваниями, в том числе наличие антиспермальных антител (MAR-IgG >50%); хроническим алкоголизмом/наркоманией; не способных адекватно отвечать на вопросы исследователя, заполнять необходимые документы и принимать исследуемый препарат.
После определения соответствия пациента критериям включения/исключения и подписания пациентом письменного согласия на участие в исследовании собирался анамнез, проводился физикальный осмотр. Пациентам выполнялась спермограмма (по ВОЗ-2010), определение MAR-теста Ig G; продукция активных форм кислорода (АФК/ROS) в нативной сперме; продукция активных форм кислорода (АФК/ROS) отмытыми сперматозоидами; микробиологическое исследование спермы на аэробные микроорганизмы с чувствительностью к антибиотикам; проводилось исследование ПЦР-13 мазка из уретры; определялась фрагментация ДНК сперматозоидов.
На контрольном визите оценивалась комплаентность, выполнялась спермограмма (по ВОЗ-2010), продукция активных форм кислорода (АФК/ROS) в нативной сперме; определялась фрагментация ДНК сперматозоидов.
Полученные клинические и лабораторные данные регистрировались в бумажных ИРК и сводились в единый электронный документ.
Оценка безопасности проводилась на основании зарегистрированных нежелательных явлений.
Так как распределение большинства показателей отличалось от нормального, для описательной статистики использовались медиана (среднее) и интерквартильное расстояние (распределение). Сравнение параметров до и после лечения проводилось при помощи теста Уилкоксона (для сравнения парных параметров в непараметрической статистике).
Результаты исследования. Основные результаты исследования представлены в таблице.
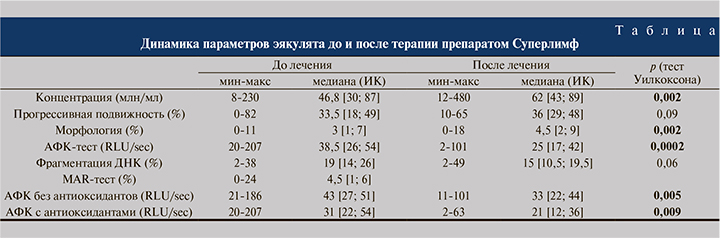
При наборе в исследование олигозооспермия была зафиксирована у 3 из 30 пациентов. В контрольной спермограмме олигозооспермия отмечена только у одного пациента.
В группе пациентов, принимавших только Суперлимф, и в группе пациентов, которым дополнительно были назначены антиоксиданты, отмечена положительная динамика (см. рис. 1). Среднее значение концентрации сперматозоидов выросло с 46,8 [30; 87] до 62 [43; 89] млн/мл, что стало статистически значимым отличием (р=0,002).
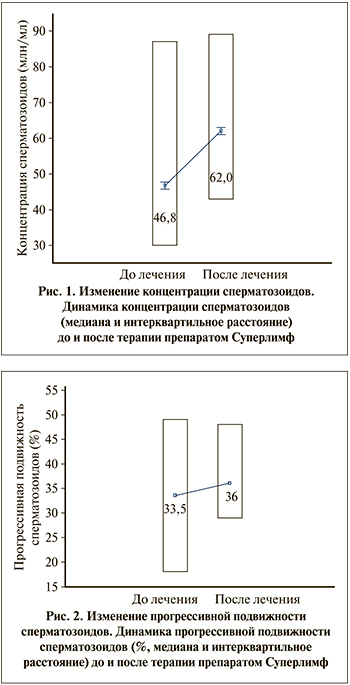
Подвижность сперматозоидов является достаточно важным показателем спермограммы и доказанно снижается у пациентов с ОС. Тем интереснее было отметить факт улучшения подвижности сперматозоидов у всех пациентов. Причем значимого влияния именно антиоксидантной терапии по сравнению с Суперлимфом выявлено не было. Подвижность улучшалась и при монотерапии Суперлимфом за счет снижения уровня АФК в эякуляте. Хотя среднее значение (медиана) прогрессивной подвижности повысилось несущественно (с 33,5 до 36%) и это отличие не стало статистически значимым (р=0,09), мы отметили, что у 9 из 15 (60%) пациентов с исходной астенозооспермией показатель прогрессивной подвижности пришел в норму, что заметно по распределению параметра. Интерквартильное расстояние изменилось со значения [18; 49] до значения [29; 48], и это можно наблюдать на рис. 2.
Изменение уровня морфологически нормальных сперматозоидов обусловлено физиологией процесса апоптоза. Этот показатель наиболее сложно поддается коррекции. Достаточно часто требуется более значимый временной интервал лечения для приведения этого показателя к значениям клинической нормы.
Положительная динамика отмечалась у 23 из 30 пациентов (77%). Среднее значение нормальной морфологии повысилось с 3 [1; 7] до 4,5% [2; 9], что стало статистически значимым отличием (р=0,002). Также было отмечено, что морфологически нормальные формы более значимо повышались у пациентов, принимавших комплексную терапию.
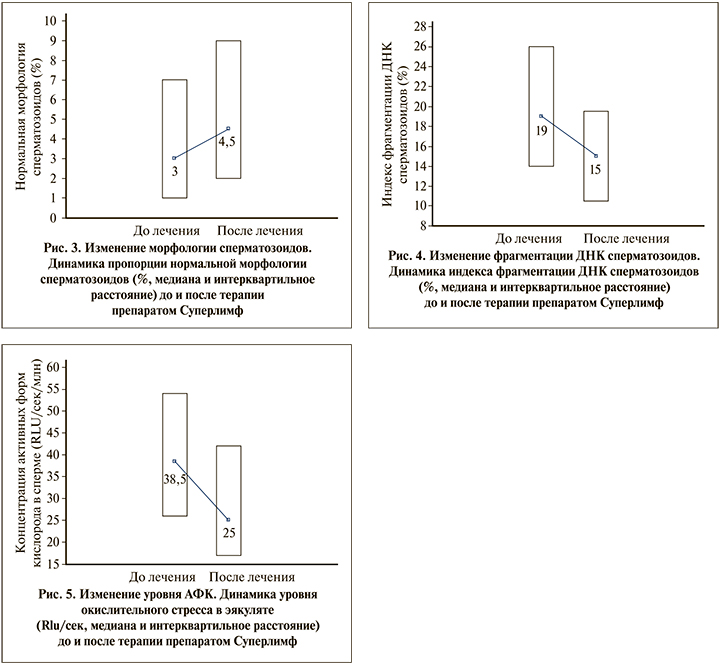
Изменение уровня фрагментации ДНК сперматозоидов и уровня АФК. Помимо основных рутинных спермиологических тестов в настоящем исследовании оценивались показатели уровня фрагментации ДНК сперматозоидов и уровни динамики АФК. Причем АФК отдельно оценивались у пациентов, принимавших комплексную терапию и монотерапию Суперлимфом. Эти показатели крайне важны, так как определяют репродуктивный потенциал пула морфологически нормальных подвижных сперматозоидов.
За безусловную норму нами были приняты пороговые значения в 15% для показателя фрагментации ДНК сперматозоидов и 20 RLU/s для максимально допустимого значения уровня АФК.
Среднемедианные показатели уровня фрагментации ДНК сперматозоидов в 19% [14; 26] до лечения опустились до среднемедианного показателя в 15% [10,5; 19,5] у пациентов в контрольных исследованиях. Данная динамика была заметной, но не стала статистически значимым отличием (р=0,06). Однако, учитывая, что значительную часть группы составляли пациенты с варикоцеле (без оперативного лечения), эту динамику можно считать безусловно положительной.
Терапия препаратом Суперлимф позволила снизить уровень АФК с 38,5 [26; 54] до 25 [17; 42] RLU/s (рис. 5), что стало статистически значимой динамикой (р=0,0002).
Суперлимф в монотерапии достоверно понизил уровень АФК у пациентов с хроническими воспалительными процессами и идиопатическим бесплодием до нормальных значений, но никак не влиял на снижение этого показателя у пациентов с варикоцеле.
Однако при добавлении антиоксидантов некоторая положительная динамика отмечалась и у этой категории больных варикоцеле.
Поскольку оценка динамики (ROS) являлась одной из основных задач исследования, важно было оценить не только абсолютные цифры, но и тенденции по клиническим группам (рис. 6).

Обсуждение и выводы. При аэробной активности клеток активные формы кислорода играют критическую роль для апоптоза. Окислительный стресс определяется дисбалансом процессов липопериокисления с повышением продукции АФК и снижением антиоксидантной защиты [2].
Активные формы кислорода влияют на мужскую фертильность путем непосредственного влияния на ДНК [4]. Изучение роли окислительного стресса в патогенезе позволило выделить группу так называемых свободно-радикальных заболеваний, список которых достаточно репрезентативен. Клинически наиболее часто выявляют повышение уровня АФК у пациентов с хроническими воспалительными процессами и варикоцеле [3]. Приблизительно у 30% пациентов с повышенным уровнем АФК причина патоспермии не выявляется [2].
В лечебный план мужского бесплодия на фоне повышенных (повышения) уровней АФК выделяют три метода: медикаментозный, хирургический и репродуктивный.
Фармакологическая терапия заключается в стимуляции сперматогенеза. Обычно применяют антиоксиданты и гормональные препараты (хорионический гонадотропин и антиэстрогены).
Хирургическая активность показана пациентам с варикоцеле.
В лечении мужского бесплодия также применяются вспомогательные репродуктивные технологии, но необходим комплекс терапевтических мер, способствующих максимальному улучшению сперматогенеза непосредственно перед забором биологического материала мужчины в протоколе ВРТ.
Настоящее исследование было проведено для оценки возможного применения новой группы препаратов – пептидов и цитокинов – у пациентов с оксидативным стрессом. Именно повышение уровня АФК было основным критерием включения пациента в протокол. Клинически повышение уровня АФК у пациентов было обусловлено воспалительными процессами в органах репродуктивной системы (40%) и варикоцеле (23%), 37% имели идиопатическое бесплодие.
У пациентов с оксидативным стрессом на фоне варикоцеле показано проведение оперативного лечения. Но при отказе от такового для улучшения параметров (эякулята) в составе комплексного плана лечения возможно назначение препарата Суперлимф.
Заключение. Препарат Суперлимф оказывает положительное воздействие на все показатели спермиологических тестов у пациентов с нарушением репродуктивной функции на фоне оксидативного стресса. Отмечается нормализация как основных параметров (концентрация, подвижность, морфология), так и дополнительных (фрагментация ДНК сперматозоидов, АФК). При выявлении ОС на фоне варикоцеле или при идиопатическом бесплодии целесообразно рекомендовать Суперлимф в составе комплексной терапии в сочетании с антиоксидантами. Продолжительность приема Суперлимф целесообразно планировать на срок не менее 60 дней.



