Введение. Согласно прогнозам Всемирной организации здравоохранения, к 2050 г. ожидается увеличение численности населения старше 60 лет до 2 млрд человек [1]. На территории Российской Федерации средняя продолжительности жизни среди женщин составила 75 лет, среди мужчин – 63 года [2]. Большинство эпизодов почечно-клеточного рака (ПКР) диагностируется у пациентов в возрасте от 60 до 70 лет [3]. По мере старения населения и широкого распространения визуализирующих методов диагностики частота выявления случайного ПКР среди пожилых людей ежегодно растет. Несмотря на то что органосохраняющие методики являются стандартом лечения локализованного ПКР, потенциальный риск периоперационных осложнений и частота повторных госпитализаций выше среди пожилых пациентов.
Цель исследования: сравнение основных периоперационных показателей и ранних функциональных результатов пациентов старшей возрастной группы и пациентов среднего возраста с локализованной формой ПКР.
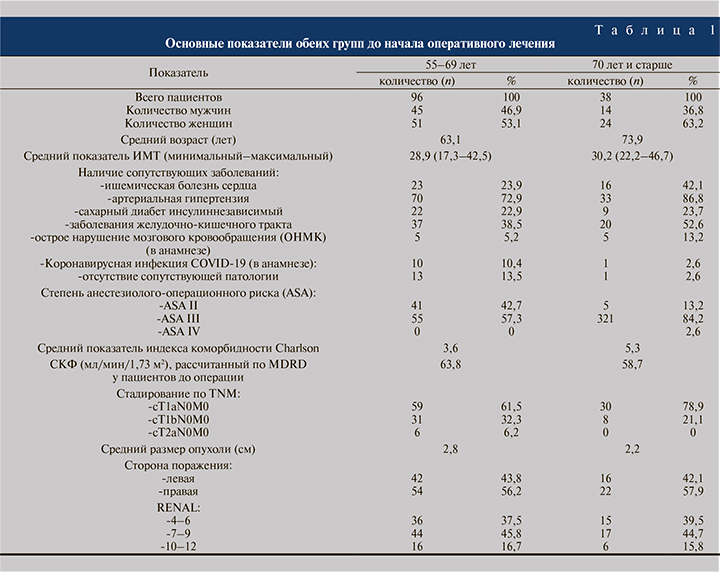
Материалы и методы. В исследуемую группу были включены пациенты с диагностированным ПКР, которым с 2016 по август 2021 г. в урологической клинике ФГАОУ ВО РНИМУ им. Н. И. Пирогова на базе ГКБ № 1 им Н. И. Пирогова выполнена лапароскопическая резекция почки (РП). Критерии включения: локализованный ПКР, размер опухоли ≤10 см (клиническая стадия cT1aN0M0, cT1bN0M0 и cT2aN0M0). Из окончательной аналитической когорты были исключены пациенты с недостаточными данными касательно предоперационной характеристики опухоли. В исследование были включены 134 пациента. В зависимости от возраста на момент выполнения оперативного вмешательства пациенты разделены на две группы: от 55 до 69 лет – 96 (71,6%), и 70 лет и старше – 38 (28,4%). На догоспитальном этапе всем больным выполнена мультиспиральная компьютерная томография (МСКТ) с внутривенным введением контрастного препарата, с последующим стадированием по классификации TNM и оценкой степени сложности РП по шкале RENAL. Также проведены оценка физического статуса по классификации ASA (American Society of Anesthesiologists) и расчет индекса коморбидности (ИК) Charlson. Скорость клубочковой фильтрации (СКФ) оценивалась по формуле MDRD (Modification of diet in renal disease). Подробные сравнительные характеристики групп представлены в табл. 1.
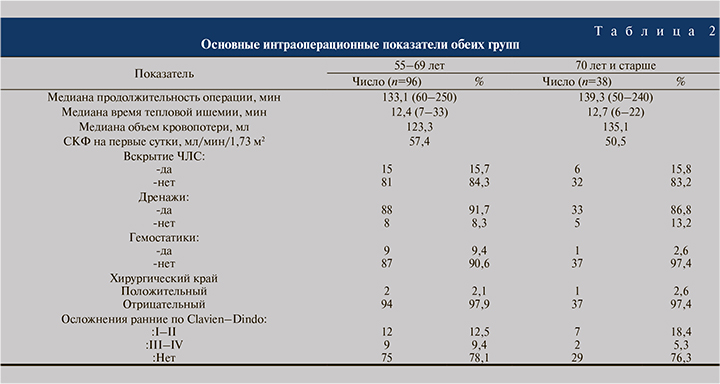
Статистическая обработка данных выполнена на индивидуальном компьютере с помощью электронных таблиц Microsoft Excel и пакета программы «Prism 8 for Windows» (GraphPad Software, Inc). Все полученные анамнестические, клинические, лабораторные и инструментальные результаты вносились в базу данных Microsoft Excel, разработанную автором, и обработаны методом вариационной статистики. Для каждого количественного параметра определены среднее значение (М), среднеквадратическое отклонение (δ), ошибка среднего (m), медиана (Ме), 95% доверительный интервал, для качественных данных — частоты (%). Для сравнения числовых данных (после проверки количественных данных на нормальное распределение) использован t-критерий Стъюдента. Для сравнения непараметрических данных применяли попарное сравнение и осуществляли с помощью критерия Манна–Уитни (для двух групп) для несвязанных совокупностей. Статистически значимыми считались различия при p<0,05 (95%-й уровень значимости). Результаты. Медиана продолжительности операции пациентам в возрасте от 55 до 69 лет составила 133,1 (60–250) мин, среди пациентов 70 лет и старше – 139,3 (50–240) мин. Медиана времени тепловой ишемии составила в I и II группах 12,4 (7–33) и 12,7 (6–22) мин, показатель медианы объема кровопотери – 123,3 и 135,1 мл соответственно. Вскрытие чашечно-лоханочной системы с последующим ушиванием выполнено 15 (15,7%) пациентам в возрасте 55–69 лет и 6 (15,8%) пациентам 70 лет и старше.
С целью оценки ранних и поздних послеоперационных осложнений применена шкала Clavien–Dindo. В I группе осложнения наблюдались в 21 (21,9%) случае, во II – в 9 (23,7%). Осложнения Clavien I–II в группе пациентов 55–69 лет были в 12,5%, в группе пациентов 70 лет и старше в 18,4% случаев, осложнения Clavien III–IV наблюдались в 9 (9,4%) и 2 (5,3%) случаях соответственно.
Проведение гемотрансфузии в послеоперационном периоде было необходимо 3 (3,1%) пациентам 55–69 лет. Суперселективная эмболизация ветвей почечной артерии выполнена только 2 (2,1%) пациентам группы 55–69 лет. В 2 (2,1%) случаях в I группе и в 1 (2,6%) –во II выполнена нефрэктомия в связи с развившимся кровотечением.
Медиана СКФ в послеоперационном периоде, рассчитанная по формуле MDRD, для I группы составила 57,4, для II – 50,5 мл/мин/1,73 м2. Снижение СКФ в I и II группах составило 5,1 и 6,9% соответственно.
Медиана времени наблюдения составила 26 (4–66) мес. Функциональные и онкологические результаты были доступны для оценки 39 (40,6%) пациентов 55–69 лет и для 18 (47,4%) 70 лет и старше. По данным ультразвукового исследования, изменения отсутствовали в 31 (79,5%) случае в I группе и в 14 (77,7%) – во II. Кистозный компонент в зоне резекции отмечен в 3 (7,7%) и 2 (11,1%) наблюдениях соответственно, обеднение сосудистого рисунка при цветовом доплеровском картировании – в 2 (5,1%) и 1 (5,6%) случаях соответственно. Ежегодно выполняли МСКТ с внутривенным контрастированием 30 пациентам в возрасте 55–69 лет и 14 пациентам 70 лет и старше. Заключение по данным МСКТ после резекции почки расценивалось как отсутствие особенностей и наблюдалось в 26 и 10 случаях; кисты в зоне резекции присутствовали в 4 и в 2 случаях соответственно. Данные ежегодной динамической нефросцинтиграфии доступны в отношении 15 пациентов I и 11 – II групп. Снижение перфузии и количества функционирующей паренхимы >15% наблюдалось в 1 и в 3 случаях соответственно.
Через 1 год после оперативного вмешательства СКФ, рассчитанная по формуле MDRD, в группе пациентов 55–69 лет составила 60,9, в группе пациентов 70 лет и старше – 54,1 мл/мин./1,73 м2.
Число госпитализаций пациентов I и II групп за время наблюдения было следующее: терапевтическое отделение – в 2,1 и 7,9%, хирургическое – в 0 и 10,5%, урологическое – в 1 и 5,3%, нефрологическое – в 0 и 2,6% и травматологическое – 2,1 и 2,6% случаев соответственно.
Согласно патоморфологическому заключению, отрицательный хирургический край наблюдался в 97,9% среди пациентов 55–69 лет и в 97,4% среди пациентов 70 лет и старше. Положительный хирургический край был зафиксирован в 2 (2,1%) и 1 (2,6%) случаях соответственно. Светлоклеточный вариант ПКР отмечен в 83 (86,4%) случаях в I группе и в 29 (76,3%) во II. Хромофобный вариант ПКР наблюдался у 7 (7,3%) и 1 (2,6%) пациентов, папиллярный у 4 (4,2%) и 8 (21,1%), другой тип ПКР в 2 (2,1%) и 0 случаях соответственно. Среди пациентов 55–69 лет у двоих зафиксирован местный рецидив, у одного – прогрессирование заболевания, тогда как среди пациентов 70 лет и старше случаев местного рецидива и прогрессирования зафиксировано не было, включая пациентов с пололожительным хирургическим краем.
Годовая онкоспецифическая выживаемость в обеих группах составила 100%, общая в I группе – 97,9%, во II – 97,4%. Подробные сравнительные характеристики групп представлены в табл. 2.
Обсуждение. На территории Российской Федерации (РФ) ежегодно регистрируется около 25 тыс. новых случаев рака почки, а при оценке повозрастных показателей между жителями РФ и США до наступления 70 лет различия отсутствуют, однако далее отмечается увеличения заболеваемости среди жителей США [4].
В связи с широким распространением визуализирующих методов диагностики опухоли почки обнаруживаются чаще в стадии Т1а [5, 6]. Несмотря на то что лапароскопическая РП является стандартом лечения локализованного ПКР в стадии Т1, данное оперативное вмешательство несет риски послеоперационных осложнений и повторной госпитализации, особенно для ослабленных пациентов [7, 8]. Для пожилых пациентов выбор оптимальной тактики лечения может превратиться в сложную дилемму. Наличие сердечно-сосудистых, неврологических, легочных заболеваний, прием антикоагулянтов и нефротоксических препаратов, снижение физического статуса пациента увеличивают риск проведения оперативного лечения по сравнению с естественным течением заболевания [9–13]. На примере нашего исследования сопутствующие заболевания в группе пациентов 55–69 лет наблюдались в 86,5% случаев, тогда как среди пациентов 70 лет и старше – в 97,4%.
Выжидательная тактика является подходящей стратегией для пожилых пациентов с декомпенсированными сопутствующими заболеваниями, выполнение оперативного лечения которым не рассматривалось [14]. A. Kutikov et al. предложили использовать номограмму конкурирующих рисков, тогда как R. Abouassaly et al. выявили средний возрастной порог в 74 года для пациентов, подходивших под активное наблюдение [15, 16]. Однако группа авторов во главе с S. P. Hillyer выполняли робот-ассистированную РП пациентам, где средний возраст составил 74,5 года. Полученные перии послеоперационные осложнения статистически не отличались от таковых в группе пациентов молодого возраста [17]. В работах отечественных авторов за 2020–2021 гг., касательно органосохраняющего лечения средний возраст составил в работах В. Б. Матвеева и соавт. 53,7 (22–79) года, в исследовании С. А. Ракул и соавт. – 61,48 (53–67) [18, 19]. В нашей работе средний возраст пациентов был несколько выше: в I группе он составил 63,1 во II – 73,9 года.
ИК Charlson является популярным критерием оценки возраста и наличия определенных сопутствующих заболеваний. Средний возраст в работе A. Becker et al. составил 74 года, а ИК – 2,1 [20]. Среди пациентов 55–69 лет ИК – 3,6, а среди пациентов 70 лет и старше – 5,6. Значение индекса в нашем исследовании существенно выше –даже среди пациентов средней возрастной группы.
Оценка физического статуса по шкале ASA применяется для расчета риска для каждого конкретного пациента. Среди пациентов 70 лет и старше сумма баллов по шкале ASA-III–IV наблюдалась в 58% случаев, средний размер опухоли составил 2,7 см, наиболее распространенная стадия по классификации TNM-T1a в 71,4% [17]. Согласно нашим сопоставленным данным, среди пациентов 70 лет и старше ASA-III–IV – 86,8%, опухолевый размер – 2,2 см, стадия Т1а, наблюдалась в 78,9%.
Что же касается опасений по поводу осложнений в послеоперационном периоде, внедрение «минимальной инвазивной» органосохраняющей методики лечения ПКР позволило обеспечить более быстрое восстановление пациентов [21]. Вопросу безопасности лапароскопической РП посвящены работы T. Deklaj et al. и A. A. Thomas et al., которые подтвердили тезис о безопасности для тщательно отобранной группы пожилых пациентов [22, 23]. Действительно, в представленной работе осложнения в группе пациентов >70 и <70 лет и старше существенно не различались и составили 21,9 и 23,7% соответственно.
В исследовании S. P. Hillyer et al. послеоперационный койко-день был вдвое выше среди пациентов старшей возрастной группы [17], в нашем исследовании такая закономерность не прослеживается, и в I и II группах койко-день составил 7,6 и 8,1 соответственно. Еще в 1996 г. A. Bufalari et al. отметили, что наличие суммы баллов по шкале ASA II–V и двух сопутствующих заболеваний служит независимым фактором риска послеоперационных осложнений и смертности [24]. Следует отметить, что помимо возраста пациента следует ориентироваться не только на наличие сопутствующих заболеваний, но и на степень их компенсации.
Заключение. Органосохраняющее лечение является безопасным вариантом для пациентов 70 лет и старше, а основные интраоперационные и онкологические результаты сопоставимы с таковыми группы пациентов среднего возраста. Сам по себе возраст не является противопоказанием к оперативному лечению. Выполнение лапароскопической РП пациентам старшей возрастной группы сопряжено с увеличением числа осложнений, требующих консервативного метода лечения, и частотой последующих госпитализаций, связанных с сопутствующими заболеваниями.



