Введение. В настоящее время в мире рак почки занимает 3-е место среди злокачественных опухолей мочеполовой системы после новообразований простаты и мочевого пузыря [1, 2]. По данным [3], в 2017 г. было диагностировано около 279 тыс. случаев почечно-клеточного рака. За последние десятилетия заметно улучшилась диагностическая служба на уровне поликлиник и диагностических центров, что в значимой мере поспособствовало увеличению частоты выявления опухолевого образования почечной паренхимы на той стадии, когда еще возможно выполнение органосохраняющего пособия [4, 5]. В клинической практике при планировании оперативного пособия во всем мире используются общепринятые нефрометрические шкалы R.E.N.A.L, PADUA и C-index [6, 7]. Эти шкалы позволяют оценить глубину расположения опухолевого узла, его локализацию относительно синуса и полостной системы почки. Независимо от доступа (лапароскопический или открытый) резекция почки по поводу опухоли включает идентичные этапы, включающие мобилизацию почки и ее сосудов, резекцию опухоли в пределах здоровой ткани в условиях тепловой ишемии, окончательный гемостаз в зоне операции [8–10].
На сегодняшний день широко используются разные методики ишемии почки на этапе резекции. Наиболее распространенная среди них – пережатие основного почечного сосуда, обусловливающее тотальную ишемию почечной паренхимы. При этом обеспечивается адекватное «сухое операционное поле» в зоне резекции, что позволяет хорошо визуализировать край опухоли и выполнять адекватный окончательный гемостаз. Подобного рода ишемия почечной паренхимы может приводить к значительному снижению функции органа [11–13]. В погоне за минимизацией времени тепловой ишемии разработана модификация раннего снятия сосудистого зажима с предшествовавшим наложением первого ряда швов на дефект паренхимы. При технической возможности и наличии сегментарной сосудистой архитектоники выполняется селективное пережатие почечного кровотока с целью снижения отрицательного влияния на функциональное состояние почечной паренхимы [14, 15]. В настоящее время получает все большее распространение методика лапароскопической резекции почки в условиях нулевой ишемии, что в свою очередь полностью исключает ишемическое воздействие на почечную паренхиму. Наряду с вышеуказанным все чаще в научной литературе можно встретить сообщение об использовании трехмерного компьютерного построения и создании на его основе трехмерной модели органа, что несомненно является положительной тенденцией на пути улучшения результатов лечения больных опухолевыми новообразованиями почек.
Цель исследования: оценка и сравнительный анализ методик энуклеации и энуклеорезекции опухолевого узла, а также классической резекции почки в условиях нулевой ишемии почечной паренхимы; определение роли трехмерного построения патологического процесса на этапе планирования оперативного лечения.
Материалы и методы. В клинике урологии Первого МГМУ им. И. М. Сеченова в период с января 2015 по июль 2018 г. одним хирургом выполнено свыше 200 ЛРП по поводу опухолевого новообразования почечной паренхимы. Нами проведен ретроспективный анализ историй болезни и видеозаписей операций. В настоящее исследование отобраны 83 пациента, у которых этап резекции почки проходил в условиях нулевой ишемии. Среди прооперированных было 48 (57,8%) мужчин и 35 (42,2%) женщин. Средний возраст пациентов составил 56,8±11,9 года.
Выделено три группы пациентов. Первая включила 41 пациента, которому выполнена энуклеация опухолевого узла, вторая – 31 пациента, перенесшего энуклеорезекцию, третья группа – 11 человек, которым проведена классическая резекция в пределах здоровой ткани (0,5–1,0 см). Выбор способа резекции определялся предпочтением хирурга, характеристиками опухолевого узла, результатом нефрометрической шкалы и 3D-моделирования патологического процесса.
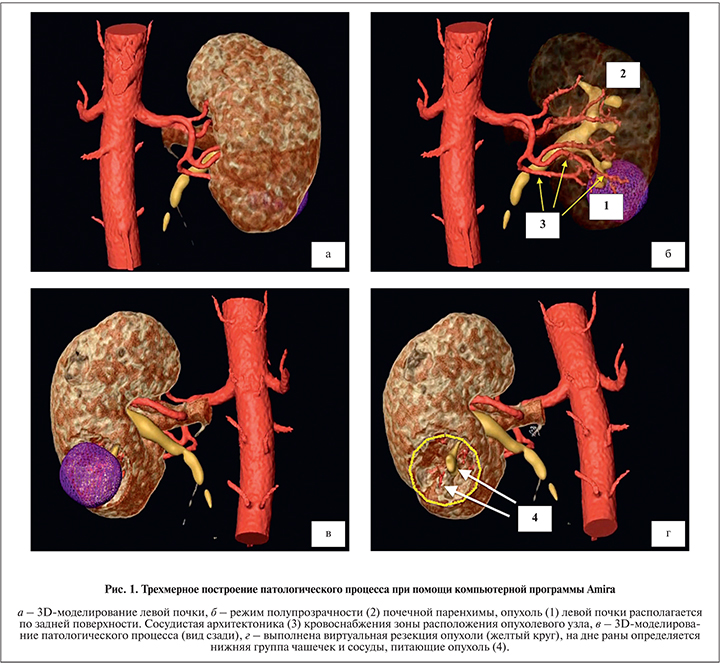
В качестве нефрометрического прогноза использована шкала R.E.N.A.L., в соответствии с которой выделяют высокий (10–12 баллов), умеренный (7–9) и низкий (4–6) риски. При планировании оперативного пособия практически всем пациентам выполнено 3D-моделирование патологического процесса на основании данных КТ органов брюшной полости с контрастированием. Построение патологического процесса в период планирования оперативного пособия выполнялось при помощи компьютерной программы Amira. Показатели, оцениваемые на 3D-изображении: близость опухолевого узла к чашечно-лоханочной системе (ЧЛС; 0–3, 3,1–6 и 6–10 мм) и сосудам 2-го и 3-го порядков (0–3, 3,1–6 и 6–10 мм); структуры дна раневой поверхности в результате виртуальной резекции почки (паренхима, ЧЛС, сосуды, ЧЛС+сосуды); количество сосудов, питающих опухолевое образование (0, 1, 2 и 3; табл. 1, рис. 1). На основании полученных данных всем пациентам установлен клинический диагноз в соответствии с Международной классификацией злокачественных новообразований ТNM.

Основные характеристики опухолевого узла, а также результаты оценки по шкале R.E.N.A.L отображены в табл. 2.
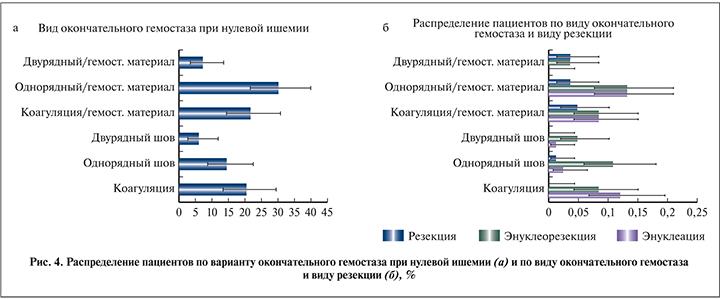
 Эндовидеохирургические этапы выполнялись с использованием 3 портов, в редких случаях устанавливали 4-й ассистентский порт. При помощи биполярного диссектора и ультразвукового скальпеля механически выделяли сосудистую ножку, при необходимости на сосуды накладывали турникеты. При дополнительной помощи аспиратора, функционирующего на низкой аспирационной тяге, выполняли этапы энуклеации опухолевого узла в условиях достаточной видимости и «сухого операционного поля» (рис. 2). Вспомогательным инструментом на пути к достижению адекватной видимости служило подкладывание гемостатического материала на зону резекции (рис. 3) в ситуациях, когда источник кровотечения достоверно не был найден и возникала угроза конверсии (пережатие почечного кровотока). Среди способов окончательного гемостаза (рис. 4), оцениваемых в нашей работе, были как бесшовный вариант (коагуляция с подкладыванием гемостатического материала и без), так и вариант с наложением однорядного и двурядного швов (с подкладыванием гемостатического материала и без).
Эндовидеохирургические этапы выполнялись с использованием 3 портов, в редких случаях устанавливали 4-й ассистентский порт. При помощи биполярного диссектора и ультразвукового скальпеля механически выделяли сосудистую ножку, при необходимости на сосуды накладывали турникеты. При дополнительной помощи аспиратора, функционирующего на низкой аспирационной тяге, выполняли этапы энуклеации опухолевого узла в условиях достаточной видимости и «сухого операционного поля» (рис. 2). Вспомогательным инструментом на пути к достижению адекватной видимости служило подкладывание гемостатического материала на зону резекции (рис. 3) в ситуациях, когда источник кровотечения достоверно не был найден и возникала угроза конверсии (пережатие почечного кровотока). Среди способов окончательного гемостаза (рис. 4), оцениваемых в нашей работе, были как бесшовный вариант (коагуляция с подкладыванием гемостатического материала и без), так и вариант с наложением однорядного и двурядного швов (с подкладыванием гемостатического материала и без).
Среди показателей эффективности оперативного лечения оценивали длительность операции, объем кровопотери, а также количество нарушений целостности ЧЛС и пути ее восстановления. Параметры, оцениваемые при гистологическом исследовании: тип опухоли, градация по Фурману и статус хирургического края.
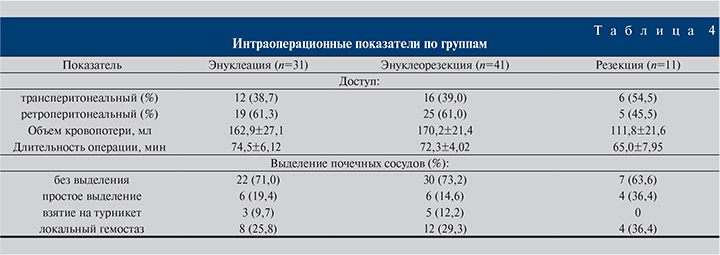
Результаты. В большинстве случаев опухолевый процесс соответствовал стадии Т1а (табл. 3). 3D-моделирование патологического процесса выполнено в 79 (95,2%) наблюдениях. Трансперитонеальный доступ использован в 34 (41%) случаях, ретроперитонеальный – в 49 (59%). Общие интраоперационные параметры (доступ, объем кровопотери, длительность операции и т.д.) по группам отображены в табл. 4.
У 23 (27,7%) пациентов с интрасинусным расположением опухоли констатировали наибольший объем кровопотери (205,7±29,1 мл) по группам, в то время как при экзофитном и эндофитном характере роста кровопотеря составила 142,3±15,2 и 208,2±35,9 мл соответственно (р=0,005).
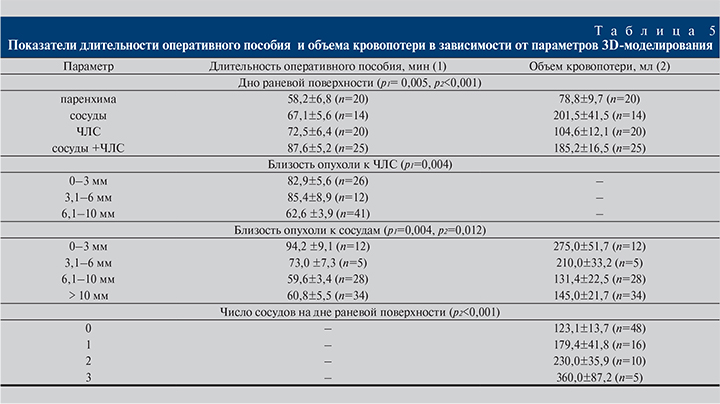
При использовании 3D-моделирования на этапе планирования оперативного пособия выполняли виртуальное удаление опухолевого узла, что позволяло дать первичную оценку структурам, располагающимся на дне раневой поверхности. Продолжительность оперативного пособия оказалась статистически значимо меньше (р=0,005) в случае, если дно раневой поверхности представлено только паренхимой (58,3±6,8 мин), по сравнению со случаями «ЧЛС+сосуды», где продолжительность операции составила 87,6±5,2 мин. Аналогичные результаты (табл. 5) получены в отношении большей длительности операции в зависимости от близости расположения опухолевого узла к ЧЛС и сосудам (р=0,004).
Методика локального гемостаза с подкладыванием гемостатического материала применялась в 24 (28,9%) случаях и достоверно не продемонстрировала значимой роли в минимизации объема кровопотери (235,4±36,4 мл), однако, принимая в расчет тот факт, что использовалась методика исключительно в случаях повышенной интенсивности кровопотери, и с целью достижения адекватной видимости полученные результаты закономерны (р<0,001).
В нашей работе основное внимание было уделено определению зависимости объема кровопотери от количества сосудов, питающих опухолевое образование, на дне раневой поверхности, по результатам виртуальной резекции. Больший объем кровопотери (р<0,001) наблюдался нами в случаях большего числа выявленных сосудов. Так, при наличии одного сосуда объем составил 179,4±41,8 мл, в то время как при наличии трех сосудов – 360,0±87,2 мл (см. табл. 5).
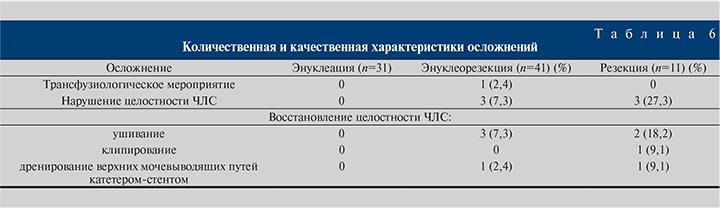
В плане осложнений (табл. 6) мы не наблюдали случаев, потребовавших пережатия почечного кровотока, перехода в открытое оперативное пособие и выполнение нефрэктомии. В одном случае в группе энуклеорезекции почки возникла необходимость в трансфузиологическом мероприятии ввиду значимого снижения уровня гемоглобина. Продолжающегося кровотечения, требующего повторного оперативного пособия или эмболизации артериальных сосудов, также не было. Чашечно-лоханочная система в группе энуклеации опухолевого узла оказалась интактной на всей площади выполнения манипуляции, в то время как в группе энуклеорезекции (n=3) и в группе резекции (n=3) имело место вскрытие чашечки. Во всех случаях нарушения целостности ЧЛС выполнено ушивание дефекта, в одном случае – клипирование. Дренирование верхних мочевых путей катетером-стентом проведено с профилактической целью в первые часы после операции, что в свою очередь, вероятнее всего, позволило избежать такого грозного осложнения, как мочевой затек.
Положительный хирургический край не диагностирован ни в одном из клинических наблюдений. При гистологическом исследовании рак выявлен в 76 (91,6%) случаях, из них светлоклеточный вариант – в 72 (94,7%). Среди доброкачественных новообразований ангиомиолипома имела место в 5 (71,4%) случаях. Данных за рецидивирование онкологического процесса на сроках наблюдения 3, 6, 12 и 18 мес. не получено.
Обсуждение. Наши результаты показывают, что даже опытные урологи могут потенциально извлекать выгоду из трехмерных моделей при планирования сложных операций.
В частности, моделирование потенциально могло бы способствовать ОСП и сохранению здоровой паренхимы, поскольку лучше понимается размер и расположение опухоли по отношению к нормальной ткани и жизненно важным структурам, таким как артерии и вены. Режим полупрозрачности почечной паренхимы при трехмерном построении позволяет легко визуализировать местоположение и размер опухоли, а также взаимосвязь опухоли с основными анатомическими структурами, такими как почечные сосуды и ЧЛС.
Решения, принимаемые на предоперационном этапе, включали выбор вида резекции (энуклеация, энуклеорезекция или резекция), выбор вида окончательного гемостаза, а также оценку необходимости использования дополнительного дренирования ЧЛС при нарушении ее целостности. Таким образом, в ситуациях, когда на дне раневой поверхности определялось наличие сосудистых структур, предпочтительным было выполнение простой энуклеации, в то время как проведение резекции могло привести к большему кровотечению. Близость сосудов второго и третьего порядков к опухолевому узлу при сравнении групп продемонстрировала достоверно значимую разницу в отношении объема кровопотери и длительности оперативного пособия. Все случаи вскрытия ЧЛС встречались при интимном прилегании опухоли к ЧЛС, в тех же случаях и понадобилось дополнительное дренирование верхних мочевыводящих путей катетером-стентом с целью предупреждения возникновения мочевого затека.
Используя полученные данные, можно избежать метода «проб и ошибок» в ходе оперативного пособия за счет того, что наглядно продемонстрирована взаимосвязь длительности операции, объема кровопотери по исследуемым группам в зависимости от данных 3D-моделирования.
У нашего исследования было несколько ограничений. Несмотря на статистически значимые результаты, выборка ограничена небольшим числом пациентов. Кроме того, поскольку это была ретроспективная оценка, мы не смогли определить из оперативных отчетов, был ли хирургический план изменен хирургом во время процедуры. Кроме того, невозможно было оценить влияние трехмерного моделирования на понимание пациентами их заболевания и плана лечения или на сохранение функции почек. Целью дальнейшей работы является повышение разрешения трехмерных моделей для более четкого определения близости опухоли к сосудистой сети и определения возможности выполнения интрапаренхиматозного клипирования.
Несмотря на сопоставимые общие клинические параметры и характеристики опухолевого узла в исследуемых группах, стоит отметить, что оптимальным методом выполнения оперативного пособия, позволяющим работать вблизи почечного синуса, является энуклеация. Метод продемонстрировал меньшую потребность в наложении швов, при этом ограничиваясь коагуляцией с использованием гемостатического материала и без. Продемонстрирована также меньшая частота кровотечений в послеоперационном периоде, что несомненно служит очевидным преимуществом при планировании оперативного пособия.



