Введение. Хронический рецидивирующий бактериальный простатит (ХРБП) представляет собой актуальную проблему современной урологии и андрологии, так как затрагивает многие звенья репродуктивного здоровья мужчин. ХБП является ведущей нозологией в структуре заболеваний мужской репродуктивной системы, не представляющий угрозы для жизни пациента, однако существенно ухудшающий ее качество среди мужской популяции, поскольку отрицательно влияет на семейные взаимоотношения, работоспособность и т.д. [1–3].
Ведущей причиной развития простатита долгие годы считалось наличие инфекционного агента в секрете предстательной железы (СПЖ), выявляемого бактериологическими методами исследования. Однако наличие микроорганизмов в СПЖ в любой степени контаминации является недостаточным условием для возникновения воспалительного процесса в предстательной железе. В настоящее время доказано, что биологические среды мочевыводящих путей и репродуктивных органов не стерильны. Для развития ХБП необходимо наличие тех или иных дополнительных факторов, которые определяют характер клинических проявлений, тяжесть течения и частоту рецидивирования заболевания [4–6].
В связи с этим на современном этапе изучения вопросов этиологии, патогенеза и диагностики простатита любого генеза патофизиология ХБП признается многогранной, несмотря на то что постулируются некоторые доминирующие механизмы воздействия, такие как инфекционные, аутоиммунные, неврологические, эндокринные и психологические факторы [8–].
Как известно, предстательная железа – многофункциональный орган мужской репродуктивной системы, при дисфункции которой запускается ряд метаболических процессов, генерирующих патологические состояния не только непосредственно в простате, но и в репродуктивной системе в целом [11–13].
Кроме того, это иммунокомпетентный орган, в котором содержатся различные иммуноактивные клетки: лимфоциты, макрофаги, тучные клетки, дисфункция которых служит одним из патогенетических механизмов развития инфекционно-воспалительного процесса в предстательной железе [14, 15].
Нарушения местного иммунитета пациентов с ХБП – одна из важных причин рецидива заболевания и отсутствия эффективности проводимой антибактериальной работы. Патологию фагоцитоза и цитокиногенеза в СПЖ мужчин с инфекционно-воспалительными процессами в ПЖ приводит к хронизации заболевания и возникновению ряда осложнений со стороны мочевыводящих путей и репродуктивных органов [14, 16, 17]. Кроме того, иммунологические особенности местного иммунитета играют ключевую роль в препятствии персистенции микроорганизмов [15, 18].
Дисфункция иммунной системы способствует в свою очередь изменению цитокинового профиля и формированию аутоиммунных процессов, что является также хорошей платформой хронизации инфекционно-воспалительного процесса в простате. Постоянное воздействие факторов патогенности микроорганизмов приводит к срыву защитных реакций, а соответственно, и к декомпенсации, и к нарушению функции предстательной железы [14].
Поэтому, несмотря на использование современных методов диагностики и строгое соблюдение стандартов обследования и лечения пациентов с ХБП, рекомендованных European Association of Urology (EAU) и Российским обществом урологов (РОУ), процент рецидива заболевания остается высоким, в связи с чем в настоящее время, особенно в эру антибиотикорезистентности, не вызывает сомнений необходимость применения специфических методов диагностики, позволяющих выявлять все звенья патогенеза.
Цель: изучить иммунологические особенности секрета простаты пациентов с ХРБП методом электронной микроскопии.
Материалы и методы. Проведен анализ морфометрического исследования нейтрофилов в СПЖ 90 пациентов с ХБП, разделенных на две группы. I (исследуемая) группа (n=51) с хроническим рецидивирующим бактериальным простатитом (ХРБП) и II (контрольная) (n=39) с хроническим первично диагностированным бактериальным простатитом (ХПДБП).
Для электронной микроскопии СПЖ фиксацию материала проводили в 2,5%-ном растворе глутарового альдегида (AppliChem, Германия) в 0,1 М фосфатном буфере (рН=7,2–7,4) в соотношении материал–фиксатор 1:20 в течение 2 ч при 4°С. После фиксации материал в объеме 1 мл помещали в пробирки и центрифугировали при 600 g в течение 10 мин, надосадочную жидкость удаляли, а осадок однократно отмывали в 0,1 М фосфатном буфере (рН 7,2–7,4) путем ресупендирования. После повторного центрифугирования проводили постфиксацию и контрастирование осадка 1%-ным раствором тетраоксида осмия (OsO4) (Acros Organics, Бельгия) в 0,1 М фосфатном буфере (рН=7,2–7,4) в течение 2 ч. Затем осадок обезвоживали в растворах этанола восходящей концентрации (50°, 60°, 70°, 80°, 96°, абсолютный этанол) по 20 мин при 4°С. Готовили эпоксидную смолу следующего состава: 1,12 г EponTM 812 (Sigma-Aldrich, США), 0,6 г DDSA (Sigma-Aldrich, США), 0,65 г MNA (Sigma-Aldrich, США), 0,05 мл DPM-30 (Sigma-Aldrich, США). Данной смолой производили пропитывание образцов (смесь смолы и ацетона 1:3 – 2 ч, смесь смолы и ацетона 1:1 – 12 ч, смесь смолы и ацетона 3:1 – 2 ч, чистая смола – 2 ч) и последующую заливку в капсулы BEEM 1001B (Structure Probe, Inc., США). Полимеризацию смолы проводили в термостате при 28°С в течение 24 ч, затем при 60°С в течение 48 ч. Из полученных блоков с образцами при помощи ультратома LKB-III 8800 (LKB Bromma, Швеция) изготавливали ультратонкие срезы толщиной 60–70 нм, которые монтировали на медные сеточки (Structure Probe, Inc., США) и контрастировали в 0,3%-ном водном растворе цитрата свинца (Sigma-Aldrich, США) с добавлением 0,01 М раствора гидроксида натрия.
После высушивания образцы исследовали методом ТЭМ в трансмиссионном электронном микроскопе JEM-1011 (Jeol, Япония) при ускоряющем напряжении 80 кВ. Изображения получали при помощи CCD-камеры Olympus-SIS Veleta Olympus Soft Imaging Solutions GmbH, Германия, с применением программного обеспечения Olympus iTEM TEM Imaging Platform (Olympus Soft Imaging Solutions GmbH, Германия). Все представленные ТЭМ-изображения репрезентативны для массы полученных изображений. Секрет простаты исследовался у каждого пациента трижды.
Исследование одобрено Локальным независимым этическим комитетом ФГБОУ ВО «РостГМУ» МЗ РФ от 05.10.2017.
Результаты. При электронной микроскопии СПЖ у большинства пациентов I группы цитологическая картина СПЖ представлена неактивными нейтрофилами с нарушением фагоцитоза. Клетки правильной округлой формы, без псевдоподий, со светлой цитоплазмой. В большинстве случаев имеет место сочетание опустошенных гранул с отсутствием псевдоподий (рис. 1 и 2).
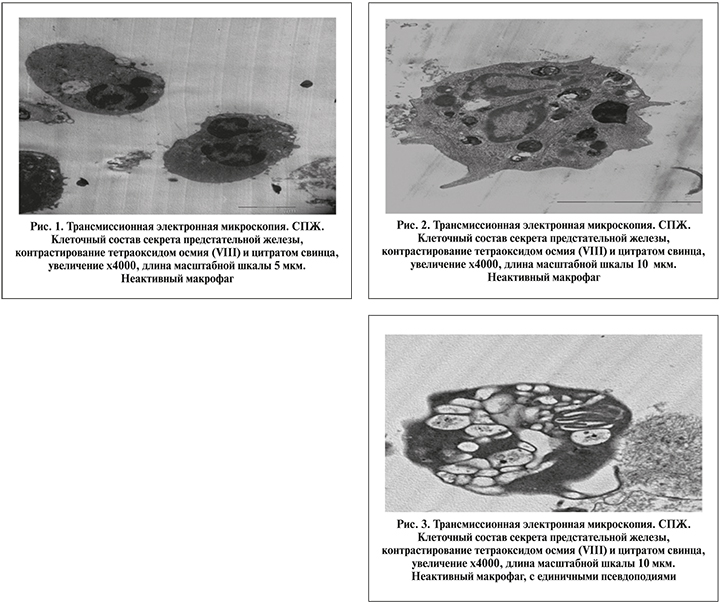
В 100% наблюдений у пациентов I группы присутствуют признаки экзоцитоза и дегрануляции нейтрофилов, отмечены нарушения процесса опсонизации микроорганизмов. Несмотря на то что в СПЖ выявлена активная миграция нейтрофилов, в основном регистрируются нейтрофилы с единичными псевдоподиями, которые не могут завершить процесс окружения и поглощения микроорганизма, хотя был активизирован процесс дезориентации микроорганизмов с выбросом активных нейтрализующих активных веществ вследствие экзоцитоза. Известно, что длительная незавершенная опсонизация способствует персистенции инфекционно-воспалительного процесса в ПЖ с возможной последующей его активацией, что клинически характеризуется рецидивом заболевания (рис. 3).
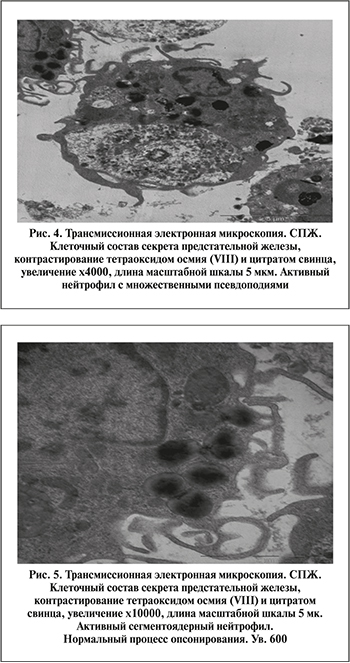 При анализе данных электронной микроскопии СПЖ у пациентов II группы отмечается наличие активных функционально нормальных нейтрофилов (лейкоцитов), характеризующихся неправильной формой, множественными псевдоподиями. У всех больных сохранен нормальный процесс опсонизации микроорганизма, где дегрануляция сочетается с наличием множества псевдоподиий, опсонирующих микроорганизмы в очаге инфекционно-воспалительного процесса ПЖ (рис. 4).
При анализе данных электронной микроскопии СПЖ у пациентов II группы отмечается наличие активных функционально нормальных нейтрофилов (лейкоцитов), характеризующихся неправильной формой, множественными псевдоподиями. У всех больных сохранен нормальный процесс опсонизации микроорганизма, где дегрануляция сочетается с наличием множества псевдоподиий, опсонирующих микроорганизмы в очаге инфекционно-воспалительного процесса ПЖ (рис. 4).
Цитологическая картина СПЖ при ХПДБП характеризуется отсутствием нарушения местного иммунитета. Регистрируется нормальный процесс фагоцитоза, где множество псевдоподий сегментоядерного нейтрофила полностью завершают процесс опсонизации микроорганизмов в зоне воспалительного процесса (рис. 5).
Анализ результатов электронной трансмиссионной микроскопии показывает, что у пациентов с ХПДБП не выявлено данных за дисфункцию местного иммунитета.
Таким образом, трансмиссионная электронная микроскопия позволяет выявлять более тонкие нарушения в лейкоцитах СПЖ, анализ которых дает возможность дифференцировать активность и тяжесть инфекционно-воспалительного процесса ПЖ.
Обсуждение. Нарушения иммунологических параметров СПЖ у пациентов с ХРБП – хорошая платформа для активации инфекционно-воспалительного процесса в простате. Полученные нами результаты электронной микроскопии доказывают, что у пациентов с ХРБП в СПЖ в большинстве случаев регистрируются неактивные нейтрофилы в сочетании с небольшим удельным весом клеток лимфоцитарного звена, в отличие от пациентов с ХПДБП, у которых в СПЖ в 100% случаев находят только активные нейтрофилы. Полученные нами результаты корреспондируют с таковыми исследований, ранее проведенных, где у пациентов с РХБП в СПЖ при микроскопическом исследовании преобладали лимфоциты [19]. Кроме того, в проведенном нами исследовании в СПЖ у пациентов с ХРБП в большинстве случаев выявлена фагоцитарная недостаточность, свидетельствующая о декомпенсации иммунной системы предстательной железы, особенно клеточных механизмов, что способствует персистенции инфекционно-воспалительного процесса, когда у пациентов с ХРБП не было отмечено нарушений фагоцитоза. Ранее в ряде проведенных исследований отмечено, что в предстательной железе как при ХРБП, так и при абактериальном простатите выявлена экспрессия HLA DR, большого количества Т-лимфоцитов с преобладанием субпопуляций CD8+ над CD4+, повышенного количества антигенпрезентирующих клеток и тканевых макрофагов, отсутствие В-лимфоцитов [20]. Эти данные свидетельствуют о том, что воспалительная реакция при хроническом простатите носит характер иммунной клеточной реакции и полученные нами результаты электронной микроскопии подчеркивают важную роль клеточного иммунитета при ХРБП.
Выводы. У пациентов с ХРБП в 100% наблюдений отмечена дисфункция иммунокомпетентных клеток ПЖ, что служит основанием для назначения иммуноактивной терапии ХРБП.
Нарушения иммунологических параметров СПЖ у пациентов с ХРБП обусловливают включение в план лечения лекарственной терапии, направленной на активацию факторов местного иммунитета.



