Введение. Хирургическое лечение гиперплазии предстательной железы (ГПЖ) характеризуется быстрорастущим числом технологий. Применение малоинвазивных методов на сегодняшний день остается рутиной урологии, а использование новых консервативных методов приводит к повышению возраста пациентов, требующих оперативного вмешательства. Использование лазерных технологий при оперативном лечении аденомы простаты – безопасный метод, а среднее время энуклеации при использовании гольмиевого лазера около 0,28 мин/гр позволяет его использовать при любых объемах аденомы [1]. Общее количество ранних послеоперационных осложнений не превышает 19% и зависит как от предоперационной подготовки (прием дезагрегантов и антикоагулянтов, возраст, индекс массы тела, оценка пациента по шкале ASA, объем простаты), так и от периоперационных данных (длительность операции и катетеризации, переливание крови, гистопатологические данные, опыт хирурга) [2]. С увеличением опыта хирурга уменьшается количество пери- и послеоперационных осложнений. В среднем кривая обучения длится 25–50 процедур, и на плато исполнения хирург выходит после 60-й процедуры [3, 4].
Значимые риски осложнений традиционных операций, неудовлетворенность пожилых пациентов результатами операций, частое сохранение симптомов, которые беспокоили пациентов на дооперационном этапе, а также проблема мультифармации диктуют необходимость поиска безопасных, эффективных, малоинвазивных методов хирургического лечения гиперплазии предстательной железы [5].
Цель исследования: определить хирургические возможности гольмиевой лазерной энуклеации (ГЛЭ) простаты и число послеоперационных осложнений в период освоения методики.
Материалы и методы. Проведено рандомизированнное ретроспективное исследование применения ГЛЭ для лечения ГПЖ. С января 2018 по май 2020 г. на базе хирургического отделения клинического госпиталя «Мать и Дитя», Уфа, проведено 98 ГЛЭ простаты одним хирургом с предыдущим опытом трансуретральной хирургии. Критерии включения в группу исследования: наличие умеренных или тяжелых симптомов нижних мочевыводящих путей, объем предстательной железы >40 см3, скорость максимального потока мочи <15 мл/с, наличие остаточной мочи >50 мл. Критерии исключения: наличие активного воспалительного процесса органов мочеполовой системы, онкологического процесса органов мочевыделительной системы, перенесенного ранее хирургического вмешательства на органах мочевыделительной системы.
В случае подозрения на онкологический процесс перед хирургическим лечением проводилась мультифокальная биопсия простаты за 4 недели до ГЛЭ. Оперативное лечение проводилось с помощью гольмиевого лазера Lumenis 100H (Israel) с использованием оптики 12 градусов, торцевого фиброволокна толщиной 550 нм. Для проведения энуклеации использовали силу тока 1,4 Дж с частотой 53 Гц, а в режиме коагуляции сила тока была 1,4 Дж с частотой 40 Гц. Морцелляцию ткани проводили с помощью морцеллятора Unidrive SIII SCB и ручкой морцеллятора Drillcut-X II URO Karl Storz (Germany), нефроскопа 0 градусов в режиме 900–1200 об/мин. При большой «средней доле» простаты использовалась «трехдолевая» методика, в остальных случаях применялась «двухдолевая» методика (рис. 1, 2).
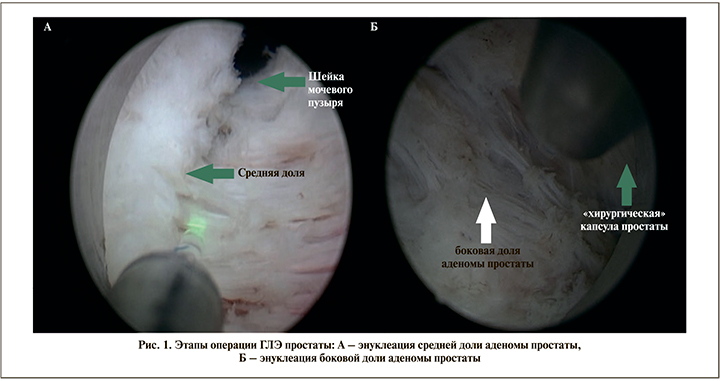
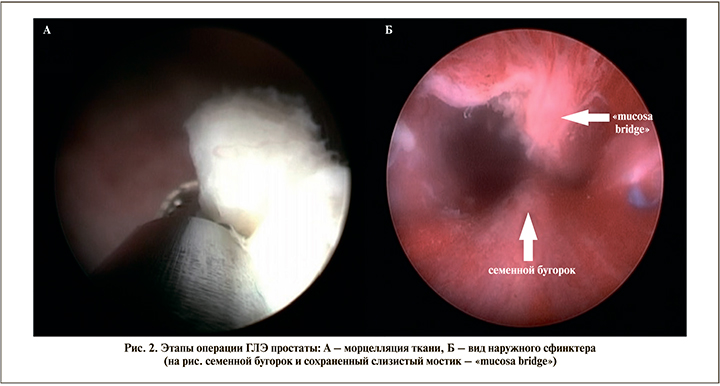
Оценивались возраст пациента, размер простаты, данные Шкалы международной оценки симптомов простаты (IPSS) и качества жизни (QoL), дневника мочеиспусканий, уровень простатоспецифического антигена (ПСА), показатели урофлоуметрии, общего времени операций, сроки дренирования мочевого пузыря уретральным катетером, осложнения по классификации Clavien–Dindo, сроки госпитализации. Проведено гистологическое исследование материала всем пациентам после операции. Статистическая обработка данных проведена с помощью прикладных программ Microsoft Office Excel, 2010, Statistica, 2010. Данные представлены в виде M+m, где M – среднее арифметическое, а m – статистическая погрешность среднего арифметического. Достоверность различий рассчитывалась при помощи дисперсного анализа с использованием T-теста для зависимых величин. Данные считались достоверными при p<0,05.
Результаты. Участвующие в исследовании пациенты получали предварительную консервативную терапию: альфа-адреноблокаторы, ингибиторы 5-альфаредуктазы. При приеме пациентами антикоагулянтов последние отменялись за 7 дней до оперативного лечения. Перед ГЛЭ простаты 26 пациентам потребовалась мультифокальная биопсия предстательной железы в связи с повышением ПСА выше 4 нг/мл или изменениями при трансректальном УЗИ, или при пальцевом ректальном исследовании. Оценивались возраст пациента, объем предстательной железы, данные шкалы международной оценки симптомов простаты (IPSS) и качества жизни (QoL), дневника мочеиспусканий, уровень простатспецифического антигена (ПСА), показатели урофлоуметрии (максимальную скорость потока мочи – Qmax), объем остаточной мочи (ООМ), общего времени операций, сроки дренирования мочевого пузыря уретральным катетером, сроки госпитализации (табл. 1).

Время операции оценивалось с момента введения резектоскопа в уретру до времени установки катетера. После оперативного лечения подключалась промывная система до утра следующего дня. Уретральный катетер удалялся после нормализации цвета мочи (до розового или желтого). При гистологическом исследовании после оперативного лечения отмечено два случая инцидентального рака предстательной железы, что составило 2,1% и потребовало дальнейшего онкологического наблюдения за данными пациентами. При оценке основных показателей выявлена достоверная зависимость между размером простаты и временем оперативного лечения (p<0,05), временем операции и сроком госпитализации (p<0,05). В нашем исследовании время операции увеличивалось в связи с интраоперационными осложнениями – перфорация мочевого пузыря, травма устья мочеточника, выраженная кровоточивость во время операции.
Общее число осложнений на госпитальном этапе составило 16 (16,3%), по шкале Clavien–Dindo выше 3b-категории в исследовании не выявлено (табл. 2).

Одиннадцать пациентов жаловались на учащенные и ургентные позывы к мочеиспусканию в первые 2 суток после удаления катетера, которые купировались самостоятельно. Данные симптомы мы отнесли к особенностям реабилитации после оперативного лечения и не рассматривали как осложнения. Наиболее грозными осложнениями стали травмы стенки мочевого пузыря (МП) и устья мочеточников (31,25 и 18,75% соответственно от общего количества осложнений, которые потребовали повторных вмешательств). Травмы устьев мочеточников были у пациентов с выраженной средней долей и в послеоперационном периоде потребовали стентирования мочеточников. Во всех случаях стентирования мочеточников с целью снижения рефлюкса мочи при мочеиспускании была пролонгация катетеризации мочевого пузыря на 3 суток. Типичных для трансуретральной резекции осложнений в виде орхэпидидимита в наших наблюдениях выявлено не было. При травме стенки МП потребовалась более длительная катетеризация, в одном наблюдении – ревизия мочевого пузыря с ушиванием раны.
Гемотампонада мочевого пузыря, как правило, была вызвана прикрытой перфорацией мочевого пузыря во время морцелляции ткани аденомы простаты или кровоточивостью из шейки мочевого пузыря. Пациенты, принимающие антикоагулянты в дооперационном периоде, имеют больший шанс получить данное осложнение. Пациенты с тампонадой мочевого пузыря (n=5) в наших наблюдениях в предоперационном периоде получали антикоагулянтную терапию (n=28) и были переведены на антикоагулянты короткого действия. Переливание свежезамороженной плазмы потребовалось в одном случае, переливания крови не потребовалось.
Обсуждение. На сегодняшний день в лечении гиперплазии предстательной железы «золотым» стандартом остается трансуретральная резекция (ТУР) при объеме ПЖ от 30 до 80 см3 [6]. Несмотря на это, методики эндоскопической энуклеации простаты, например, такие как гольмиевая энуклеация простаты (HoLEP), тулиевая энуклеация простаты (ThuLEP) и т.п., служат альтернативой не только открытой аденомэктомии, но и ТУР простаты [7, 8]. По результатам многочисленных исследований, гольмиевый, тулиевый и «зеленый» (GreenLight) лазеры показывают наилучшие результаты [9]. Во многих исследованиях гольмиевый лазер показал себя как метод, для которого характерны наименьшие показатели ре-катетеризации, задержки мочи, воспалительно-инфекционных осложнений, стрессового недержания мочи и ретроградной эякуляции [10]. Несмотря на преимущества ГЛЭ, в настоящее время методика не используется в постоянной практике. Основные причины: высокая стоимость лазерного оборудования, необходимость морцелляции, техническая сложность процедуры и длительный период обучения [11]. Считается, что необходимое количество процедур для достижения минимального опыта хирурга колеблется между 30 и 50 операциями [12]. Данные последних мета-анализов и систематизированных клинических исследований подтверждают, что все техники эндоскопической энуклеации достаточно высокоэффективны и обладают схожими интраоперационными и послеоперационными результатами [14, 15].
Необходимо учитывать, что при большой «средней доле» велика опасность травм устьев мочеточников. В связи с коагуляцией сосудов у капсулы простаты во время операции значительно снижается риск интраоперационного кровотечения. ГЛЭ простаты имеет преимущества по сравнению с другими оперативными пособиями в показателях кровопотери, катетеризации и времени госпитализации [15, 16] и рекомендована пациентам, которым невозможно отменить антикоагулянтную и дезагрегантную терапию [17]. По нашим наблюдениям, было пять пациентов с гемотампонадой мочевого пузыря, которым потребовалось отмывание сгустков. Для снижения вероятности образования резидуальной ткани необходим тщательный осмотр послеоперационной поверхности с целью гемостаза. Травмы мочевого пузыря на этапе морцелляции произошли при выполнении первых 10 операций. В связи с этим, по нашему мнению, требуется выделение данной манипуляции в отдельный этап обучения техники операции. Возможность гистологического исследования ткани после оперативного лечения – один из необходимых критериев хирургии предстательной железы. Частота инцидентального рака предстательной железы после операций на органах малого таза мужчин находится в пределах 5–14% и требует тщательной подготовки пациентов старших возрастных групп [18]. По нашим результатам, данный показатель не превысил 2%.
Заключение. Использование ГЛЭ простаты для оперативного лечения ГПЖ – достойная альтернатива ТУР простаты, достаточно безопасная операция для пациентов, принимающих антикоагулянты и дезагреганты. Предыдущий опыт трансуретральной хирургии позволяет быстрее освоить методику и снизить количество осложнений.



