Введение. Процесс канцерогенеза характеризуется нарушением иммунного ответа организма и формированием его несостоятельности за счет активации инволюции тимуса, что создает предпосылки для развития Т-клеточного иммунодефицита, а генерализацией канцерогенеза считается метастазирование опухолевых клеток в лимфатические узлы [1]. Состояние подвздошных лимфатических узлов при раке простаты – один из определяющих факторов в прогнозе заболевания [2], а диагностический скрининг микрометастазов в лимфатических узлах – одной из важных задач в стадировании рака простаты [3].
Комплексное морфологическое исследование центральных и периферических лимфоидных органов при опухоли простаты в динамике ее экспериментального развития позволит выявить особенности их структурной организации на различных стадиях канцерогенеза простаты, а это в свою очередь даст возможность оценить действие в эксперименте известных и новых противоопухолевых препаратов как на ткани опухоли, так и на лимфоидную ткань.
В связи с вышесказанным была сформулирована цель исследования – выявить структурные преобразования в тимусе и регионарных лимфатических узлах на начальных этапах формирования экспериментальной опухоли простаты.
Материалы и методы. Эксперименты проведены на 60 половозрелых самцах мышей СВА массой 28–30 г (ФГБУ «Институт цитологии и генетики» СО РАН, Новосибирск). Все эксперименты выполнены в соответствии с Правилами проведения работ с использованием экспериментальных животных, утвержденными Приказом Минздрава СССР № 577 от 12.08.1977, с соблюдением принципов гуманности, изложенных в директиве Европейского сообщества (86/609/ЕС).
Экспериментальную модель злокачественной опухоли простаты создавали путем инокуляции разведенного клеточного штамма трансплантируемой асцитной карциномы Эрлиха в паренхиму простаты после срединной лапаротомии под эфирным наркозом: путем инъекций вводили 0,2 мл асцитной жидкости, содержавшей 500–550х10³ атипичных опухолевых клеток. На 5-е сутки после инокуляции атипичных клеток в простате формируется опухолевый узел объемом 2 мм³, состоящий из полиморфных атипичных клеток [4]. Животных разделили на группы: 1) контроль (интактные животные, которым не вводили клетки опухоли) (n=20); 2) животные на 5-е сутки экспериментального роста опухоли простаты (n=20) и 3) животные на 18-е сутки экспериментального роста опухоли простаты (n=20).
Животных выводили из эксперимента в соответствующие сроки путем дислокации шейных позвонков под эфирным наркозом. Для гистологического исследования забирали простату, тимус, тазовые лимфатические узлы, зафиксированные в растворе Теллесницкого [5]. Материал заливали в парафин, на ротационном микротоме изготавливали продольные срединные срезы (толщиной 5 и 7 мкм), которые затем окрашивали гематоксилином и эозином по Майеру, азуром ΙΙ и эозином по Нохт-Максимову [6]. С помощью окулярной тестовой системы при увеличении 16, 32, 200 и 1000 методом точечного счета проводили морфометрию срезов и подсчет клеточных элементов в опухоли, структурных компонентах тимуса и тазовых лимфатических узлов. В тимусе осуществляли морфометрию коркового и мозгового вещества, соединительнотканных компонентов (капсула, трабекулы). Железистые эпителиальные образования тимуса (эпителиальные тяжи, эпителиальные канальцы) морфометрировали на тех же срезах при увеличении 200, подсчитывали все тимусные тельца (Гассаля) на срезах целого органа, а затем их количество на стандартной площади 10 мм².
Кроме того, в тимусе подсчитывали абсолютное количество клеток на стандартной площади в 2025 мкм². Дифференцировали иммунобласты, средние и малые лимфоциты, митотически делящиеся клетки, клетки с пикнотическими ядрами, эпителиоретикулярные клетки, макрофаги, моноциты, тучные клетки. Клетки тимуса подсчитывали в субкапсулярной (подкапсульной) зоне коркового вещества, в кортико-медуллярной зоне и центральной части мозгового вещества. В тазовых лимфатических узлах определяли распространенность метастазов (локализацию атипичных опухолевых клеток). В опухоли простаты определяли соотношение паренхимы и стромы, ядра и цитоплазмы атипичных клеток, а также выраженность клеточного полиморфизма. В лимфатических узлах проводили морфометрию капсулы, краевого и мозговых синусов, лимфоидных узелков, паракортикальной Т-зависимой зоны и мозговых тяжей. Рассчитывали корково-мозговой индекс – отношение площади коркового и площади мозгового вещества (индекс К/М), площадь В-зависимой зоны лимфатических узлов. Подсчитывали абсолютное количество клеток в структурных компонентах лимфатических узлов при помощи окулярной сетки площадью 2025 мкм². Выделение структурных компонентов и клеточных элементов в лимфатических узлах проводили согласно Международной гистологической номенклатуре.
Результаты эксперимента обрабатывали с использование методов вариационной статистики. Различия показателей, которые оценивали с помощью критерия Стьюдента, считали статистически значимыми при p<0,05 [7].
Результаты. На 5-е сутки после инокуляции опухолевых клеток в простате животных формировался опухолевый очаг размером 2 мм3, состоявший из полиморфных атипичных клеток. В тимусе выявлено сокращение размеров коркового вещества на 6%, увеличение площади соединительнотканных структур – на 51%, площади железистых образований – в 2 раза по сравнению с интактными животными (табл. 1).

На 5-е сутки опухолевого роста в тазовых лимфатических узлах метастазы не обнаружены. В центральной части мозгового вещества, кортикомедуллярной зоне тимуса увеличивалась численность иммунобластов, средних лимфоцитов, клеток на стадии митоза, клеток с пикнозом ядер и эпителиальных клеток на фоне сокращения числа малых лимфоцитов и макрофагов по сравнению с интактными животными.
В подкапсульной зоне тимуса на 23% было снижено количество иммунобластов по сравнению с интактными животными при увеличении числа макрофагов в 2 раза (табл. 2).
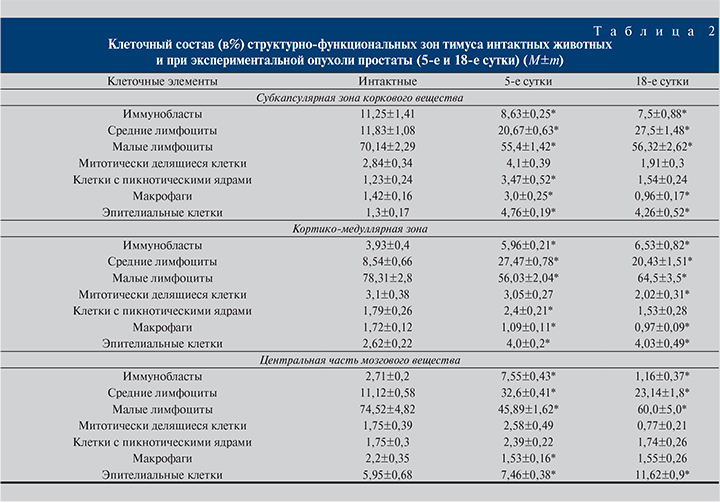
На 18-е сутки роста опухоли выявлено практически полное замещение ткани простаты атипичными полиморфными клетками (паренхима опухоли – 82,3±0,6%, строма опухоли – 17,7±0,4%). Паренхима опухоли была представлена крупными полиморфными атипичными клетками овальной, вытянутой или полигональной форм с гиперхромными ядрами; ядерно-цитоплазматический индекс клеток составил 1,66±0,08. В тимусе увеличились размеры коркового вещества на 8%, площади соединительнотканных структур – на 29%, железистых эпителиальных образований – в 2,8 раза. Наряду с этим зафиксировано уменьшение площади мозгового вещества на 16% по сравнению с таковым в группе интактных животных (см. табл. 1). Количество телец Гассаля значительно увеличилось (4,84±0,75) по сравнению с контрольными значениями (2,67±0,59), отмечен рост размеров железистых эпителиальных образований. Во всех зонах тимуса было снижено количество иммунобластов, малых лимфоцитов, клеток на стадии митоза и макрофагов на фоне увеличивавшегося количества средних лимфоцитов и эпителиоретикулярных клеток по сравнению с аналогичными значениями в группе интактных животных (см. табл. 2). Исключение составила кортикомедуллярная зона, в которой число иммунобластов возросло.
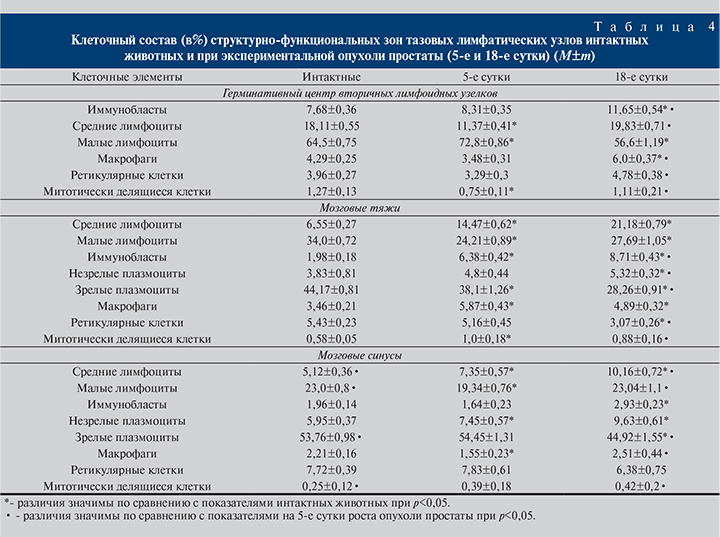
На 18-е сутки опухолевого роста в краевом и мозговом синусах тазовых лимфатических узлов выявлены метастазы опухоли – атипичные крупные клетки с выраженным полиморфизмом (ΙΙΙ стадия канцерогенеза – метастазирование). По сравнению со значениями в группе интактных животных в тазовых лимфоузлах площадь паракортикальной зоны увеличилась на 20% (табл. 3), наблюдались структурные признаки выраженной узелковой реакции (площадь вторичных лимфоидных узелков уменьшилась в 2,6 раза). Выявлено уменьшение размеров мозговых тяжей на 21,2%, В-зависимой зоны – на 35,5%. Площадь мозговых синусов в лимфатических узлах на 5-е сутки увеличилась на 9%, на 18-е сутки уменьшилась на 9%. В герминативных центрах лимфоидных узелков по сравнению с таковыми в группе интактных животных число иммунобластов увеличилось на 8% (5-е сутки) и на 35% (18-е сутки), количество макрофагов на 5-е сутки уменьшилось на 18%, на 18-е сутки увеличилось на 28,5%. В мозговых тяжах фиксировали рост в 3–4 раза числа средних лимфоцитов и уменьшение количества зрелых плазмоцитов на 14,5 и 34% на 5-е и 18-е сутки соответственно. Количество макрофагов на 5-е сутки выросло на 41%, на 18-е сутки – на 30% (табл. 4).

Обсуждение. Известно, что рост злокачественных опухолей сопровождается продукцией ими веществ, вызывающих снижение либо полную блокаду противоопухолевого иммунного ответа [8]. Кроме подавления локального иммунного ответа опухоль оказывает прямое угнетающее действие на иммунные органы, что обусловливает снижение продукции ими иммунокомпетентных клеток либо выработку дефектных цитотоксических лимфоцитов, которые также могут служить источником иммуносупрессивных Т-reg клеток [9, 10].
Результаты исследований ряда авторов показали, что при развитии опухолей инволюция тимуса и связанное с ней нарушение пополнения периферических Т-лимфоцитов лежат в основе развития Т-клеточного иммунодефицита [11]. Инволюция тимуса при росте опухоли у человека и экспериментальных животных изучается уже на протяжении нескольких десятков лет [11], при этом выявлены значительные различия в гистологических реакциях тимуса у человека и грызунов. Результаты изучения тимуса и тазовых лимфатических узлов в нашем эксперименте свидетельствуют о том, что в динамике развития экспериментальной опухоли простаты в них происходят изменения структурной организации и цитоархитектоники, степень выраженности которых зависит от степени злокачественной трансформации простаты.
На раннем этапе (5-е сутки) роста опухоли простаты отсутствовали метастазы в регионарные лимфатические узлы, в строме простаты вокруг первичного опухолевого узла количество кровеносных и лимфатических сосудов уменьшилось по сравнению с интактными животных [4]. В тимусе возросла доля соединительнотканных элементов и железистой ткани, при этом уменьшалось число иммунобластов в подкапсульной зоне, в остальных структурных зонах число их возросло, что в сочетании с увеличением числа клеток на стадии митоза свидетельствует об активации процессов пролиферации и бласттрансформации лимфоидных клеток, об усилении цитоксических механизмов иммунного ответа [12].
На стадии метастазирования опухоли простаты в лимфатические узлы (18-е сутки, III стадия канцерогенеза) обнаружено полное замещение тканей простаты атипичными клетками, уменьшение числа кровеносных сосудов в строме опухоли. На 18-е сутки роста опухоли простаты в тимусе выявлены признаки структурной дезорганизации (уменьшение размеров мозгового вещества, увеличение площади коркового вещества, железистых эпителиальных образований, соединительнотканных компонентов), сопровождавшиеся уменьшением числа лимфоидных клеток в корковом и мозговом веществах при увеличении их числа в кортикомедуллярной зоне. Данную перестройку можно расценить как проявление 2-й фазы акцидентальной инволюции органа [13]. Микроскопическое исследование тимуса выявило изменения в его эпителиальном компартменте: тенденцию к увеличению относительной площади железистых эпителиальных образований по сравнению с контрольными значениями, а также численности эпителиоретикулярных клеток. Данные литературы говорят о том, что железистые эпителиальные образования в тимусе являются функциональными структурами, присущими нормальному тимусу, роль которых заключается в усилении секреции его гормонов при экстремальных воздействиях на организм [12]. Полученные нами результаты (на 18-е сутки роста опухоли простаты) соответствуют данным других авторов, отметивших: рост и формирование злокачественной опухоли приводит к акцидентальной инволюции тимуса и служит следствием антигенной стимуляции [3], а также иммуносупрессивного действия фактора роста эндотелия сосудов (VEGF) [14].
Результаты нашего исследования тазовых лимфатических узлов показали, что на III стадии экспериментального канцерогенеза простаты (18-е сутки) с появлением в краевом и мозговом синусах лимфатических узлов атипичных крупных клеток (метастазов) в них происходят изменения структурной организации. Это, вероятно, обусловлено инволюционными процессами в тимусе и говорит о нарушении их транспортной функции. В корковом веществе лимфатических узлов выявлены структурные признаки неполноценности местного иммунного ответа: уменьшение площади паракортикальной (Т-зависимой) зоны, увеличение размеров В-зависимой зоны, узелковая реакция (увеличение площади вторичных лимфоидных узелков). В мозговом веществе лимфатических узлов определилась характерная синусная реакция на метастазирование – сокращение размеров мозговых синусов, что более характерно для поздних стадий канцерогенеза. Показано, что при раке простаты изменения в цитоархитектонике регионарных лимфатических узлов происходят еще до их колонизации опухолевыми клетками: уменьшается площадь расположения антигенпрезентирующих дендритных клеток, размеров паракортикальной зоны лимфатических узлов, числа Т-лимфоцитов [15].
Заключение. Подводя итоги проведенным исследованиям, можно констатировать, что злокачественная опухоль простаты вызывает характерные преобразования цитоархитектоники центральных (тимус) и периферических (лимфатические узлы) иммунных органов, степень выраженности которых зависит от стадии канцерогенеза простаты. Морфологические преобразования в тимусе при экспериментальном канцерогенезе простаты свидетельствуют о его акцидентальной инволюции вследствие выраженной антигенной стимуляции [6, 11] и могут быть результатом иммуносупрессивного действия ростового фактора эндотелия сосудов (VEGF) [15], что подтверждается полученными нами ранее морфологическими результатами количественного исследования лимфатических сосудов стромы опухоли и выявленными структурными преобразованиями в регионарных лимфатических узлах простаты [4].



