Введение. Настоящая серия эксперимента является последовательной частью эксцессивного исследования, направленного на оценку обсемененности и соответствующих воспалительных изменений в ткани простаты (Пр) у лабораторных животных после топической трансуретральной инокуляции ступенчато возрастающих концентраций бактерий (Escherichia coli, Staphylococcus haemolyticus, Peptococcus niger) [1–3]. В результате предшествовавших серий эксперимента нами установлено, что дебатируемые бактерии S. haemolyticus и P. niger в инициальном инфицирующем титре 103 КОЕ/мл уже на первые сутки наблюдения способны вызывать островоспалительные деструктивные изменения в Пр. Следует отметить, что совокупная выраженность патоморфологических изменений в Пр после инфицирования S. haemolyticus была определена на более значительном уровне по сравнению с таковыми при инокуляции каузативного уропатогена E. coli, а при инфицировании анаэроба P. niger тяжесть изменений оказалась сопоставимой с патоморфозом ткани, вызванным E. coli. К 14-м суткам отмечена тенденция к разрешению воспалительных изменений и относительному снижению показателей обсемененности. С учетом полученных в предшествовавших сериях данных нами был расширен дизайн эксперимента и определены дальнейшие задачи по оценке микробной нагрузки и воспалительных изменений в Пр при инфицировании возрастающим титром в отдаленном сроке наблюдения изучаемым спектром уропатогенов.
Наряду с этим известны данные о взаимосвязи между хроническим воспалением в Пр и развитием рака простаты (РП). В мета-анализе (11 исследований, 1971–1996) L. K. Dennis et al. (2002) показано наличие повышенного риска (ОШ=1,6) развития РП у пациентов, перенесших простатит [4]. В релевантном мета-анализе (20 исследований, 1990–2012) J. Jiang et al. (2013) также выявили достоверную взаимосвязь (ОШ=1,64; 95% ДИ: 1,36–1,98) между перенесенным простатитом и развитием РП [5]. Несомненно, значительным количеством исследований определено влияние различных патофизиологических (метилирование ДНК, перекисное окисление липидов, генез свободных радикалов и активных форм кислорода и т.д.) и клеточно-опосредованных (регуляция апоптоза, пролиферации и т.д.) процессов, протекающих при воспалении, как на активность различных интрацеллюлярных медиаторов и трансдукторов, так и на стимулирование канцерогенеза [6–8]. В частности, воспалительная стимуляция медиатора NFkB опосредует проонкогенные изменения посредством активации неоангиогенеза, нарушения стабильности клеточного цикла и генной регуляции синтеза различных цитокинов и хемокинов, в частности фактора некроза опухолей (TNFα), белков-ингибиторов апоптоза (TRAF1 и TRAF2), семейства белков B-cell CLL/lymphoma 2, белка р53 и т.д. [9]. В свою очередь изменения экспресcии р53 и EAF2 фактора приводят к активации функционирования сигналингового пути STAT3, опосредующего онкогенез при РП [10, 11]. Иным маркером неопластической трансформации при РП является регуляторный белок Ki-67, cтепень экспрессии которого отражает скорость пролиферации опухолевых клеток [12]. Исследованиями подтверждено, что выраженность экспрессии р53 и Ki-67 взаимосвязана при РП с более высокими баллами по классификации Gleason и морфологической классификации Международного общества уропатологии (ISUP Grade) соответственно, с худшим прогнозом по агрессивности и прогрессированию заболевания [13]. Таким образом, принимая во внимание дизайн проводимого экспериментального исследования, включающего оценку интенсивности бактериально-индуцированного воспалительного процесса в Пр при длительном периоде наблюдения, определена целесообразность проведения оценки возможных постинфекционных неопластических изменений в тканях Пр при условии персистенции воспалительных изменений или пролиферативной трансформации.
Цель исследования: осуществить по результатам эксперимента: 1) оценку степени бактериальной обсемененности и выраженности гистологических изменений тканей простаты на 60-е сутки наблюдения при трансуретральном инфицировании различными уропатогенами в титрах 102, 3, 5 КОЕ/мл; 2) принципальный сопоставительный анализ между показателями тестового инокулируемого титра и микробной нагрузки с тяжестью гистологических изменений тканей простаты; 3) верификацию неопластических трансформаций тканей простаты при длительно персистирующем бактериально-индуцированном воспалительном процессе.
Материалы и методы. Этическое заявление. Исследование одобрено Этическим комитетом ФГБОУ ВО РостГМУ Минздрава России на основании ознакомления с предоставленными материалами дизайна и плана реализации эксперимента (протокол № 16/17 от 05.10.2017). Эксперимент на лабораторных животных (ЛЖ) разработан и проведен в соответствии с международными и отечественными руководствами и рекомендациями [14–17].
Лабораторные животные. 14 половозрелых кроликов New Zealand, масса: 3350–4300 г, возраст: 34–42 мес.
Уропатогены. Штаммы Escherichia сoli (штамм № 32), Staphylococcus haemolyticus (штамм № 28), Peptococcus niger (штамм № 7), выделены из биоматериала (после пробы Meares-Stamey) пациентов с верифицированным простатитом II категории (согласно классификации Национальных институтов здоровья – Национального института диабета, заболеваний пищеварительного тракта и почек (NIHNIDDK Classification System, 1999) посредством расширенного культурального исследования на 12 питательных средах по разработанной методике (патент RU 2452774 C1 № 2011103414/10 от 31.01.2011). Последующее культивирование осуществляли по методикам, представленным в предыдущих сериях эксперимента [1, 2]. Инокулируемые титры уропатогенов: 102, 103, 105 КОЕ/мл; контроль – Sol. NaCl 0.9%.
Рандомизация. С целью минимизации ошибок отбора (selection bias) на постадаптационном этапе (7 дней) ЛЖ были распределены на пять групп (табл. 1) с группировкой по инфицирующему уропатогену с помощью Генератора случайных последовательностей (Random Sequence Generator, «Randomness and Integrity Services Ltd.», Дублин, Ирландия). С целью снижения количества ошибок, связанных с ходом эксперимента и снижения риска искажения результатов (performance bias), на постинфекционном этапе группу экспериментаторов «ослепляли» посредством присвоения уникального идентификационного кода каждой инфицированной особи.

Этапы экспериментального моделирование простатита, вивисекции и подготовки биоптатов наряду с методиками культурального и гистологического исследований тканей Пр детально описаны в предшествовавших исследованиях [1–3]. Срок наблюдения – 60 суток с момента инокуляции. Иммуногистохимическое исследование. Подготовку срезов тканей для иммуногистохимического (ИГХ) исследования после регидратации и депарафинирования проводили на начальном этапе с использованием демаскирующих растворов «3 в 1» Сell Marqueтм Trilogy («Sigma Aldrich» Corp., Сент-Луис, Миссури, США) на водяной бане (t=98oC, pH – 6,0) в течение 30 мин. Для блокировки эндогенной пероксидазы и предотвращения связывания с ним хромогена применяли раствор Сell Marqueтм Hydrogen Peroxide Block («Sigma Aldrich» Corp., Сент-Луис, Миссури, США). Этапную промежуточную промывку препаратов выполняли с использованием фосфатно-солевого буфера промывочного Сell Marqueтм 20х PBS IHC Wash Buffer+Tween 20 («Sigma Aldrich» Corp., Сент-Луис, Миссури, США). После обводки срезов карандашом для ИГХ-исследования Elite Pap-Pen 2 мм («Diagnostic BioSystems» Inc., Плезантон, Калифорния, США) производили нанесение антител к Ki-67 – Сell Marqueтм Ki-67 Rabbit Monoclonal Antibodies и р53 – Сell Marqueтм р53 Mouse Monoclonal Antibodies («Sigma Aldrich» Corp., Сент-Луис, Миссури, США), предварительно дилюцированных разбавителем антител Сell Marqueтм Emerald на основе PBS («Sigma Aldrich» Corp., Сент-Луис, Миссури, США). Далее проводили инкубацию (t=24oC, 30 мин) в S.-Bt Smart Biotherm («Biosan» SIA, Рига, Латвия), после которой производили промывание срезов и нанесение детектирующей системы Сell Marqueтм HRP HiDef 2-Step Polymer Detection Kit Rabbit & Mouse («Sigma Aldrich» Corp., Сент-Луис, Миссури, США) с 30-минутной экспозицией, затем выполняли повторную промывку и нанесение визуализирующего хромогена Сell Marqueтм 25х DAB Kit («Sigma Aldrich» Corp., Сент-Луис, Миссури, США). Далее выполняли контрольное промывание, дополнительное докрашивание ядер Hematoxyline Mayer в течение 3 мин (с помещением под покровное стекло) и фиксацию в 10%-ном нейтральном забуференном формалине «HistoSafe®» продолжительностью 24 ч, репарафинирование. После проводки производили микротомирование тканей (4 мкм) с помощью ротационного микротома Leica RM 2265 («Leica Microsystems» GmbH, Вецлар, Германия), используя микротомные лезвия Accu-Edgeтм Microtome Blades A-35 «Extreme thin Section» («Sakura Finetek USA, Inc.», Торранс, Калифорния, США). Полученные срезы помещали на высокоадгезивные стекла Polysineтм Сoated Microscope Slides («Polysciences» Inc., Уоррингтон, Пенсильвания, США) и высушивали (t=37oC, 18 ч).
Визуальную оценку гистологических изменений и результатов иммуногистохимических (ИГХ) реакций проводили с помощью прямого светового микроскопа Leica DM2000 («Leica Microsystems» GmbH, Вецлар, Германия) в разрешениях x100, x200, х400 фотофиксацию патоморфологических изменений – цифровой камерой Leica DFC295 3 Mpx («Leica Microsystems» GmbH, Вецлар, Германия).
Экспрессию белка p53 и количественную оценку пролиферативной активности по сигналу Ki-67 проводили путем фиксации соотношения окрашенных ядер на 100 клеток (x200/400). Введенная градация – 1) для p53: отсутствие экспрессии (0 баллов); слабая экспрессия (1 балл) – окрашены <10,0% ядер; умеренная экспрессия (2 балла) – от 10,0 до 33,0%; сильная экспрессия (3 балла) – >33,0% окрашивания ядер клеток; 2) для Ki-67: ≤2,0% – отрицательно, ≤25,0% – 1+, 25,0 – 50,0% – 2+, 51,0 – 75,0% – 3+, 76,0 – 100,0% – 4+ [19, 20].
С целью минимизации ошибок детекции (detection bias) на этапах формирования биоптатов проводили их шифрование для «ослепления» персонала, проводящего культуральное, гистологическое и ИГХ-исследования.
Статический анализ. Статистическую обработку полученных данных проводили с помощью программного обеспечения GraphPad Prism 9 by Dotmatics («GraphPad Software» Inc., Graphpad Holdings LLC, Сан-Диего, Калифорния, США). Тесты Shapiro–Wilk и Колмогорова– Смирнова показали отсутствие нормального распределения показателей. В связи с этим описательная статистика количественных признаков представлена в виде центральной тенденции медианы (Me) и интерквартильного размаха (25 и 75 процентили) – в тексте представлено как Ме [LQ;UQ]. Сравнение переменных в независимых выборках выполнено посредством непараметрических статистических методов one-way ANOVA Kruskal-Wallis H-test с Dunn’s post-hoc-тестом. Принятый уровень достоверности p<0,05. Титровые показатели (10n КОЕ/мл) в тексте обозначены в виде десятичного логарифма n (n lgКОЕ/мл), где n – степень обсемененности.
Результаты. Оценка бактериальной обсемененности тканей простаты. Данные бактериологического исследования показали наличие обсемененности тестируемыми микроорганизмами биоптатов Пр во всех наблюдаемых случаях в группах (Г) 1–3 (табл. 2). В Г4 (S. haemolyticus+P. niger) оценить изменения не представлялось возможным в связи с летальным исходом ЛЖ на 7-е и 12-е сутки после инокуляции 2,00 и 5,00 lgКОЕ/мл соответственно. В Г5 (контроль) верифицирована резидентная микрофлора, представленная таксонами Propionibacterium spp., Eubacterium spp., Bacteroides spp. и в виде монои бикомпонентных микробных ассоциаций в титрах от 1,00 до 3,00 lgКОЕ/мл.
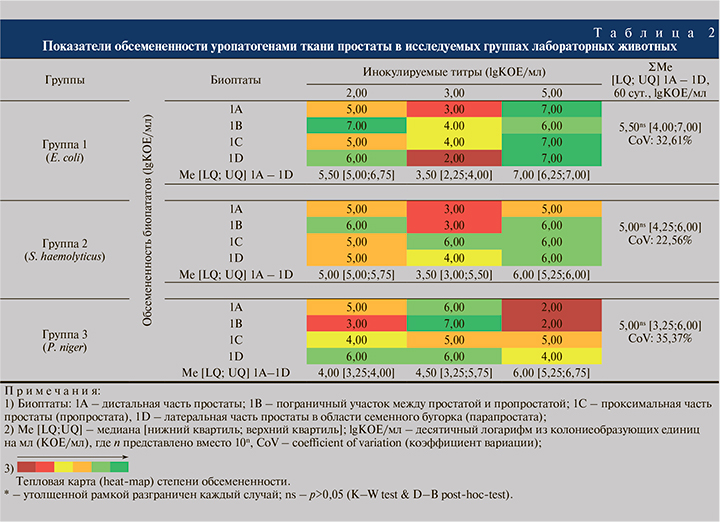
Частотный анализ значений микробной нагрузки показал, что ни в одной из тестируемых групп не выявлено показателей микробной нагрузки биоптатов Пр <2,00 и >7,00 lgКОЕ/мл. Анализ распределения частот выявил в Г1 в большинстве (33,3%) случаев обсемененность биоптатов на уровне 7,00 lgКОЕ/мл, в Г2 – в 42.7% наблюдений на уровне 6.00 lgКОЕ/мл и в Г3 – в 25,0% случаев на уровне 5,00 и 6,00 lgКОЕ/мл соответственно (рис. 1).
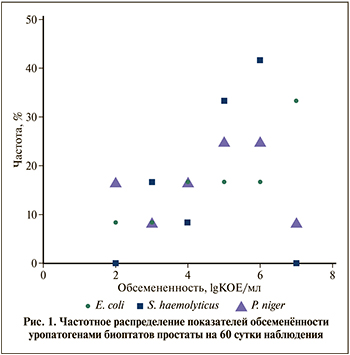
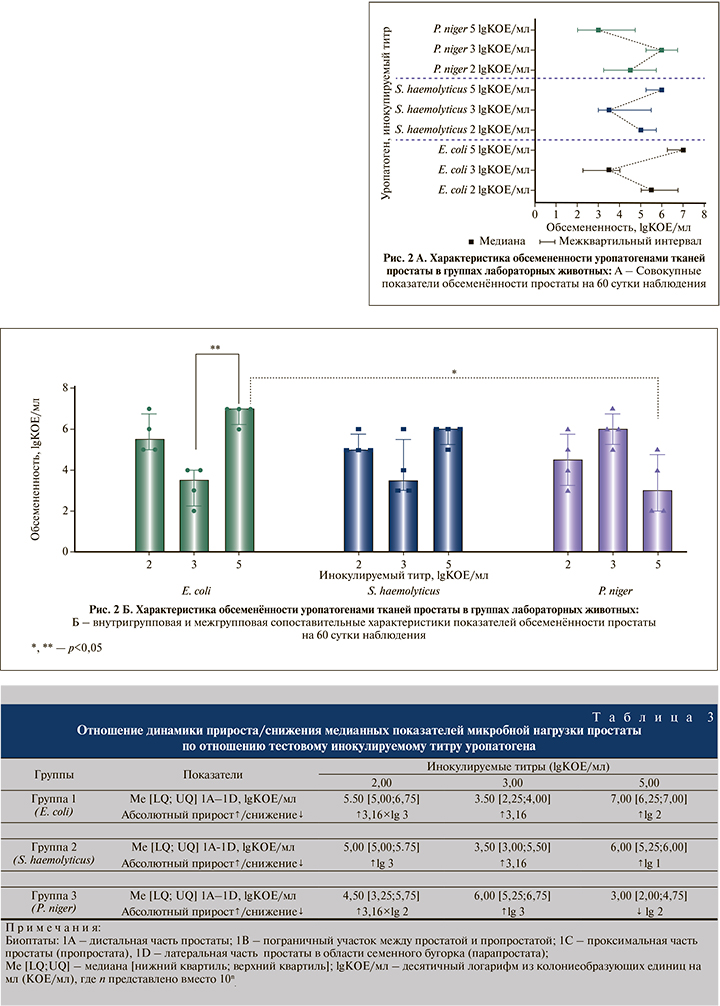
Совокупная оценка медианной микробной нагрузки Пр как единой органной структуры показала, что в Г1 наиболее высокие медианные показатели обсемененности Пр на 60-е сутки (1А – 1D) отмечены после инокуляции тестового титра E. coli 5,00 lgKOЕ/мл, а наименьшие показатели микробной нагрузки определены после инокуляции тестового титра E. coli 3 lgKOЕ/мл; в Г2 максимальные – после инокуляции тестового титра S. haemolyticus 5,00 lgKOЕ/мл и минимальные – после введения S. haemolyticus 3,00 lgKOЕ/мл соответственно; в Г3 наивысшие – после инокуляции тестового титра P. niger 3,00 lgKOЕ/мл и наименьшие – после инокуляции P. niger 5,00 lgKOЕ/мл соответственно (рис. 2A). Оценка темпов изменения микробной нагрузки по отношению к тестовому инокулируемому титру показала накопление бактериальной массы в 8 из 9 (88,9%) случаев: максимальный прирост обсемененности в +3.16×lg 3 раза зафиксирован на 60-е сутки наблюдения в Г1 после введения E. coli 2,00 lgКОЕ/мл, минимальный прирост в +3.16 раза установлен в Г1 и Г2 после инокуляции E. coli 3.00 и S. haemolyticus 3.00 lgКОЕ/мл соответственно, максимальное снижение обсемененности в -lg 2 раз отмечено в Г3 после введения P. niger 5,00 lgКОЕ/мл (табл. 3). Сравнительный анализ не выявил достоверных различий между совокупными Ме-показателями микробной нагрузки Пр в группах (табл. 3). В свою очередь мультивариантый анализ показал существование значимых внутригрупповых различий микробной нагрузки в Г1 на 60-е сутки (р=0.006) между инфицированием E. coli 5,00vsE. coli 3 lgKOЕ/мл; а также межгрупповых различий (р=0.013) – между инфицированием E. coli 5 vs P. niger 5 lgKOЕ/мл соответственно (рис. 2Б). Гистологическая оценка изменений тканей простаты.
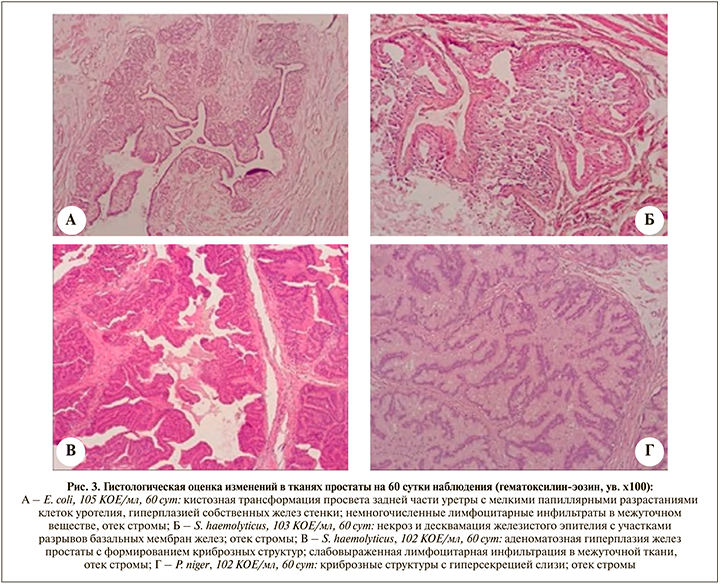
В Г1 (E. coli) при оценке гистологических изменений после инокуляции возрастающим титром 2.00, 3.00, 5.00 lgКОЕ/ мл в отдаленном наблюдении к 60-м суткам в тканях Пр в каждом из случаев визуализированы умеренная дилятация желез Пр с пилообразной пролиферацией гландулярного эпителия желез Пр, мелкофокусные скопления лимфоцитарных инфильтратов в межуточном веществе, небольшие участки ремоделирования и дезорганизации стромы; также в ряде препаратов в стенке простатического отдела уретры, непосредственно окруженной измененными тканями Пр, зафиксировано наличие протяженных участков уплощения уротелия с наличием фокусов мелкопапиллярных разрастаний эпителиального слоя; определены участки кистозной трансформации просвета уретры, а также локусы гиперпластического патоморфоза собственных желез уретральной стенки (рис. 3А). В Г2 (S. haemolyticus) соответственно в каждом из случаев верифицированы умеренная аденоматозная гиперплазия желез с формированием криброзных структур, в ряде участков тканей Пр определены мелкие фокусы некроза и десквамации гландулярного эпителия с участками разрывов базальных мембран желез, деструктуризация желез и окружающей стромы (рис. 3Б); несмотря на отдаленный срок наблюдения в препаратах визуализированы участки перманентного стромального отека, чередующиеся с диффузными фокусами дезинтеграции и дезорганизации интерстиция, в межуточной ткани сохранялась слабовыраженная лимфоцитарная инфильтрация (рис. 3В). В Г3 (P. niger) соответственно в тканях Пр в каждом из случаев отмечены умеренно-выраженные изменения в виде эктатических изменений желез с формированием криброзной архитектуры и гиперсекрецией слизистого компонента, уплощение гландулярного эпителия; стромальные изменения выражались в формировании участков деструктуризации межуточного вещества и незначительного отека, единичной инфильтрация стромы иммунокомпетентными клетками (рис. 3Г). Патоморфологические изменения в области края мембранозной уретры и шейки мочевого пузыря в группах на 60-е сутки характеризовались ремоделированием межуточного вещества и уплощением уротелия.
В Г5 (контроль) воспалительные изменения в ткани Пр не зафиксированы.
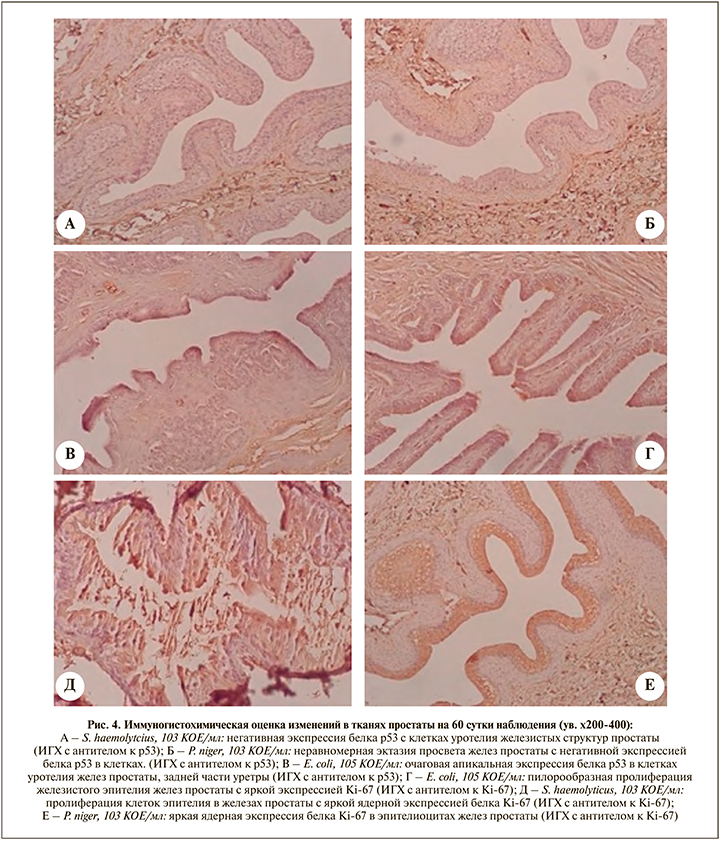
Иммуногистохимическая оценка неопластических изменений ткани простаты. Верификация экспрессии p53 при сроке наблюдения 60 суток не выявила наличия умеренной и значимой активности (>10,0%) транскрипционного фактора в различных участках тканей Пр ни в одной из экспериментальных групп (рис. 4А, 4Б). Тем не менее следует отметить, что в Г1 (E. coli) в нескольких препаратах (5,00 lgКОЕ/мл) в гландулярном эпителии желез Пр и фокусах уротелия прилегающих участков простатического отдела уретры отмечена мелкоочаговая апикальная ядерная экспрессия (≈10,0%) p53, однако внутренний контроль реакции оказался негативным (рис. 4В). ИГХ-верификация пролиферативной активности Ki-67 при сроке наблюдения 60 суток зафиксировала малую активность (≤25%) маркера в некоторых участках ткани Пр в ряде препаратов из различных экспериментальных групп. Так, в Г1 (E. coli, 5,00 lgКОЕ/мл) на фоне умеренных гиперпластических изменений желез Пр отмечены участки пилорообразной пролиферации гландулярного эпителия с экспрессией (+1) Ki-67 (рис. 4Г); также в Г2 (S. haemolyticus, 3,00 lgКОЕ/мл) и Г3 (P. niger, 3,00 lgКОЕ/мл) в железах Пр определены участки пролиферативной активности гландулярного эпителия с активностью маркера (+1) Ki-67 (рис. 4Д, 4Е). Тем не менее тождественные участки ткани Пр с симультанной экспресcией р53 и Ki-67 не обнаружены ни в одной из групп.
Обсуждение. В результате проведенной нами экспериментальной серии исследований удалось достичь адекватного уровня обсемененности исследуемого локуса у ЛЖ при инфицировании возрастающим титром различных уропатогенов, позволившего провести валидную оценку микробной нагрузки и гистологических изменений в тканях органокомплекса.
При сопоставительном анализе результатов культурального и гистологического исследований на 60-е сутки наблюдения установлено, что во всех тестируемых группах зафиксирована персистенция уропатогенов в ткани Пр на отдаленном сроке наблюдения. При этом анализ внутригрупповых различий в Ме-показателях обсемененности выявил только в Г1 (E. coli) наличие значимых различий на данном сроке наблюдения между инокуляциями 3,00 и 5,00 lgКОЕ/мл. Необходимо отметить, что, оценив совокупные Ме-показатели только на 60-е сутки наблюдения, не установлено выраженных различий в колебаниях между группами, а Ме-титр микробной нагрузки ткани варьировался в пределах 5,00–5,50 lgКОЕ/мл, т.е. не превышал стартовую максимальную инокулирующую дозу 5,00 lgКОЕ/мл. В частности, ни в одном из наблюдений не отмечено значительных повышений >7,00 lgКОЕ/мл, что может указывать на определенный пороговый уровень накопления патогена в тканях. Примечательно, что в Г1 (E. coli) и Г2 (S. haemolyticus) на данном сроке наблюдения при тестовом титре 3,00 lgКОЕ/ мл в обоих случаях прирост обсемененности был минимальным. Следует предположить, при соответствующей инфицирующей дозе в данных группах на сроке 60 суток отмечается снижение бактериальной обсемененности Пр. Однако в предшествовавших сериях экспериментов исследованиях снижение микробной нагрузки тканей отмечено к 14-м суткам в группах, инфицированных E. coli и P. niger [2]. В свою очередь из всех доступных наблюдений в данной серии только в Г3 (P. niger) медианная микробная нагрузка ткани Пр выявлена на более низком уровне по отношению к стартовой инфицирующей дозе (3,00 vs 5,00 lgКОЕ/мл), что может быть связано с прогредиентной элиминацией уропатогена к данному сроку наблюдения. Тем не менее с учетом весьма значительного уровня обсемененности ткани Пр в каждом из наблюдений отмечена диссоциация между данными показателями и гистологическими изменениями. Выраженность альтеративных воспалительных изменений в Г2 (S. haemolyticus) оказалась доминирующей в данной серии и выражалась в виде персистенции стромального отека, однако без выраженной реактивности микроциркуляторной сети (только в единичных сосудах отмечено полнокровие) и наличия некротических фокусов, лимфоцитарная инфильтрация имела слабовыраженный, но вместе с тем диффузный характер, что указывает на незначительность клеточной воспалительной реакции; поствоспалительное пролиферативное ремоделирование ткани выражалось в наличии дезинтеграции стромального компонента и изменении архитектоники строения желез Пр, сопровождавшейся формированием криброзных структур. В Г1 (E. coli) не отмечено признаков островоспалительных изменений, о чем свидетельствует отсутствие плеторы микроциркуляторного русла и выраженной реакции стромального компонента наряду с незначительной инфильтрацией иммунокомпетентными клетками, носящей единичный мелкофокусный характер; пролиферативные изменения выражались в дилятации желез Пр, уплощении гландулярного эпителия и дезорганизации стромального компонента. В Г3 (P. niger) острых альтеративных трансформаций в ткани Пр не отмечено, но вместе с тем сохраняются участки незначительного стромального отека, единичная диффузная клеточная инфильтрация, обращает на себя внимание, что значительное количество желез содержало в просвете массу слизистого компонента, указывающего на наличие эвакуационных нарушений, возможно, вследствие длительно существовавшего отека окружающей ткани или обструкции на уровне выводных протоков; основные пролиферативные изменения ткани выражались в изменении архитектуры расположения желез Пр с их эктазией и ремоделировании стромы.
В схожих по дизайну монокультурных экспериментальных исследованиях на ЛЖ исследователями приведены данные, по некоторым аспектам корреспондирующие с настоящей работой и показывающие как формирование хронического воспаления, так и персистенцию острого воспаления в отдаленных сроках наблюдения. L. Kaplan et al. (1983) в модели на 10-недельных крысах Sprague-Dawley показали, что после инъекционного инфицирования 5х5 lgКОЕ/мл E. coli кастрированным и интактным ЛЖ к 4-м суткам наблюдения во всех долях Пр были выявлены признаки острого воспаления. Однако на 18-е сутки в группе интактных ЛЖ какие-либо деструктивные и поствоспалительные изменения в вентральной доле Пр простаты отсутствовали, но в дорсолатерной доле Пр отмечались признаки пролиферативного воспаления с позитивными результатами культурального исследования ткани [21].
S. I. Seo et al. (2003) в модели на 12-, 16недельных крысах Wistar установили, что после инокуляции 1х8 lgКОЕ/мл E. coli Z-17 у 62,0% (n=100) наблюдений через 4 нед. в Пр определено пролиферативное воспаление, однако только в 8,0% случаев исследователи отметили спонтанное разрешение хронического воспаления. У остальных 38,0% особей отмечены как признаки острого процесса в Пр (которые, возможно, привели в определенном количестве случаев к летальному исходу), так и полное отсутствие инфламационных изменений [22]. E. Elkahwaji et al. (2006) в исследовании на 12-недельных мышах C3H/HeOuJ верифицировали после инфицирования 2х6 lgКОЕ/мл E. coli 1677 на 5-е сутки острое гнойное воспаление в Пр, которое к 12-й и 26-й неделям наблюдения трансформировалось у определенной части особей в хроническое. Несмотря на демонстративные результаты, показывающие эффективность мышиной модели для воспроизведения простатита, в схожем исследовании на 13-недельных мышах BALB/c и C57BL/6J на 5-е сутки после инфицирования в Пр значимых воспалительных трансформаций не отмечено [23, 24].
Оценка экспрессии иммуномаркера р53 выявила только в случае инфицирования E. coli 5,00 lgКОЕ/мл наличие незначительной активности белка – супрессора опухоли на 60-е сутки, тем не менее без внутреннего положительного контроля. Участки ткани с повышенной пролиферативной активностью гландулярного эпителия и гиперэкспрессией Ki-67 визуализированы во всех тестируемых группах (однако не при всех инфицирующих титрах) на отдаленном сроке наблюдения, но вместе с тем выраженность его экспрессии не превышала 25,0% ни в одном из случаев. Таким образом, недостоверно расценивать данные изменения экспрессии маркеров в качестве показателя онкопролиферативной трансформации ткани Пр. Однако следует отметить, что в исследованиях, посвященных оценке экспрессии р53 и Ki-67 при РП у человека, также не удается во всех случаях иммуногистоанализа выявить позитивную реакцию на данные маркеры в ткани.
R. Verma et al. (2015) при оценке гистологических и ИГХизменений в Пр (n=50) при РП (Gleason score – 6–10) выявили только в 76,0% наблюдений гиперэкcпресcию р53 и в 64,0% – Ki-67, при этом клеточная активность р53 и Ki-67 отсутствовала при низкодифференцированном РП (ISUP Grade – 4–5, Gleason score – 80–10) в 6,67 и 13,33% (n=15) случаев cоответственно [25]. Sh. Madani et al. (2011) также продемонстрировали, что только в 61,9% (n=21) и 88,0% (n=25) наблюдений соответственно при умеренно-дифференцированном (ISUP Grade 3) и низкодифференцированном (ISUP Grade – 4–5) РП определена гиперэкспрессия Ki-67 [20]. T. Jiang et al. (2005) в свою очередь верифицировали только в 51,1% (n=45) случаев экспрессию р53 в биоптатах при РП, cообразно в 14,3 и 56,7% (n=23) изменения активности маркера выявлены в опухолях с Gleason score ≤7 и >7 [26]. Также применительно к р53 следует учитывать наличие некоторых факторов, влияющих как на его экспрессию, так и на детекцию. Так, белок Mdm2 (белок-ингибитор р53) опосредует дифференцированное воздействие на экспрессию р53 у определенных индивидов посредством наличия полиморфизма гена MDM2, кодирующего данный белок [27]. В связи с этим следует предположить, что могут отмечаться и межвидовые различия аллелей данного гена, вследствие чего степень ингибирования р53 может разниться между гуманоидными и негуманоидными представителями. Также следует учитывать данные, свидетельствующие о неспособности некоторых антител вступать во взаимодействие с определенными изоформами р53, тем самым искажая его детекцию [28]. Можно также предположить, что данный вид ЛЖ, использованный в эксперименте, крайне мало восприимчив к развитию РП, в связи с чем смоделировать данный процесс представляется затруднительным. Однако Y. Wang et al. (2022), используя именно кроликов New Zealand вместо крыс и мышей (объясняя это их большей филогенетической близостью к человеку), показали возможность моделирования РП посредством инъекционного введения PC3pipGFP PCa культуры клеток: к 14-м суткам наблюдения у 70,0% (n=20) особей отмечена неопластическая трансформация, а средняя скорость роста опухоли составила 39±25 мм2/нед. [29].
Заключение. Таким образом, синтезируя вышепредставленные данные, можно выделить несколько ключевых моментов:
1) К 60-м суткам наблюдения после инфицировании S. haemolyticus (102, 3, 5 КОЕ/мл) во всех случаях отмечено наличие участков умеренного пролиферативного ремоделирования ткани простаты, а также фокусов слабого персистирующего активного воспаления; при инфицировании E. coli (102, 3, 5 КОЕ/мл) во всех случаях определены умеренно-выраженные поствоспалительные трансформации тканей без значительных островоспалительных фокусов; при инфицировании P. niger (102, 3, 5 КОЕ/мл) пролиферативные изменения ткани простаты имели слабовыраженный характер; активные альтеративные изменения не зафиксированы.
2) Не установлена взаимосвязь между инициальным инфицирующим титром различных уропатогенов, степенью обсемененности тканей на установленных сроках наблюдения и тяжестью воспалительных изменений в ткани простаты, что требует дальнейшего анализа с проведением сопоставительной морфометрии.
3) Достоверно не выявлено участков неопластической трансформации ткани простаты при бактериально-индуцированном воспалительном процессе на отдаленных сроках наблюдения (60 сут.). Вместе с тем в ряде случаев отмечена гиперэкспрессия Ki-67, свидетельствующая о повышенной пролиферативной активности гландулярного эпителия желез простаты, которая может быть расценена нами как воспалительная. Следует отметить наличие гистологических изменений тканей простаты, особенно в группе инфицирования S. haemolyticus, в виде аденоматозной гиперплазии ее желез. Данные бактериально-индуцированные патоморфозы могут свидетельствовать об инициальном этапе поствоспалительной аденоматозной трансформации простаты, по типу схожей с аденоматозными изменениями простаты у человека при доброкачественной гиперплазии. Естественно, данная гипотеза требует дальнейшей верификации в последующих экспериментальных исследованиях.



