Введение. Ежегодно в мире диагностируют более 550 тыс. новых случаев рака предстательной железы (РПЖ). За последнее десятилетие число активно выявленных случаев злокачественных новообразований данной локализации в России увеличилось с 15,4 до 33,8% [1]. При этом летальность в течение года с момента установления диагноза за те же годы снизилась с 15 до 7,8%. Это обнадеживающая тенденция, обусловленная многими факторами и доказывающая эффективность программ ранней диагностики РПЖ в России. Доказывает это и тот факт, что если в 2008 г. ранние стадии РПЖ диагностировали у 44% пациентов, то в 2020 г. – у 60,5% [2, 3]. Прогрессивное развитие методов диагностики и внедрение скрининга рака простаты в клиническую практику позволили в ряде стран диагностировать локализованные формы РПЖ у 90% больных [4, 5].
Внедрение и выбор альтернативных методов лечения пациентов с РПЖ, которым не показано радикальное оперативное вмешательство, по-прежнему остаются дискутабельными, поскольку необходимо провести хорошо спланированные проспективные исследования с описанием стандартизированных показателей, прежде чем можно будет дать рекомендации по применению аблативной тотальной или фокальной терапии в рутинной клинической практике (что является маловероятным в ближайшее время) [6, 7].
За последние 23 года метод ультразвуковой аблации простаты (High Intensity Focused Ultrasound (HIFU)) прошел уникальный путь от первой операции, выполненной в 1999 г. профессором Токийского университета Т. Ушида, до одного из основных прогрессивных малоинвазивных методов лечения локализованного РПЖ. В 2015 г. в США метод HIFU включен в список видов лечения локализованного РПЖ, согласно рекомендациям Агентства по контролю качества пищевых продуктов и лекарственных препаратов (FDA), и Американской ассоциации урологов. В то же время, по мнению Европейской ассоциации урологов (EAU, 2023), в связи с отсутствием убедительных сравнительных средне- и долгосрочных онкологических результатов HIFU следует предлагать только в рамках спланированных проспективных исследований [8].
HIFU представляет собой сфокусированные ультразвуковые волны, испускаемые преобразователем, которые вызывают повреждение ткани за счет механического и термического эффекта, а также эффекта кавитации. Цель HIFU – повысить температуру ткани опухоли выше 75°C, чтобы произошло ее разрушение посредством достижения коагуляционного некроза.
На сегодняшний день для лечения пациентов с РПЖ существует три основных типа аппаратов, в основе которых лежит излучение ультразвуковых волн с помощью транc- ректального датчика.
«Sonablate» (Focal Surgery, США), в котором используется пьезоэлектрический датчик 4 МГц для визуализации, а также для лечебного воздействия. Расстояние от линзы до фокуса составляет 3,0; 3,5 или 4,0 см, мощность излучения – от 1680 до 2000 Вт/см2. В России на данный момент используется три таких аппарата.
«Ablatherm» (EDAP TMS S.A., Воль-ан-Велин, Франция) состоит из двух основных стоек, имеет лечебный датчик прямоугольной формы с вогнутой поверхностью в виде ложки электронно-матричного типа с фокусным расстоянием 45 мм, частотой излучения 3 МГц. Лечебный датчик совмещен с диагностическим (7,5 МГц). На 2021 г. в Российской Федерации в разных клиниках использовалось 19 таких аппаратов.
«Focal One» (EDAP TMS S.A., Воль-ан-Велин, Франция) – новый R-HIFU аппарат последнего поколения, который состоит из одной мобильной стойки. В роботе используется единый электронно-матричный зонд с 3D-роботизированными движениями по трем осям (в ручном режиме по 5 осям) с длиной продольного секвенса 100 мм с отдельным датчиком для визуализации on-line трансректального ультразвукового исследования (ТРУЗИ) 7,5 Мгц и отдельным мультисрезовым датчиком для rHIFU-терапии 3МГц c динамически изменяемым фокальным объемом (5–40 мм), скоростью термоаблации 30 см3/ч, одновременным использованием сразу 8 фокусов и глубиной пенетрации 60 мм, «elastic-fusion» ТРУЗИ/МРТ (магнитно-резонансной томографии) в базовой комплектации, наведением и визуализацией в режиме реального времени, роботической on-line-автокоррекцией расстояния от датчика до стенки прямой кишки c учетом ее кривизны, охлаждением стенки кишки и контролем температуры в ней, датчиком внешних движений пациента. На сегодняшний день в России в клинической практике используется 3 экземпляра роботического аппарата «Focal One», один из которых располагается в клинике урологии МГМСУ на базе ГКБ С. И. Спасокукоцкого.
По сравнению с аппаратом «Ablatherm» его основными преимуществами являются:
- Абсолютно новый восьмисрезовый датчик, позволяющий значительно снижать время аблативного лечения, отека и эффекта кавитации и как следствие – улучшать качество визуализации.
- Миниатюрный фокальный объем работы аппарата от 5 до 40 мм, который позволяет крайне точно выполнять аблативное лечение.
- Фьюжн-наведение: создание трехмерной МРТ-реконструкции предстательной железы с последующим наложением ультразвукового изображения в режиме реального времени для еще более точной визуализации и оконтуривания зоны интереса.
- Полностью роботизированная регулировка температуры прямой кишки независимо от положения и работы си-стемы «Focal One».
- Возможность динамической фокусировки.
- Миниатюрность аппарата.
Основным показанием к проведению HIFU является локализованный РПЖ (с целью его радикального лечения), однако возможно применение HIFU и при местнораспространенных формах заболевания для паллиативной помощи пациентам [9]. По данным различных авторов, ультразвуковая аблация простаты может применяться для лечения пациентов РПЖ низкого и промежуточного риска, имеющих противопоказания к проведению радикальной простаткэтомии (РПЭ)/лучевой терапии или отказывающихся от традиционного лечения. В ряде исследований, посвященных изучению HIFU у больных РПЖ, представлены онкологические и функциональные результаты лечения при разном сроке наблюдения, описана хорошая переносимость данной операции, изучен профиль интра- и постоперационных осложнений [10, 11].
Материалы и методы исследования. Материалом для исследования послужили данные о 75 пациентах с верифицированным раком предстательной железы, перенесших HIFU в онкоурологическом отделении ГКБ им. С. И. Спасокукоцкого ДЗМ за период с ноября 2019 по ноябрь 2021 г.
Критериями включения пациентов в исследования были:
- локализованный РПЖ (в стадии не выше Т2);
- уровень общего ПСА крови <15 нг/мл;
- прогностическая группа International Society of Urological Pathology (ISUP)≤3;
- отсутствие тяжелых сопутствующих заболеваний в стадии декомпенсации;
- согласие больного на операцию.
В качестве первичного метода лечения ультразвуковая аблация была выполнена 40 больным. У 5 пациентов данный метод использовался для лечения рецидива опухоли после дистанционной лучевой терапии. В рамках клинического исследования фокальная аблация предстательной̆ железы высокоинтенсивным сфокусированным ультразвуком была проведена 30 больным. Таким образом, в наше исследование были включены 70 (93%) больных с первичными новообразованиями, ранее не получавших противоопухолевое лечение, и 5 (7%) с рецидивными опухолями, стандартное противоопухолевое лечение у которых оказалось неэффективным. Оценку распространенности опухолевого процесса проводили на основе клинической классификации опухолей по системе the Union for International Cancer Control, the TNM Classification of Malignant Tumors (UICC TNM) (8 пересмотр, 2017). Распределение пациентов в зависимости от стадии опухоли представлено в табл. 1. Согласно выше представленным данным, в исследовании преобладали пациенты со стадией T1cN0M0 (80%).
Всем больным на предоперационном этапе выполнялись общеклиническое обследование, определение уровня общего ПСА крови, ультразвуковое исследование (УЗИ) мочевой системы, урофлоуметрия с определением объема остаточной мочи, МРТ органов малого таза с контрастированием (или проводилась повторная оценка результата МРТ, полученного из другого лечебного учреждения), промежностная сатурационная биопсия предстательной железы для установки точной локализации опухолевого очага при условии выполнения фокального лечения. В тех случаях, когда биопсия простаты была ранее выполнена в другой клинике, проводился пересмотр микропрепаратов биопсии для подтверждения прогностической группы ISUP [12, 13].
Лечение проводилось под общей анестезией с использованием роботического комплекса «Focal One» (использование закиси азота при этом настоятельно не рекомендуется: этот газ влияет на качество ультразвуковых изображений во время лечения за счет усиления кавитационного эффекта и как следствие – на увеличение продолжительности операции). Данный аппарат оснащен единым электронно-матричным зондом с 3D-роботизированными движениями с отдельным датчиком для визуализации on-line ТРУЗИ 7,5 Мгц и отдельным мультисрезовым датчиком для rHIFU-терапии 3 МГц c динамически изменяемым фокальным объемом (5–40 мм). Лечение происходило под строгим контролем систем безопасности: во-первых, во время фазы аблации программное обеспечение автоматически контролирует расстояние от лечебного датчика до стенки прямой кишки, а охлаждающая система поддерживает температуру слизистой оболочки прямой кишки на уровне 14°C; во-вторых, положение «фокальной» точки внутри предстательной железы контролируется оперирующим хирургом в режиме реального времени; в-третьих, в аппарате установлен датчик внешних движений пациента, который при малейшем движении мгновенно остановит работу системы. Собственно, этот алгоритм и позволяет называть данную систему роботической.
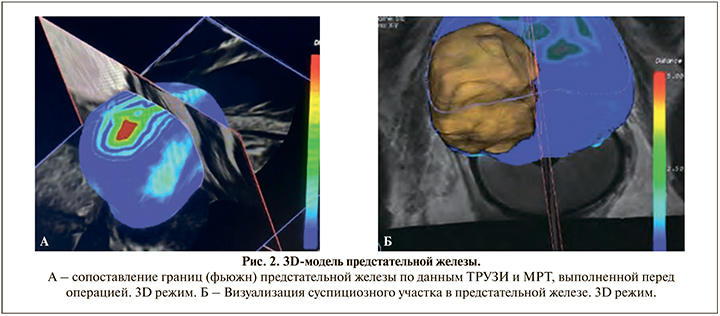
Для проведения лечения ультразвуковой датчик вводился трансректально в положении пациента лежа на правом боку (рис. 1). Планирование лечения проводилось с помощью ультразвука с последующим наложением изображений МРТ и данных предоперационной биопсии, когда проводилось fusion 3D-моделирование (рис. 2).
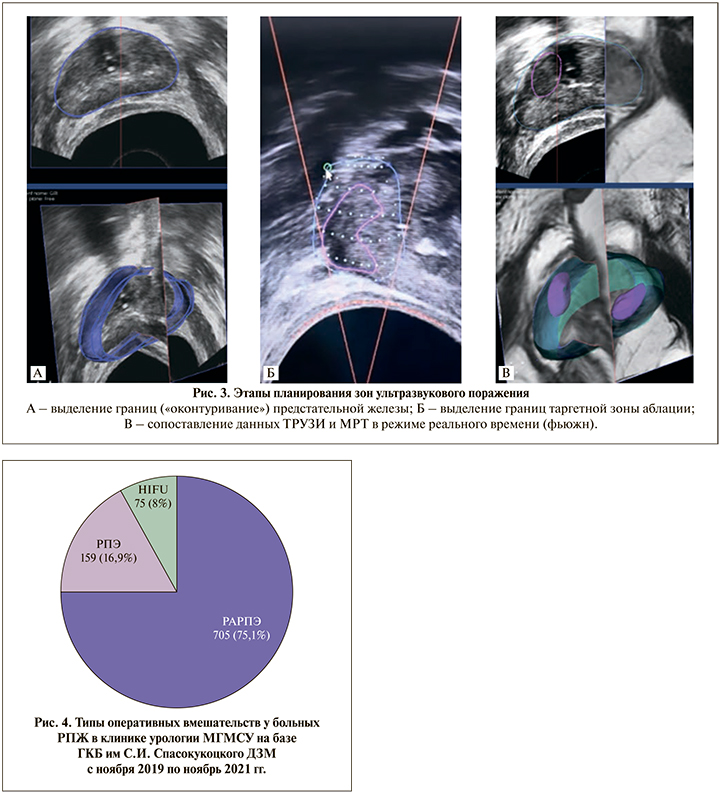
Уролог выполнял оконтуривание предстательной железы для планирования зон ультразвукового поражения и в обязательном порядке устанавливал границу в 4–6 мм от сфинктера, чтобы предотвратить его повреждение (рис. 3).
Чем больше размер предстательной железы, тем дольше выполнялась ультразвуковая аблация, в связи с чем каждому пациенту, которому планировалось выполнение тотальной аблации простаты, при объеме предстательной железы свыше >35 см3 и/или при наличии инфравезикальной обструкции (ИВО)/симптомов нижних мочевыводящих путей (СНМП) (сумма баллов по шкале IPSS >19) с целью уменьшения в объеме переднезаднего размера предстательной железы и обеспечения технической возможности проведения одномоментного лечения всего органа первым этапом выполнялась трансуретральная резекция простаты (ТУР).
Средний срок госпитализации больных, которым была выполнена HIFU-терапия, составлял 4,5 сут. в зависимости от того, в каком объеме было проведено аблативное лечение. Если пациент подвергался фокальной аблативной методике, уретральный катетер удаляли на 3-и сутки после оперативного пособия; при выполнении тотальной аблации – на 4-е сутки. Каждому пациенту в период со дня операции и после выписки в течение 30 дней для снижения тонуса гладких мышц предстательной железы, шейки мочевого пузыря и простатической части уретры в отсутствие противопоказаний назначали прием селективного блокатора α1- адренорецепторов.
За время стационарного наблюдения каждому пациенту был проведен курс инфузионной, противовоспалительной и антибактериальной терапии, в последующем продленный в амбулаторном режиме до 30 сут. для минимизации послеоперационного воспалительного процесса.
Для оценки результата оперативного пособия в отсутствие противопоказаний через год пациентам выполняли МРТ малого таза с внутривенным контрастированием.
Основными критериями эффективности лечения являлись наименьшее значение (надир) ПСА и отрицательные контрольные биопсии спустя год после оперативного вмешательства.
Статистический анализ данных проводили с использованием программного обеспечения Statistica 12.0 (StatSoft, США). Нормальность распределения величин в выборке оценивали с помощью критерия Шапиро–Уилка. Статистическую значимость различий количественных параметров между группами осуществляли с помощью критерия Манна–Уитни, а долей – посредством использования критерия Хи квадрат Пирсона с поправкой Йетса на непрерывность. В динамике средние величины показателей сравнивали с исходным уровнем с помощью критерия Уилкоксона. Для выявления статистических различий критический уровень доверительной вероятности p принимали как 0,05.
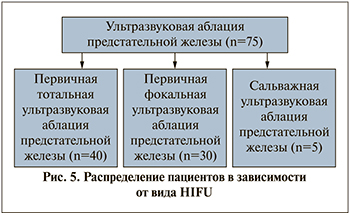
Результаты. В период с ноября 2019 по ноябрь 2021 гг. в клинике урологии МГМСУ на базе ГКБ им С. И. Спасо-кукоцкого ДЗМ лечение РПЖ проведено 939 пациентам (с 20.04.2020 по 16.07.2020 оперативная активность урологической клиники была приостановлена в связи со сложившейся эпидемиологической обстановкой, вызванной пандемией COVID-19). Возраст пациентов составлял 62,2±2,4 (min=51, max=80). 705 (75,1%) больным выполнена робот-ассистированная радикальная простатэктомия (РАРПЭ), 159 (16,9%) – радикальная позадилонная простатэктомия (РПЭ) и 75 (8%) пациентам – ультразвуковая аблация простаты (HIFU) (рис. 4).
28% пациентов (n=21) от общего числа пролеченных при помощи HIFU больных первым этапом перенесли трансуретральную резекцию предстательной железы (ТУРП).
У 40 (53,3%) пациентов лечение методом HIFU было первичным тотальным, у 5 (6,7%) – сальважным тотальным после дистанционной лучевой терапии или брахитерапии и у 30 (40%) метод фокальной терапии осуществляли в рамках отдельного клинического протокола (рис. 5).
В табл. 2 приведены основные характеристики пролеченных пациентов.
Статистически значимые различия между подгруппами установлены для распределения пациентов в зависимости от клинической стадии заболевания, градации баллов по Глисону (прогностической группы ISUP), по объему предстательной железы и индексу эректильной функции.
Межгрупповых различий по возрасту, величине максимальной скорости потока мочи, индексу IPSS установлено не было.
Уровень ПСА крови варьировался от 3,2 до 15,5 нг/мл, в среднем составив 9,3 нг/мл. Средний объем предстательной железы составил 32 (11–50) см3. Данный «пул» пациентов не имел выраженных нарушений мочеиспускания. (среднее значение суммы баллов по шкале IPSS (International Prostate Symptom Score) – 7: от 3 до 25). Большинство пациентов были заинтересованы в сохранении сексуальной функции IIEF-5 (International Index of Erectile Function) (4–25).
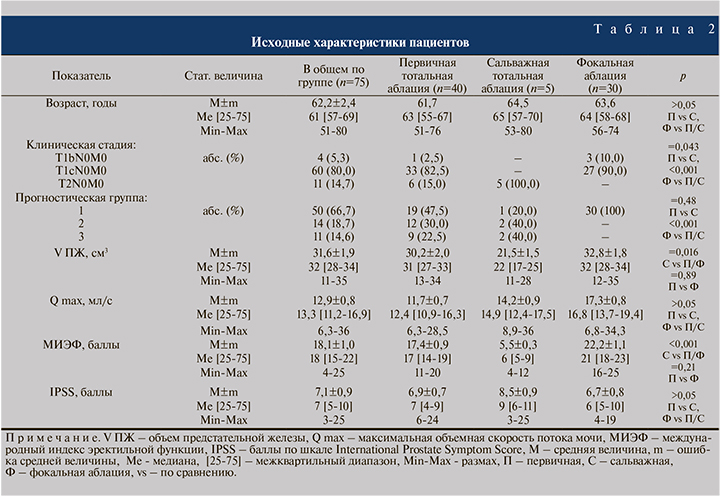
Через год после ультразвуковой аблации простаты полностью обследованы 53 (70.6 %) больных. Была изучена динамика уровня общего ПСА крови и индекса IPSS в первые 12 мес. после операции (рис. 6 и 7). В большинстве случаев отмечена устойчивая тенденция к послеоперационному снижению уровня общего ПСА при наблюдении от 1 до 12 мес. В конце первого года наблюдения среднее значение ПСА составило 0,96±0,11 нг/мл. Средний объем остаточной мочи составил 83 (0–150) мл.
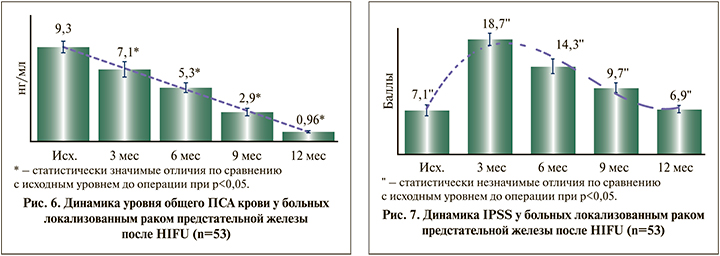
Через 3 мес. после HIFU выраженность СНМП у пациентов усиливалась: индекс IPSS возрос с 7,1±0,9 до 18,7±1,0 балл (р=0,017) и соответствовал умеренным нарушениям. Через 6 и 9 мес. имело место снижение индекса с достижением нормализации мочеиспускания через 12 мес. IPSS в конце первого года после операции соответствовал 6,9±0,6 балла и не отличался от исходного уровня (p>0,05).
При наблюдении в течение 1 года серьезных осложнений по хирургической классификации Clavien–Dindo отмечено не было (максимальный класс – I–II). 49 (92,4%) пациентов полностью удерживали мочу, 3 (5,6%) больных отмечали эпизоды ургентного недержания мочи 3–7 раз в неделю (использовали не более 1 прокладки в день).
Из всех 53 пролеченных больных имели место 5 (9,4%)наблюдений задержки мочи (после удаления уретрального катетера). У всех 5 пациентов мочеиспускание восстановилось после повторной установки и последующего удаления уретрального катетера. У 1 (1,9%) пациента, перенесшего до ультразвуковой аблации аденомэктомию, отмечено тотальное недержание мочи.
Среди полностью обследованных больных 35 пациентов были заинтересованы в сохранении эректильной функции (ЭФ). 17 (48,5%) пациентов относились к группе, которым ранее была выполнена тотальная ультразвуковая аблация предстательной железы, 18 (51,5%) пациентов относились к группе после фокального аблативного лечения. Через 3 мес. после HIFU наблюдалось ухудшение ЭФ в обеих группах, однако при наблюдении в течение года в группе пациентов, которые перенесли фокальное аблативное лечение, 89% пациентов имели ЭФ, достаточную для пенетрации. У пациентов, перенесших тотальную ультразвуковую аблацию простаты, ЭФ сохранилась в 71% наблюдений. Средний процент сохранения ЭФ после HIFU составил 80%, среднее значение IIEF-5 – 18 баллов.
У 4 (12%) из 32 пациентов, которым выполнена тотальная ультразвуковая аблация предстательной железы, выявлен рецидив заболевания спустя 12 мес. после HIFU. Через год после фокальной ультразвуковой аблации контрольная биопсия простаты проведена 21 (70%) из 30 пациентов. Из 21 больного фиброзная и атрофическая ткань выявлена у 19 (90,5%) больных, аденокарцинома простаты у 2 (9,5%). У 2 больных, у которых выявлен рецидив рака простаты, 1 пациенту рекомендовано активное наблюдение, 1 пациент направлен на дистанционную лучевую терапию.
Заключение. Ультразвуковая аблация простаты используется в клинической практике на протяжении более 20 лет. Технические нововведения и внедрение в клиническую практику fusion-технологий позволяют улучшать результаты лечения. Первичный собственный опыт урологической клиники МГМСУ продемонстрировал хорошие онкологические результаты при коротком сроке наблюдения. Отмечены хорошая переносимость лечения, минимальное число побочных эффектов и осложнений, быстрое восстановление и сохранение качества жизни. Целесообразно проведение дальнейшего проспективного анализа. По нашему мнению, метод ультразвуковой аблации предстательной железы с использованием роботического комплекса «Focal One» является перспективным и целесообразным в лечении пациентов с раком предстательной железы. Метод требует дальнейшего изучения, определения его места в иерархии органосохраняющего и функционально щадящего лечения злокачественных опухолей предстательной железы.



