Введение. Развитие эндоурологических методов лечения заболеваний верхних мочевыводящих путей обеспечило возможность практически полного отказа от традиционных, «открытых», операций, позволяя не только избавить пациента от травматичности хирургического доступа, но и максимально сократить сроки послеоперационной реабилитации. С другой стороны, внедрение «внутрипросветных» технологий привело к ощутимому росту числа ятрогенных стриктур мочеточника. Осложнения лучевой терапии, гинекологических и ангиохирургических вмешательств, туберкулез и ретроперитонеальный фиброз дополняют список причин сужений и облитераций последнего [1, 2].
 Заместительная кишечная пластика является последним вариантом реконструктивной хирургии множественных и протяженных стриктур мочеточника. В зависимости от размера и локализации его дефекта в качестве «вставки» могут быть использованы как червеобразный отросток, так и фрагменты толстой или тонкой кишок. Однако за счет мобильности и особенностей кровоснабжения подвздошной кишки именно илеопластика служит наиболее универсальным способом тотального замещения мочеточника. Несмотря на то что впервые эта операция была выполнена J. Shoemaker в 1906 г., до середины XX в. в литературе приводились лишь данные экспериментов или отдельных клинических наблюдений [3]. И только в 1959 г. W. Goodwin опубликовал собственный опыт лечения 18 подобных больных, причем с благополучным исходом. Именно в этой статье были сформулированы фундаментальные принципы интестиноуретеропластики и описана хирургическая техника, используемая и по сей день [4]. Миллениум ознаменовался прорывом минимально инвазивных методов во все сферы урологии. По мере совершенствования лапароскопического, а затем и роботического оборудования все более сложные вмешательства выполняются без традиционного хирургического разреза. Так, в 2000 г., I. Gill впервые осуществил лапароскопическую заместительную илеопластику пациентке с единственной почкой при уротелиальной карциноме верхней трети мочеточника [5]. В свою очередь первая робот-ассистированная операция при множественных стриктурах оного описана J. Wagner в 2008 г. [6]. Пионером среди российских урологов стал А. Е. Санжаров, выполнивший лапароскопическую кишечную пластику 22.07.2010 [7]. Впрочем, за двадцатилетнюю историю лапароскопической заместительной уретеропластики публикации о ее результатах все еще немногочисленны и, как правило, посвящены клиническим разборам единичных случаев из практики. Это объясняется не столько малой встречаемостью заболевания, сколько сложностью исполнения, переводящей лапароскопическое вмешательство в разряд «эксклюзивных». Кроме того, редкие наблюдения, описанные в современной литературе, в подавляющем большинстве реализованы из комбинированного доступа: когда резекция сегмента кишки и формирование межкишечного анастомоза выполняются из «мини»-лапаротомии, а остальные этапы – эндоскопически.
Заместительная кишечная пластика является последним вариантом реконструктивной хирургии множественных и протяженных стриктур мочеточника. В зависимости от размера и локализации его дефекта в качестве «вставки» могут быть использованы как червеобразный отросток, так и фрагменты толстой или тонкой кишок. Однако за счет мобильности и особенностей кровоснабжения подвздошной кишки именно илеопластика служит наиболее универсальным способом тотального замещения мочеточника. Несмотря на то что впервые эта операция была выполнена J. Shoemaker в 1906 г., до середины XX в. в литературе приводились лишь данные экспериментов или отдельных клинических наблюдений [3]. И только в 1959 г. W. Goodwin опубликовал собственный опыт лечения 18 подобных больных, причем с благополучным исходом. Именно в этой статье были сформулированы фундаментальные принципы интестиноуретеропластики и описана хирургическая техника, используемая и по сей день [4]. Миллениум ознаменовался прорывом минимально инвазивных методов во все сферы урологии. По мере совершенствования лапароскопического, а затем и роботического оборудования все более сложные вмешательства выполняются без традиционного хирургического разреза. Так, в 2000 г., I. Gill впервые осуществил лапароскопическую заместительную илеопластику пациентке с единственной почкой при уротелиальной карциноме верхней трети мочеточника [5]. В свою очередь первая робот-ассистированная операция при множественных стриктурах оного описана J. Wagner в 2008 г. [6]. Пионером среди российских урологов стал А. Е. Санжаров, выполнивший лапароскопическую кишечную пластику 22.07.2010 [7]. Впрочем, за двадцатилетнюю историю лапароскопической заместительной уретеропластики публикации о ее результатах все еще немногочисленны и, как правило, посвящены клиническим разборам единичных случаев из практики. Это объясняется не столько малой встречаемостью заболевания, сколько сложностью исполнения, переводящей лапароскопическое вмешательство в разряд «эксклюзивных». Кроме того, редкие наблюдения, описанные в современной литературе, в подавляющем большинстве реализованы из комбинированного доступа: когда резекция сегмента кишки и формирование межкишечного анастомоза выполняются из «мини»-лапаротомии, а остальные этапы – эндоскопически.
 Цель настоящей работы – анализ собственной серии лапароскопических заместительных кишечных пластик мочеточников, выполненных полностью интракорпорально при сроке послеоперационного наблюдения от 6 мес. до 7 лет.
Цель настоящей работы – анализ собственной серии лапароскопических заместительных кишечных пластик мочеточников, выполненных полностью интракорпорально при сроке послеоперационного наблюдения от 6 мес. до 7 лет.
Материалы и методы. Проведен мультицентровый ретроспективный анализ результатов реконструктивных вмешательств, предпринятых с января 2010 по декабрь 2017 г. по поводу патологии, требующей замещения мочеточников.
Критерии включения: пациенты подвергнутые лапароскопической уни- или билатеральной заместительной уретеропластике нереконфигурированным фрагментом подвздошной кишки. Критерии исключения: больные, перенесшие лапароскопические аппендикулярную, толсто- или тонкокишечную пластики реконфигурированными сегментами, а также их сочетание с лоскутом Boari.
Ограничений по полу, возрасту, массе тела или других не было. Изучали этиологию протяженных стриктур и облитераций мочеточника. Определяли частоту развития и структуру интра- и послеоперационных осложнений, причины конверсий доступа, продолжительность операции и стационарного пребывания больных. Функциональные итоги оценивали на основании данных экскреторной уро- или томографии, проводившихся через каждые полгода после операции.
Техника операции. Несмотря на схожесть общих принципов выполнения интестинопластики, каждая операция индивидуальна и обладает своими неповторимыми особенностями. В исследованной когорте больных при билатеральном замещении кишечные сегменты располагали как «U»-образно, так и в виде «Γ» или «7». В случаях односторонней реконструкции изолированный участок кишки имплантировали между лоханкой и мочевым пузырем изоперистальтически, формируя анастомозы так, как описано ранее [7]. Здесь же приводится нестандартная техника левосторонней лапароскопической трансмезентериальной илеоуретеропластики в сочетании с методикой Psoas-hitch. Видеопротокол операции доступен по адресу: https://youtu.be/IeA60pSiUBE.
Положение больного на спине с поворотом операционного стола на «здоровую» сторону. Оптика в пупочном кольце. Рабочие троакары – в эпигастрии, подвздошной области и параректально, между оптическим и портом в подвздошной области. Во время операции пациента по мере необходимости переводили из положения Фовлера в Тренделенбурга и обратно. После ревизии брюшной полости и рассечения спаек в мезоколон нисходящей кишки формировали «окно», ограниченное нижнебрыжеечной веной, ветвями левых ободочных сосудов и дугой Риолана. Проводя диссекцию меж фасций Тольда и Герота, обнажали забрюшинное пространство в проекции ворот почки, при этом сосуды частично выделяли для контроля и анатомической ориентировки. Лоханку освобождали из рубцов в максимально возможном, но безопасном объеме. Следующим этапом осуществляли мобилизацию и Psoas- hitch-фиксацию мочевого пузыря, следуя цели сокращения протяженности, требуемого для замещения мочеточника, фрагмента подвздошной кишки. Необходимую и достаточную длину последнего определяли, примеряя сегмент до его резекции: фиксировав атравматическим зажимом к лоханке стенку кишки, ее расправляли вниз до места предполагаемого анастомоза с мочевым пузырем. Убедившись в его адекватности, фрагмент резецировали, а непрерывность кишечника восстанавливали сшивающими аппаратами по традиционной методике. Трансплантат располагали изоперистальтически по отношению к лоханке, а после ее вскрытия формировали интракорпоральный анастомоз конца кишки с просветом лоханки на внутреннем стенте. Переходя к дистальной реконструкции, в брыжейке сигмовидной кишки формировали дополнительное «окно», через которое свободный конец неоуретера подводили к мочевому пузырю, в самой «высокой» точке которого вырезали отверстие соответствующего диаметра. Каудальный анастомоз выполнялся после проведения дистальной части внутреннего стента в полость мочевого пузыря. Все описанные анастомозы между лоханкой, концами кишки и мочевым пузырем исполнялись непрерывным однорядным швом (Vicryl 3/0) с проведением иглы через всю толщу тканей. Герметичность проверяли, вводя физиологический раствор через нефростому и уретральный катетер. Последние удаляли через 7–10 дней, выполнив антеградную пиелографию (рис. 1).
Полученные результаты сведены в единую базу данных и подвергнуты статистической обработке с использованием пакета прикладных программ «STATISTICA».
Результаты. Полученные данные приведены в табл. 1. Критериям включения соответствовали 40 пациентов, из них 23 (57,5%) женщины. Средний возраст составил 48,4 (27–70) года, индекс массы тела – 29,3 (23–40) кг/м2.
Билатеральное замещение предпринято в отношении 8 больных, унилатеральное – 32, причем 20 из них справа. Чаще всего показанием к операции служили протяженные стриктуры и облитерации мочеточников, явившиеся осложнением эндоурологических вмешательств на верхних мочевыводящих путях и лучевой терапии. Таких пациентов в нашем исследовании было 13 и 11 соответственно. Продолжительность вмешательства составила 335 (150–680) мин при объеме кровопотери 221 (50–400) мл; необходимости в гемотрансфузии не возникло ни разу.
 Интраоперационные осложнения возникли трижды (7,5%). В 1 (2,5%) случае на фоне выраженных инфильтративно-воспалительных изменений в области ворот почки при мобилизации лоханки произошло ранение почечной вены. В другом при проведении тотального адгезиолизиса ушивались десерозированные участки кишки. Описанные повреждения устранены интракорпоральным мануальным швом. В третьем наблюдении тщетные попытки безопасного разделения спаечного конгломерата сопровождались множественными перфорациями кишечника. В результате произведена резекция тонкой кишки в пределах здоровых тканей, а проходимость ее восстановлена анастомозом «бок-в-бок» сшивающим аппаратом. Все эти операции завершены лапароскопически без конверсий доступа и послеоперационных осложнений. Впрочем, избежать последних нам не удалось, а их обобщенный показатель достиг 12,5%. Так, дополнительного медикаментозного лечения (Clavien I) потребовали 2 (5%) больных. Трижды (7,5%) нам пришлось прибегать к повторным вмешательствам (Clavien III). Причем в первом случае возникла необходимость в цисто- и «неоуретероскопии» с заменой свернувшегося в клубок внутреннего стента, послужившего причиной подтекания мочи по страховому дренажу брюшной полости. У второго больного клиника острой кишечной непроходимости потребовала срочного хирургического вмешательства на третьи послеоперационные сутки. Выполнена релапароскопия, ревизия брюшной полости. Причиной обструкции стало отсутствие адекватной проходимости аппаратного тонко-тонкокишечного анастомоза – лапароскопическая резекция анастомоза с формированием нового. И первая пациентка и второй больной провели в стационаре по 14 дней, включая предоперационный период, а возникшие осложнения, на наш взгляд, незначительно повлияли на период реабилитации. Чего нельзя сказать о третьем больном, в судьбе которого череда случайностей и трагическое стечение обстоятельств едва не поставили под сомнение саму возможность благополучного исхода.
Интраоперационные осложнения возникли трижды (7,5%). В 1 (2,5%) случае на фоне выраженных инфильтративно-воспалительных изменений в области ворот почки при мобилизации лоханки произошло ранение почечной вены. В другом при проведении тотального адгезиолизиса ушивались десерозированные участки кишки. Описанные повреждения устранены интракорпоральным мануальным швом. В третьем наблюдении тщетные попытки безопасного разделения спаечного конгломерата сопровождались множественными перфорациями кишечника. В результате произведена резекция тонкой кишки в пределах здоровых тканей, а проходимость ее восстановлена анастомозом «бок-в-бок» сшивающим аппаратом. Все эти операции завершены лапароскопически без конверсий доступа и послеоперационных осложнений. Впрочем, избежать последних нам не удалось, а их обобщенный показатель достиг 12,5%. Так, дополнительного медикаментозного лечения (Clavien I) потребовали 2 (5%) больных. Трижды (7,5%) нам пришлось прибегать к повторным вмешательствам (Clavien III). Причем в первом случае возникла необходимость в цисто- и «неоуретероскопии» с заменой свернувшегося в клубок внутреннего стента, послужившего причиной подтекания мочи по страховому дренажу брюшной полости. У второго больного клиника острой кишечной непроходимости потребовала срочного хирургического вмешательства на третьи послеоперационные сутки. Выполнена релапароскопия, ревизия брюшной полости. Причиной обструкции стало отсутствие адекватной проходимости аппаратного тонко-тонкокишечного анастомоза – лапароскопическая резекция анастомоза с формированием нового. И первая пациентка и второй больной провели в стационаре по 14 дней, включая предоперационный период, а возникшие осложнения, на наш взгляд, незначительно повлияли на период реабилитации. Чего нельзя сказать о третьем больном, в судьбе которого череда случайностей и трагическое стечение обстоятельств едва не поставили под сомнение саму возможность благополучного исхода.
Пациент 66 лет, страдавший ожирением (40 кг/м2) и сахарным диабетом, в связи с протяженной стриктурой левого мочеточника вследствие множественных уретероскопий перенес без осложнений лапароскопическую заместительную илеопластику. Продолжительность вмешательства составила 370 мин, кровопотеря – 250 мл. Послеоперационный период сопровождался непродолжительным парезом кишечника, требовал постоянного внимания к сопутствующей патологии, но протекал без серьезных осложнений и спустя 2 нед. пациент был подготовлен к выписке. Раны зажили первичным натяжением, швы сняты. Оформляя листок нетрудоспособности, больной отметил внезапное появление резкой спастической боли в животе, сопровождавшейся тошнотой и рвотой. Верифицирована острая тонкокишечная непроходимость, причиной которой стало подкожное ущемление петли тощей кишки в раневом канале 12-мм троакара. Принимая во внимание отсутствие ишемических изменений и повреждений компримированного сегмента, объем экстренной операции ограничился мини-лапаротомией через описанную рану предыдущего вмешательства, ревизией и послойным ушиванием передней брюшной стенки. Ранняя диагностика, своевременная и адекватная хирургическая тактика позволили максимально снизить возможные риски и степень хирургической травмы. Однако еще через девять дней пациент в очередной раз прооперирован в связи с эвентрацией. Несмотря ни на что, он был выписан с выздоровлением через 35 дней от момента поступления в стационар. Безусловно, приведенный клинический пример несущественно повлиял на статистические данные, и средние сроки стационарного лечения пациентов в нашем исследовании составили 13,5 (10–35) дней. Тем не менее этот случай демонстрирует необходимость мультидисциплинарного подхода к заместительным кишечным пластикам.
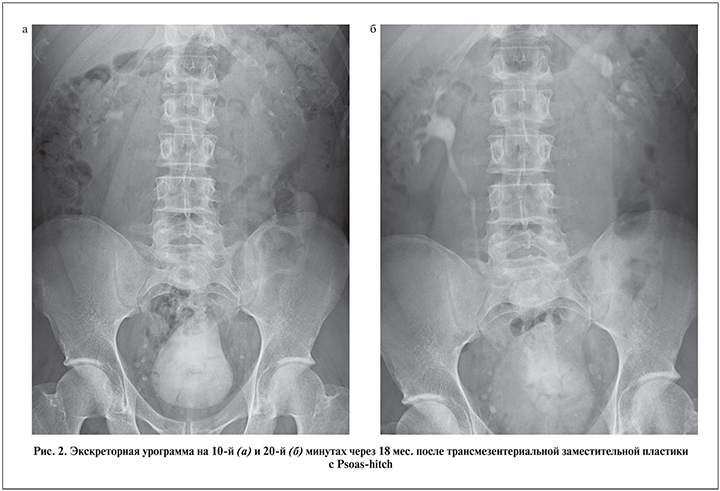
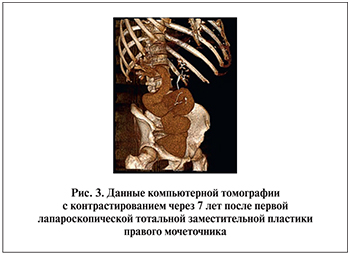
Лишь 4 из 40 наших больных проигнорировали программу послеоперационного мониторинга в связи с низким комплаенсом. Изучив катамнез 36 пациентов в сроки от 6 мес. до 7 лет, мы не обнаружили каких-либо отсроченных осложнений, значимых метаболических или уродинамических нарушений, равно как и угнетения функции почек (рис. 2, 3).

Обсуждение. История заместительной кишечной пластики мочеточников насчитывает более 110 лет. Однако до сих пор это вмешательство остается редким, а литературные источники, отражающие его результаты, немногочисленны. После того как W. Goodwin [4] описал первую серию подобных операций, в подавляющем большинстве публикаций освещались лишь технические аспекты хирургии и ближайшие периоперационные данные. Работы, оценивавшие отдаленные функциональные исходы, появились только в начале XXI в. Так, F. J. Verduyckt et al., изучая уродинамику после кишечной пластики мочеточников, выяснили, что в исследованной группе из 8 пациентов, оперированных с 1981 по 2000 г., функция почки до и после реконструктивного вмешательства не отличалась даже спустя 65 месяцев [8]. Через 3 года Chung et al., проведя анализ лечения 52 подобных больных со сроком наблюдения до 6 лет, пришли к аналогичным выводам, а частота развития серьезных осложнений в когорте исследования не превысила 10,5% [9]. Самой крупной из современных работ остается «Долгосрочные результаты илеоуретеропластики: 25-летний опыт одной клиники» A. Kocot et al., увидевшей свет в конце 2016 г. С 1991 по 2016 г. заместительной кишечной пластике мочеточников подвергнуты 157 пациентов, причем 52 из них оперированы с двух сторон. «Неоуретеры» имплантировались в мочевой пузырь 79, в кишечный рзервуар – 70 и 8 больным – на кожу. Спустя 54 мес. наблюдений авторы отметили регресс гидронефроза в 62%, а улучшение функции почки – в 94% случаев. Отсроченные (через 18–36 мес.) повторные вмешательства потребовались 6 из 157 человек. Дважды чрезмерное растяжение и деформация трансплантата приводили к выраженным рецидивирующему ацидозу и угнетению функции почки. Это посужило показанием к лапаротомии, ревизии, адгезиолизису и дистальной резекции излишков илеоуретера. В остальных случаях выполнялись открытые и эндоскопические вмешательства в связи с обструкцией восстановленных мочевых путей пробкой кишечной слизи. К сожалению, авторы продемонстрировали отдаленные результаты вмешательств в общей когорте больных без стратификации по видам реимплантации. Однако именно в этой работе выявлена корреляция между длиной интестинального сегмента, используемого для пластики, и такими поздними осложнениями, как его дилатация и «kinking», обструкция кишечной слизью и грубый ацидоз [10].
В России максимальным опытом заместительной реконструктивной хирургии мочеточников располагает клиника профессора Б. К. Комякова. Так, до 2015 г. на кафедре урологии СЗГМУ им. И. И. Мечникова выполнено более 150 открытых операций с использованием различных отделов желудочно-кишечного тракта, включая 78 нереконфигурированных илеопластик. Результаты колоссальной научной и методической работы нашли отражение в монографии «Кишечная и аппендикулярная пластика мочеточников», являющейся настольной книгой всех русскоязычных урологов [11]. Отдавая должное перспективам минимально инвазивной хирургии в урологии, авторы прогнозировали постепенное расширение показаний к лапароскопической заместительной пластике мочеточника. А в 2016 г. уже поделились собственными результатами 6 лапароскопических уретероилеоцистоанастомозов больным, не имевшим в анамнезе лапаротомий и радиотерапии. Оценив потенциал подобных вмешательств, авторы подвергли сомнению преимущество лапароскопической перед открытой илеоуретеропластикой при выраженных постлучевых изменениях тканей, тяжелом послеоперационном спаечном процессе в брюшной полости, выраженном педункулите со склерозирующим паранефритом и двусторонних протяженных стриктурах [12].
Впервые в мировой практике лапароскопическая тотальная заместительная илеопластика человеку была выполнена I. Gill в 2000 г. Несмотря на продолжительность операции, длившейся 8 ч, интра- и послеоперационных осложнений не отмечено, объем кровопотери был минимальным, а пациентка выписана на 4-е послеоперационные сутки. Впрочем, прекрасные результаты первоначального опыта не послужили популяризации метода. Обратившись к мировой литературе, за прошедшее с тех пор время лапароскопической кишечной пластике было посвящено лишь несколько работ с сериями, не превысившими в общей сложности 20 наблюдений [5, 6, 13–19]. Поиск в системе PubMed позволил обнаружить еще два экспериментальных исследования на животных [20–21]. Из всех этих публикаций только четыре освещали полностью интракорпоральную лапароскопическую технику, причем два из них – на свиньях и с реконфигурацией лоскута [18–21]. По мере развития роботической хирургии появились сообщения и о робот-ассистированной илеопластике [6, 19, 22–26]. Однако максимальное количество больных в группе исследования не превысило 7. Более того, все авторы отметили, что для работы на различных этажах брюшной полости приходилось неоднократно прибегать к редокингу, что неудобно и существенно тормозит ход вмешательства.
В табл. 2 приведены основные результаты вышеупомянутых работ. При сравнении опубликованных данных вызывает интерес существенный разброс показателей времени операции и сроков госпитализации. Так, в клиническом наблюдении A. Sim et al. [18] лапароскопическая заместительная пластика выполнена полностью интракорпорально за 2,5 часа. Тогда как I. Gill, оперируя из комбинированного доступа (этап резекции и восстановления кишки проведен из мини-лапаротомии), потратил на это 8 [5]. При этом его пациентка выписана на 4-е сутки, а средний койко-день после интракорпоральных робот-ассистированных реконструкций в статье B. Ubrig et al. составил 14 дней [24].
Конечно, количество пациентов в приведенных группах не позволяет достоверно оценивать полученные данные. Тем не менее объяснение видится в следующем. Несомненно, операционное время напрямую зависит не только от опыта хирурга, но и от конкретной исходной клинической и интраоперационной ситуации. Так, в нашем исследовании продолжительность вмешательства варьировалась от 150 до 680 мин. В первом случае произведено левостороннее субтотальное замещение молодой худой пациентке после осложненной гистерэктомии. Самая длительная операция была выполнена пожилой даме, страдавшей ожирением и диабетом, перенесшей ранее множество лапаротомий. Поводом для тотальной правосторонней илеопластики послужил мощный рубцовый процесс на фоне адъювантной лучевой терапии рака шейки матки и паранефрита. При ретроспективном анализе этапов операции выяснилось, что значимую часть времени отнял адгезиолизис, т.к. мощный спаечный процесс брюшной полости не позволял не только выбрать оптимальный и адекватный фрагмент кишки, но и осуществить доступ в забрюшинное пространство. Более того, отсутствие возможности безопасного разделения межкишечного спаечного конгломерата потребовало его иссечения – произведена резекция тонкой кишки с формированием интракорпорального анастомоза. Наконец, выделение лоханки на фоне выраженного педункулита и склерозирующего паранефрита не ускорило завершения операции.
Обратив внимание на сроки стационарного лечения больных, в приведенных источниках они колебались в диапазоне от 3 до 12,5 дней. Безусловно, необходимость повторных вмешательств и коррекция осложнений влияют на продолжительность лечения, но немаловажным фактором остается принцип организации работы конкретной клиники. Сравнительный анализ указанных публикаций не возможен не только по причине малочисленности групп исследования, но и вследствие особенностей системы здравоохранения стран, гражданами которых авторы являются. Например, «Fast track» – хирургия в сочетании с особенностями финансирования и организации амбулаторного патронажа, позволяет урологам Гренобля выписывать больных с дренажами в течение 12 ч после роботической простатэктомии [27]. В России на сегодняшний день подобные подходы представляются маловероятными. В собственном исследовании средние сроки стационарного пребывания составили 13,5 дней. Как правило, за это время удавалось добиться полной реабилитации и удалить все дренажи, включая внутренние стенты, исключив необходимость каких-либо манипуляций на амбулаторном этапе лечения иногородних больных.
Возвращаясь к отдаленным функциональным результатам, необходимо отметить единодушное мнение экспертов о корреляции длины и расположения кишечного сегмента, а также диаметра анастомозов с отсроченными осложнениями. Чем более длинная петля используется для замещения, тем выше риск реабсорбционных метаболических нарушений. Как показали исследования A. Kocot и W. Zhong, спустя несколько лет после реимплантации илеоуретер существенно дилатируется, особенно если был расположен антиперистальтически. Последнее обусловливает развитие выраженного ацидоза и рефлюкс-пиелонефрита, равно как и способствует образованию пробки из кишечной слизи, потенциально грозящей обструкцией. При формировании каудального соустья «бок кишки-в-пузырь», авторы рекомендуют не просто рассекать стенки кишки и мочевого пузыря так, как это принято при межкишечных анастомозах, а вырезать в них «окна» соответствующего диаметра. При использовании техники «конец кишки-в пузырь», диаметр мочепузырного отверстия должен соответствовать просвету трансплантата. Это исключит стеноз анастомоза и его обтурацию слизью, а изоперистальтическая имплантация послужит профилактикой рефлюкса [10, 28]. В нашей работе репликация принципов открытой хирургии в лапароскопическую обеспечила достижение функциональных результатов, не уступающих таковым при традиционных вмешательствах, при несомненно меньшей травматичности. Описанная выше техника трансмезентериальной заместительной кишечной пластики в сочетании с Psoas-hitch в некоторых ситуациях может рассматриваться в качестве альтернативы. С одной стороны, использование окон в брыжейке нисходящей и сигмовидной кишки позволяет расположить кишечный фрагмент по кротчайшей прямой. С другой стороны, подтягивание мочевого пузыря к поясничной мышце дополнительно сокращает расстояние. Подобный маневр помогает существенно сократить длину илеоуретера.
Заключение. Безусловно, проведенный анализ не лишен недостатков. Это ретроспективное и нерандомизированное исследование в отсутствие контрольной группы сравнения. Тем не менее представленный материал наибольший из доступных в литературе, а результаты, включая отдаленные функциональные исходы, демонстрируют эффективность и безопасность лапароскопических технологий в лечении этой категории больных. Вне зависимости от доступа – открыто или лапароскопически – тотальная заместительная кишечная пластика мочеточников остается редким и технически сложным вмешательством, сочетающим тысячу нюансов и множество подводных камней.



