Введение. В настоящее время лапароскопическая пиелопластика (ЛП) является методом выбора при оперативном лечении больных первичными сужениями пиелоуретерального сегмента (ПУС) [1–3]. Эффективность ЛП составляет более 90%, что сравнимо с результатами открытой пиелопластики. Среди предложенных методов чаще применяется методика Хайнс–Андерсена, когда суженный ПУС резецируют и проводят спатуляцию мочеточника, затем выполняют анастомоз между неизмененными участками мочевых путей. Критерии успеха пиелопластики: нормализация уродинамики верхних мочевыводящих путей (ВМП), ликвидация клинических симптомов и улучшение показателей радиологических исследований. Однако неудовлетворительные результаты после пиелопластики наблюдаются в 4–10% случаев [4–7]. Так, B. L. Jacobs et al. [8] проанализировали результаты 1125 лапароскопических и 775 открытых пиелопластик и 1315 эндопиелотомий, частота рецидивов после которых составила 7, 9 и 15% соответственно. Неудачи ЛП могут быть как на ранних, так и на поздних сроках после операции. При неадекватной проходимости пиелоуретероанастомоза после извлечения стента наблюдается расширение чашечно-лоханочной системы (ЧЛС), проявляющееся болью и инфекцией ВМП. В подобных ситуациях нередко приходится устанавливать мочеточниковый стент или выполнять пункционную нефростомию. По мере лечения инфекции и ликвидации воспалительного отека в зоне анастомоза может восстановиться нормальная уродинамика ВМП. Неудачи на поздних этапах могут также возникать через 2 или более лет после операции [4]. Сохранение расширения ЧЛС, периодические обострения хронического пиелонефрита, болевой синдром на поздних сроках наблюдения могут свидетельствовать о неэффективности пиелопластики. Ретроградная эндопиелотомия ввиду меньшей инвазивности является привлекательным методом лечения рецидивной обструкции ПУС. Однако ее эффективность после ранее перенесенной пиелопластики остается невысокой [9–12], что, на наш взгляд, можно объяснить несколькими факторами. Во-первых, при эндопиелотомии проводится рассечение циркулярной стриктуры в одном или двух местах, тогда как рубцовая ткань оставшейся части анастомоза остается. Во-вторых, глубокое рассечение мочеточника до парауретеральной клетчатки приводит к затеку мочи, обусловливающей формирование новых рубцов в зоне ПУС.
Радикальным методом лечения пациентов с рецидивной стриктурой ПУС служит повторная пиелопластика, которую можно также выполнять лапароскопическим доступом. В литературе представлено несколько сообщений о результатах подобных операций [13–16].
Цель настоящей работы: проанализировать наш опыт повторной ЛП больным рецидивной стриктурой ПУС.
 Материалы и методы. В клинике урологии СЗГМУ им. И. И. Мечникова с февраля 2010 по март 2018 г. ЛП выполнена 178 больным. У 18 (10,1%) из них была выявлена рецидивная обструкция ПУС. Мужчин было 11, женщин – 7, средний возраст составил 36,5±8,0 лет. Обструкция ПУС слева диагностирована у 12 прооперированных, справа – у 6. Ранее 10 больным была выполнена открытая пиелопластика, 8 – ЛП. Пациентов с обструкцией ПУС, не связанной с предыдущей пиелопластикой, в исследование не включали. Перед операцией всем больным выполняли внутривенную урографию, УЗИ и компьютерную томографию почек, динамическую реносцинтиграфию. По результатам сцинтиграфии почек на стороне поражения выявлен обструктивный тип кривой (табл. 1).
Материалы и методы. В клинике урологии СЗГМУ им. И. И. Мечникова с февраля 2010 по март 2018 г. ЛП выполнена 178 больным. У 18 (10,1%) из них была выявлена рецидивная обструкция ПУС. Мужчин было 11, женщин – 7, средний возраст составил 36,5±8,0 лет. Обструкция ПУС слева диагностирована у 12 прооперированных, справа – у 6. Ранее 10 больным была выполнена открытая пиелопластика, 8 – ЛП. Пациентов с обструкцией ПУС, не связанной с предыдущей пиелопластикой, в исследование не включали. Перед операцией всем больным выполняли внутривенную урографию, УЗИ и компьютерную томографию почек, динамическую реносцинтиграфию. По результатам сцинтиграфии почек на стороне поражения выявлен обструктивный тип кривой (табл. 1).
При рецидивной обструкции ПУС операцию выполняли лапароскопическим доступом. В положении больного на боку в подвздошной области устанавливали первый троакар 7 или 11 мм для лапароскопа, производили инсуфляцию до 12 мм рт.ст. Далее проводили еще 3 троакара: по подключичной линии два троакара 6 мм в подвздошной области и ниже реберной дуги, а один 6 мм по задней аксиллярной линии. После мобилизации толстой кишки и ее медиального отведения идентифицировали мочеточник на протяжении верхней трети. Дальнейшее выделение ПУС и лоханки было относительно легким у пациентов, которым первичную пиелопластику выполняли открытым ретроперитонеальным доступом. Рубцово-спаечный процесс у них в основном располагался по задней поверхности почки вне зоны чрезбрюшинного доступа. У больных после трансперитонеальной ЛП повторную пиелопластику осуществляли через зону первоначальной операции, где уже были рубцовые изменения. При выделении ПУС и лоханки необходимо максимально иссекать рубцовые ткани вокруг мочевых путей, что способствует формированию адекватного анастомоза и достижению хорошего функционального результата.
Всем пациентам выполнена чрезбрюшинная ЛП по Хайнс–Андерсену. После резекции рубцово-измененного суженного ПУС узловыми швами формировали заднюю полуокружность анастомоза и после антеградного проведения стента ушивали его переднюю часть. Устанавливали дренаж и выполняли перитонизацию зоны операции.
В послеоперационном периоде проводили антибактериальную и симптоматическую терапию. После извлечения дренажа больного выписывали на амбулаторное лечение. Стент удаляли амбулаторно через 4–6 нед., в динамике выполняли УЗИ почек, экскреторную урографию и динамическую сцинтиграфию. Успех лечения оценивали с помощью экскреторной урографии и динамической сцинтиграфии почек.
Результаты. Все повторные ЛП были успешными, конверсий не было. Средняя продолжительность операции составила 105,5±28 мин. Она была более длительной у больных, которым ранее выполняли трансперитонеальную ЛП. После открытой пластики гидронефроза, произведенной ретроперитонеальным доступом, повторная ЛП оказалась менее сложной. Средняя потеря крови составила 60,0±20,5 мл.
Интраоперативных осложнений не было, а послеоперационные наблюдались у 3 (16,7%) больных: у 2 – лихорадка (II ст. по Клавьену), у 1 – подтекание мочи (I ст. по Клавьену). Дополнительных вмешательств (пункционная нефростомия, замена стента) не проводили. За период наблюдения (от 10 до 38 мес.) операция была признана неуспешной для 1 (5,4%) из 18 больных, в последующем ему проведено эндопротезирование ПУС нитиноловым стентом.
Приводим одно из клинических наблюдений повторной успешной ЛП при рецидивной стриктуре ПУС правой почки.
 П а ц и е н т к а Г. 71 года госпитализирована в плановом порядке с жалобами на наличие нефростомического дренажа справа. В анамнезе открытая пиелопластика 18 лет назад.
П а ц и е н т к а Г. 71 года госпитализирована в плановом порядке с жалобами на наличие нефростомического дренажа справа. В анамнезе открытая пиелопластика 18 лет назад.
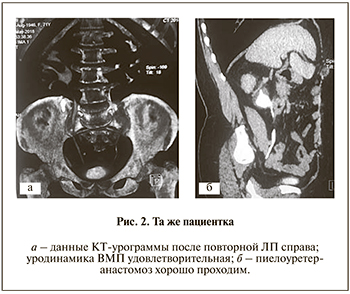
В течение последних двух лет отмечала боли в пояснице справа и частые обострения хронического пиелонефрита. Во время последнего стационарного лечения в связи с обструктивным пиелонефритом выполнена пункционная нефростомия справа. При обследовании в нашей клинике проведена антеградная пиелография, в ходе которой была визуализирована облитерация ПУС (рис. 1), подтвержденная данными ретроградной уретерографии. Функция обеих почек по данным сцинтиграфии удовлетворительная. С учетом облитерации ПУС, наличия нефростомического дренажа и частых атак пиелонефрита решено выполнять ЛП справа. Троакары установлены по вышеописанной методике. Чрезбрюшинно выделены ПУС и лоханка правой почки, иссечены парауретеральные рубцовые ткани. Измененный ПУС резецирован на протяжении 2 см, мочеточник спатулирован, на стенте выполнен пиелоуретеранастомоз. Интра- и послеоперационных осложнений не было. Страховой дренаж удален на 2-е сутки, нефростома – на 5-й день после операции, больная выписана на амбулаторное лечение. Стент удален амбулаторно через 6 нед. В настоящее время состояние больной удовлетворительное, жалоб нет. На КТ-урограмме через 18 мес. после операции уродинамика ВМП удовлетворительная, ПУС справа адекватно проходим (рис. 2).
 В данном клиническом наблюдении использование современной лапароскопической техники позволило ликвидировать рецидивную ОПУС слева.
В данном клиническом наблюдении использование современной лапароскопической техники позволило ликвидировать рецидивную ОПУС слева.
Обсуждение. В настоящее время оперативное лечение больных с первичными сужениями ПУС не вызывает серьезной дискуссии, так как методом выбора служит ЛП. Сложности возникают при рецидивных стриктурах ПУС, которые в основном наблюдаются после открытой или лапароскопической пиелопластики. Малоинвазивным способом их лечения является ретроградная эндопиелотомия, процент успеха которой остается высоким [9–12]. Однако причина обструкции ПУС в этих сериях довольно вариабельны: например, в группу эндопиелотомии наряду с пиелопластикой включены пациенты с обструкцией ПУС после перкутанной нефролитотрипсии и других эндоурологических вмешательств на ВМП. Возможно, высокий успех эндопиелотомии в этих сериях связан с небольшим количеством пациентов с рецидивной обструкцией ПУС после открытой или лапароскопической пиелопластики. Так, T. Patel et al. [10] ретроградную эндопиелотомию выполняли 41 больному рецидивной обструкцией ПУС, и только 14 из них ранее подвергались пиелопластике. Несомненно, эндопиелотомия в отличие от повторной пиелопластики является менее инвазивным вмешательством и нередко применяется в отношении пациентов с рецидивной стриктурой ПУС. При ее неэффективности вновь возникает вопрос о резекции суженного ПУС. Открытая повторная пиелопластика демонстрировала сравнительно лучшие результаты относительно эндопиелотомии [13, 17, 18], и она активно применялась до эры эндовидеохирургии.
С активным внедрением лапароскопии повторная ЛП стала альтернативой открытой пластике ПУС. При лапароскопическом доступе может потребоваться больше времени для выделения ПУС и лоханки из рубцовых тканей, но количество послеоперационных осложнений и сроки госпитализации и реабилитации пациентов меньше, чем при открытом вмешательстве [14–16].
Количество оперированных больных рецидивной обструкцией ПУС, которым выполнена повторная ЛП, редко превышает нескольких десятков. С. Р. Sundaram et al. [14] сообщили о самом большом опыте подобных операций (36 пациентов) с успехом 83%. Тем не менее только 3 (8,3%) из них ранее подвергались пиелопластике, в то время как в нашем исследовании всем 18 пациентам была выполнена пластика ПУС. В работе [16] 36 (94,7%) из 38 пациентов ранее перенесли пиелопластику.
В нашем исследовании, по данным радионуклидного исследования, неудача констатирована в отношении 1 из 18 пациентов. Этот показатель не отличается от таковых, полученных другими авторами при лечении первичной обструкции ПУС [1 – 3, 5]. Это можно объяснить тем, что все операции выполнялись лапароскопической хирургической бригадой с достаточным опытом в эндовидеохирургической реконструкции различных отделов мочеточника. Повторная ЛП может быть очень сложной операцией, а иногда и невыполнимой из-за невозможности мобилизации лоханки и протяженности ПУС. В подобных ситуациях хирург должен быть готовым к эндовидеохирургическому выполнению таких редких реконструктивных вмешательств, как уретерокаликоанастомоз по Нейверту [19, 20], к илеоуретеропластике реконфигурированным сегментом тонкой кишки по Yang–Monti или аппендиксом [21, 22]. В нашей серии наблюдений рецидивные стриктуры были короткими. Однако для формирования широкого анастомоза без натяжения во всех случаях нам приходилось мобилизовывать почку и верхнюю треть мочеточника. Для успешной пиелопластики необходимо максимально сохранять сосуды мочеточника и лоханки, создавать широкий и герметичный анастомоз. При его формировании следует быть предельно аккуратным, избегая перегибов или скручивания. Для этого необходимо в достаточном объеме выделить мочеточник и лоханку, правильно наложить первый шов. Более того, должен быть идентифицирован каждый нижнеполярный сосуд, а при его локализации кпереди от ПУС необходимо выполнять антевазальную пиелопластику. Некоторые нижнеполярные сосуды могли быть не определены как основная причина сужения ПУС во время первой операции или же хирург выполнил только транспозицию сосуда без резекции ПУС [23]. У пациентов после пиелопластики часто выявляется избыточное количество рубцовой ткани в перилоханочном пространстве. Эти изменения могут быть ассоциированы с экстравазацией мочи или чрезмерной реакцией тканей на первое хирургическое вмешательство [24]. Немаловажным этапом пиелопластики является антеградная установка стента. При его непрохождении в мочевой пузырь из-за анатомических особенностей интрамурального отдела мочеточника насильственное проталкивание стента может приводить к отрыву анастомоза, расхождению швов, негерметичности анастомоза и развитию уриномы. В подобных ситуациях рекомендуем не упорствовать с проведением стента до мочевого пузыря, максимально устанавливать его в мочеточник и лоханку, формировать анастомоз. После удаления троакаров можно уложить пациента в литотомическое положение, выполнить уретероскопию и низвести дистальный конец стента в мочевой пузырь.
Данная работа имеет несколько ограничений. Во-первых, короткие сроки послеоперационного наблюдения. Во-вторых, все операции выполнялись хирургом с достаточным опытом в лапароскопической пластике мочеточника, что не позволяет обобщить полученные результаты с данными центров с лимитированным количеством подобных вмешательств. В-третьих, исследование ретроспективное и несравнительное. В связи с этим считаем необходимым дальнейшее накопление опыта выполнения подобных операций, проведение сравнительного анализа их результатов с таковыми у пациентов с первичным гидронефрозом и изучение отдаленных результатов повторной пиелопластики.
Заключение. Достаточный опыт в эндовидеохирургической хирургии мочеточника позволяет лапароскопическим доступом ликвидировать рецидивные стриктуры ПУС с низкой частотой послеоперационных осложнений и высокой степенью успеха.



