Введение. Трансуретральная хирургия предстательной железы является одной из наиболее часто выполняемых групп урологических вмешательств у мужчин, а резекция простаты до сих пор считается «золотым» стандартом хирургического лечения доброкачественной гиперплазии предстательной железы (ДГПЖ) [1, 2]. Однако наряду с очевидными достоинствами эндоурологические вмешательства на предстательной железе несут некоторые ограничения. Осложнения трансуретральной резекции простаты (ТУРП) включают развитие кровотечений, персистенции симптомов нижних мочевыводящих путей (СНМП), инфекции мочевыводящих путей (ИМП) и т.д. Последние являются потенциально угрожающими жизни осложнениями и одной из ведущих причин сепсиса, зачастую трудно поддаются контролю. Подсчитано, что смертность от ИМП увеличилась более чем на 140,18% с 1990 по 2019 г., а стандартизованный по возрасту коэффициент смертности увеличился с 2,77 по 3,13/100 000 [3–5]. Частота инфекционных осложнений при трансуретральной хирургии простаты колеблется от 0,5 до 20% [6–9]. Проблема профилактики и лечения ИМП осложняется также ростом уровня резистентности уропатогенов и вариабельностью микробного спектра мочи.
В соответствии с актуальной степенью изученности проблемы в мировой литературе и с точки зрения практической значимости мы поставили четыре важных, с нашей точки зрения, вопроса в текущем мета-анализе:
1) снижает ли антибиотикопрофилактика (АБП) уровень послеоперационной бактериурии и инфекционных осложнений у больных после трансуретральных операций на простате;
2) влияет ли продолжительность антибиотикопрофилактики на уровень послеоперационной бактериурии и инфекционных осложнений у больных после трансуретральных операций на простате;
3) связана ли дооперационная бактериурия с увеличением частоты послеоперационной бактериурии и инфекционных осложнений у пациентов после трансуретральных операций на простате;
4) есть ли связь между предоперационным уровнем общего простатспецифического антигена (ПСА) и уровнем послеоперационной бактериурии?
Таким образом, целью данной работы стал систематический анализ мировой литературы в отношении оценки бактериального статуса мочи, воспалительного статуса простаты и режимов АБП при трансуретральной хирургии простаты. Значимость исследования подтверждается и тем, что актуальные рекомендации по схемам антибиотикопрофилактики при трансуретральной хирургии простаты ссылаются на исследования периода 2002–2005 гг., что требует актуализации библиографической базы с учетом современных тенденций [10–13].
Материалы и методы
Стратегия поиска. Исследование было проведено в соответствии с рекомендациями по предпочтительным элементам отчетности для систематических обзоров и мета-анализов [14]. Поиск проводился в библиографических базах данных PubMed, ClinicalKey, Google Scholar и Cochrane с 1992 по 2022 г. (последний запрос 08.01.2023). Алгоритм поиска был разработан с использованием ключевых слов, определенных в соответствии с принципом PICOS (Patient Intervention Comparison Outcome Study type: P – population or patients, популяция или пациенты, I – intervention, вмешательство, C – comparison, сравнение и O – outcomes, исходы, S – study, исследование): доброкачественная гиперплазия предстательной железы, ДГПЖ, трансуретральная резекция простаты, ТУР ПЖ, трансуретральная энуклеация предстательной железы, ThuLEP, HoLEP, антибиотикопрофилактика, инфекции мочевыводящих путей, фебрильные осложнения, бактериурия, бактериологическое исследование мочи, ПСА. При поиске использовались следующие операторы SQL: И, ИЛИ, НЕ. Поиск ключевых слов проводился по названиям, аннотациям и в тексте статей. Мы также использовали инструмент «похожие статьи», а также анализ библиографических ссылок связанных работ. После проведения поиска было отобрано 8 рандомизированных контролируемых исследований (РКИ) [13, 15–21] и 9 нерандомизированных исследований [22–30].
Участники. Критерии включения и исключения. При проведении исследования использовалась модель критериев включения PICOS: P (пациенты) – пациенты с ДГПЖ, перенесшие трансуретральную операцию на предстательной железе; I (сравниваемые подходы) – короткие и пролонгированные режимы АБП, предоперационная бактериурия и исходный уровень общего ПСА; С (сравнение) – отсутствие/наличие АБП, дооперационная бактериурия и исходный уровень общего ПСА; О (исход) – послеоперационная бактериурия; инфекционные осложнения; S (тип исследования) – рандомизированные клинические исследования; проспективные и ретроспективные нерандомизированные исследования. Критерии исключения: отсутствие необходимых данных для оценки исходов, наличие микробиологически подтвержденной предоперационной ИМП, антибиотикотерапия в течение последнего месяца, гистологически подтвержденный рак предстательной железы.
Оценка качества. Качество включенных исследований оценивали два рецензента (первый и второй авторы) с использованием инструмента Risk of Bias 2.0 для РКИ и ROBINS-I (Cochrane Collaboration) (рис. 1) для нерандомизированных испытаний [31, 32]. В случае разногласий оценка проводилась третьим автором.
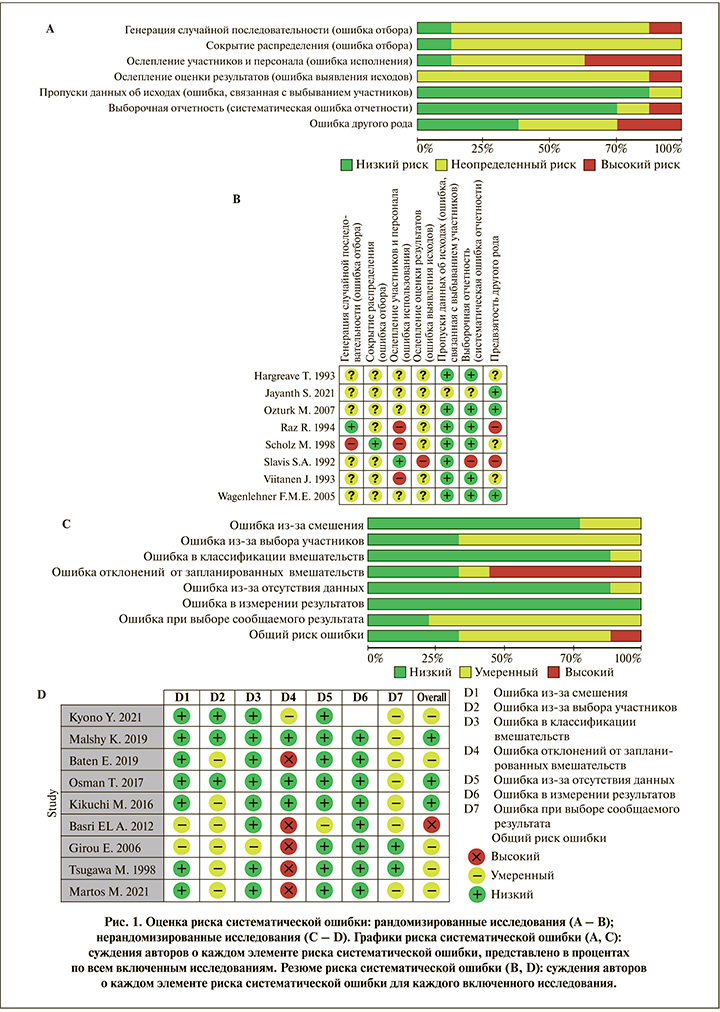
Оцениваемые исходы. Первичным оцениваемым исходом было развитие бессимптомной послеоперационной бактериурии, вторичным исходом – развитие инфекционных осложнений. Бессимптомная бактериурия определялась как выраженная бактериурия без клинических признаков и симптомов инфекции в течение 3 мес. после оперативного вмешательства. Значимый уровень бактериурии составлял не менее 103 колониеобразующих единиц (КОЕ)/мл.
Оцениваемые инфекционные осложнения включали инфекции в области хирургического вмешательства, определяемые как повышение температуры тела ≥38°C в течение 30 дней после операции, в отсутствие других подтвержденных причин развития гипертермии, а также инфекции мочевыводящих путей, подтвержденные значимой лейкоцитурией (≥10 лейкоцитов в поле зрения) и положительным результатом бактериального исследования мочи в течение 1,5 мес. после операции [33].
Статистическая обработка. Для расчета отношения шансов (ОШ) с 95% доверительным интервалом (ДИ) использовался метод Mantel–Haenszel. Для оценки непрерывных данных применялся расчет разности средних (РС) при 95% ДИ с использованием метода обратной дисперсии. Статистическую неоднородность количественно оценивали с помощью критерия Q Cochrane и теста I2. Значимую гетерогенность определяли при P<0,10 или I2>40%. Модель с фиксированным эффектом использовалась в отсутствие значимой гетерогенности; в противном случае использовалась модель случайных эффектов [34, 35]. Анализ данных был выполнен с использованием программного обеспечения Review Manager (RevMan 5.4.1).
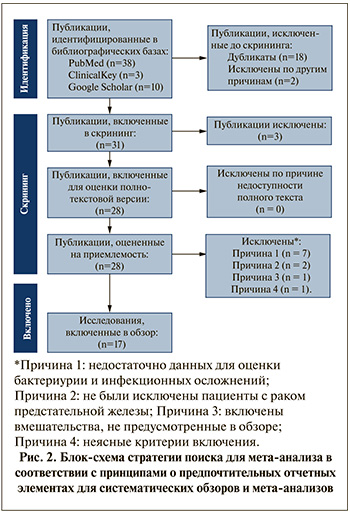
Результаты. В соответствии с алгоритмом поиска найдено 28 публикаций, 11 из которых были исключены, а 17 исследований были включены в анализ: 8 рандомизированных контролируемых испытаний (РКИ) [13, 15–21] и 9 нерандомизированных исследований [22–30]. В совокупности в исследованиях приняли участие 4778 пациентов. Период наблюдения варьировался от 10 дней до 4 мес. Алгоритм отбора исследований для проведения мета-анализа показан на блок-схеме PRISMA (рис. 2).
1) Влияние антибиотикопрофилактики на развитие бактериурии и инфекционных осложнений у больных после трансуретральной хирургии простаты. Для оценки послеоперационной бактериурии отобрано 7 исследований (2233 пациента) [13, 15–17, 19, 21, 28]. Среди методов антибиотикопрофилактики преобладал однодозовый режим по сравнению с многодозовым. Наиболее часто применялись противомикробные препараты цефалоспоринов 3-го поколения (реже – 2-го поколения), фторхинолонов и триметоприма/сульфаметоксазола. В большинстве исследований диагностически значимый уровень послеоперационной бактериурии составлял 105 КОЕ/мл [15, 17–19, 21], реже – 104 КОЕ/мл [28] и 103 КОЕ/мл [13].
Анализ (рис. 3 (А)) показал, что частота послеоперационной бактериурии составила 15,2% (200 из 1317) в группе антибиотикопрофилактики и 30,1% (276 из 916) в группе без профилактики. В соответствии с критерием Q Cochrane статистически значимой неоднородности не выявлено (p>0,1, I2=26%). Мета-анализ показал частоту послеоперационной бактериурии в группе применения АБП статистически значимо ниже по сравнению с группой без профилактики [ОШ=0,35, ДИ: 0,28, 0,44].


Для оценки развития инфекционных осложнений отобрано 7 исследований (2576 больных) [15, 17–21, 24]. Аналогично однодозовый режим преобладал над многодозовым. Наиболее часто применялись противомикробные препараты цефалоспоринов 3-го поколения (реже – 2-го поколения), фторхинолонов и триметоприма/сульфаметоксазола. В большинстве исследований диагностически значимым был уровень послеоперационной бактериурии 105 КОЕ/мл [15, 17–19, 21, 24], в одном исследовании – 104 КОЕ/мл [20]. Срок наблюдения составил от 2 до 6 нед.
Анализ показал, что частота инфекционных осложнений в послеоперационном периоде составила 6,5% (79 из 1221) в группе профилактики и 15,6% (211 из 1355) – в группе без профилактики (рис. 3 (B)). В соответствии с критерием Q Cochrane данные имеют значительную гетерогенность (Р<0,1, I2=85%). Мета-анализ продемонстрировал преимущество использования антибиотикопрофилактики в снижении частоты инфекционных осложнений в послеоперационном периоде, результат статистически значимый [ОШ=0,31, ДИ: 0,13, 0,73].
2) Влияние продолжительности антибиотикопрофилактики на частоту инфекционных осложнений после трансуретральной хирургии простаты. Для анализа частоты инфекционных осложнений в послеоперационном периоде отобрано три исследования (1083 пациента) [15, 16, 29].
С учетом дизайна исследований сравнение проведено между однодневным режимом дозирования (менее 24 ч) и многодозовым режимом (от 3 до 5 дней).
Мета-анализ показал, что частота инфекционных осложнений в послеоперационном периоде составила 10,3% (56 из 541) в группе однодневной профилактики и 6,6% (36 из 542) в группе пролонгированной профилактики (более 3 дней) (рис. 3 (C)). Согласно Q-критерию Cochrane, данные не имели существенной гетерогенности (P>0,1, I2=0%). Мета-анализ продемонстрировал преимущество использования пролонгированной антимикробной профилактики для снижения частоты послеоперационных инфекционных осложнений, результат оказался статистически значимым [ОШ=1,67, ДИ: 1,07, 2,61].
3) Влияет ли наличие предоперационной бактериурии на уровень значимой бактериурии и инфекционных осложнений в послеоперационном периоде? Анализ исходов развития послеоперационной бактериурии включил три исследования (656 пациентов) [25–27]. Т. Osman и соавт. признавали диагностически значимым уровень послеоперационной бактериурии 105 КОЕ/мл [25], Kikuchi и соавт. – 104 КОЕ/мл [26], El. А. Basri и др. – 103 КОЕ/мл [27]. Среди пациентов с выявленной до операции бактериурией частота послеоперационной бактериурии составила 22,5% (31 из 138). В группе больных без бактериурии до операции частота послеоперационной бактериурии составила 18% (93 из 518) (рис. 3 (D)). Согласно Q-критерию Cochrane, данные имели значимую гетерогенность (P<0,1, I2=91%). Мета-анализ показал, что частота послеоперационной бактериурии достоверно не различается в группах с предоперационной бактериурией и без нее [ОШ=0,66, ДИ: 0,10, 4,31].
Анализ частоты развития послеоперационных инфекционных осложнений в зависимости от наличия предоперационной бактериурии включил три исследования (1224 пациента) [22, 23, 26].
Среди больных с послеоперационными инфекционными осложнениями частота дооперационной бактериурии составила 38,6% (107 из 277). Частота предоперационной бактериурии в группе больных без послеоперационных инфекционных осложнений составила 34,6% (328 из 947) (рис. 3 (E)). Согласно Q-критерию Cochrane, данные не имели существенной гетерогенности (p>0,1, I2=25%). Мета-анализ показал, что частота послеоперационных инфекционных осложнений достоверно не различается в группах с предоперационной бактериурией и без нее [ОШ:=1,01, ДИ: [0,69, 1,48].
3) Существует ли связь между предоперационным уровнем ПСА и уровнем послеоперационной бактериурии? В анализ включены 3 исследования (290 пациентов) [25, 26, 30].
Т. Osman и соавт. считали диагностически значимым уровень послеоперационной бактериурии 105 КОЕ/мл, М. Kikuchi и соавт. – 104 КОЕ/мл. М. Martos и соавт. фиксировали любой уровень бактериурии.
Среди больных с послеоперационной бактериурией средний уровень ПСА составлял 12,2±2,9 нг/мл. В группе без послеоперационной бактериурии средний уровень ПСА составлял 8±4,2 нг/мл (рис. 3 (F)). Согласно Q-критерию Cochrane, данные имели значимую гетерогенность (Р<0,1, I2=92%). Мета-анализ показал, что средний предоперационный уровень ПСА значимо различается у пациентов с послеоперационной бактериурией и без нее [РС: 1,34, ДИ: 0,00; 2,68].
Обсуждение
1) Влияние антибиотикопрофилактики и ее продолжительности на развитие бактериурии и инфекционных осложнений у больных после трансуретральной хирургии простаты. Вопрос о целесообразности применения антибиотикопрофилактики у пациентов, перенесших трансуретральные операции на предстательной железе, в настоящее время по-прежнему обсуждается. Так, согласно В. Köves и соавт., объединившим данные 138 медицинских центров, антимикробная профилактика при трансуретральной резекции простаты проводится только половине пациентов [36].
И это несмотря на то что современные гайдлайны рекомендуют применять АБП во всех случаях [11]. Среди доказанных преимуществ применения профилактики отмечают снижение общего потребления антимикробных препаратов, снижение частоты послеоперационной бактериурии (26 по сравнению с 9,1%) и септицемии (4,4 по сравнению с 0,7%). Однако частота персистенции бактериурии, несмотря на АБП, составляет 36% при применении аминогликозидов и 22% – при применении как фторхинолонов, так и цефалоспоринов [37].
Анализ отобранных исследований позволил нам подтвердить значительное влияние использования АБП на оцениваемые исходы по сравнению с группой без профилактики. Кроме того, значимой в данном мета-анализе оказалась разница в частоте инфекционных осложнений в группе короткого режима дозирования (до 24 ч) и пролонгированного (от 3 до 5 дней). Однако мы хотим подчеркнуть тот факт, что большая часть включенных исследований, демонстрирующих статистически значимое преимущество применения АБП, все же проведены достаточно давно (1992–2007), при этом им явным образом противопоставляются данные, полученные в единственном представленном недавнем исследовании 2019 г. Нам представляется правильным обратить внимание на эту несогласованность, и по меньшей мере предположить, что наблюдаемая тенденция к заметному снижению эффективности применения АБП в данной группе больных с течением лет может свидетельствовать о стремительно растущей резистентности представителей микробиоты мочи этих больных как результат избыточного и нерационального использования антибактериальных препаратов. В данном случае суммарный статистический результат, указывающий на преимущества широкого применения АБП, обоснован численным преобладанием устаревших исследований, тогда как главную ценность представляют полученные данные в отношении тенденции к масштабной утрате клинического эффекта применения АБП.
2) Влияет ли наличие предоперационной бактериурии на частоту значимой бактериурии или инфекционных осложнений в послеоперационном периоде? С точки зрения важности изучения режимов АБП очевидна необходимость понимания исходного бактериального статуса больных и его влияния на исходы. В этом мета-анализе одной из задач была оценка уровня дооперационной бактериурии с точки зрения развития значимой послеоперационной бактериурии или инфекций после вмешательства. Данный фактор риска развития инфекционных осложнений упоминается в работах, оценивающих хирургические вмешательства различного профиля, а не только в урологии. Так, J. Salazar и соавт. проанализировали данные более 15 тыс. больных из различных хирургических отделений и установили, что среди тех больных, у которых до операции была бессимптомная бактериурия, частота инфекционных осложнений в послеоперационном периоде оказалась в 1,5 раза выше в сроки наблюдения до 1 года [38]. Среди пациентов, перенесших ортопедические или сердечно-сосудистые вмешательства, частота инфекционных осложнений была почти вдвое выше среди тех, у кого до операции была бессимптомная бактериурия. Такие данные также предоставляют специалисты в области травматологии, нейрохирургии [39, 40, 41]. Однако стоит отметить, что в настоящее время в урологической практике вопрос о наличии связи между бессимптомной бактериурией до операции и развитием инфекционных осложнений после операции обсуждается [25, 42, 43]. Следует начать с того, что сам по себе термин «бессимптомная бактериурия» в определенном смысле требует пересмотра ввиду сдвига парадигмы в отношении стерильности мочи [44]. Сегодня мы четко понимаем, что у каждого человека в норме в моче определяются микроорганизмы в различных концентрациях. При этом индивидуальная микробиота мочи подвержена определенным динамическим изменениям, обусловленным множеством факторов. Известны ли в настоящее время детерминанты и векторы сдвига микробного спектра мочи у мужчин в условиях нормы или патологии? Является ли статическая оценка бактериурии без учета динамики ее качественных и количественных изменений репрезентативным критерием наличия риска инфекционных осложнений? Определенно нет. В этом мета-анализе статистическая значимость связи между наличием предоперационной бактериурии и уровнем бактериурии или инфекционными осложнениями после ТУРП не была подтверждена.
3) Существует ли связь между предоперационным уровнем ПСА и послеоперационной бактериурией? Традиционная факторная структура инфекционных осложнений или выраженной бактериурии после трансуретральных операций на простате не включает уровень ПСА [7, 13, 25, 27, 28, 45, 46]. Однако известно, что простатспецифический антиген, нашедший свое основное применение в диагностике рака предстательной железы, неспецифичен в отношении онкологического процесса и высокореактивен при воспалительных процессах тканей предстательной железы. Изучено, что среди мужчин с фебрильной ИМП часто отмечается повышение уровня ПСА в сыворотке крови [47]. В то же время повышенный уровень ПСА и изменение объема предстательной железы предлагаются в качестве критериев поражения предстательной железы у мужчин с фебрильной инфекцией мочевыводящих путей.
Клиническая сложность группы больных с предрасположенностью к развитию инфекционно-воспалительных процессов в предстательной железе, а также наличие очагов хронической инфекции, локальных очагов инфаркта тканей предстательной железы, персистенция СНМП у части больных определяют необходимость изучения взаимоотношений между мочевой средой и тканями предстательной железы на предмет наличия единой оси циркуляции бактериальных агентов и сововлечения в воспалительные процессы [48]. Наши данные продемонстрировали связь между уровнем общего ПСА и развитием послеоперационной бактериурии. Однако требуются дополнительные исследования со стратификацией групп пациентов по уровню ПСА.
Вывод. Настоящий мета-анализ продемонстрировал значительные пробелы в знаниях о периоперационном бактериальном статусе и эффективности стратегий антибиотикопрофилактики в группе пациентов, перенесших трансуретральные операции на предстательной железе. Большинство включенных исследований имели существенную неоднородность, что свидетельствует, с одной стороны, о неоднозначности вопросов, поднятых в нашем и аналогичных исследованиях, с другой – о недостаточности протоколов периоперационного обследования пациентов с точки зрения инфекционного фактора. Требуются дальнейшие исследования для разработки эффективных стратегий снижения риска развития инфекционных осложнений и рационального использования антибактериальных препаратов.



