Введение. Острый обструктивный пиелонефрит (ООП) является частым и проблемным состоянием в практике уролога. Он характеризуется прогрессивным ростом заболеваемости населения, редицивированием и тенденцией к хронизации процесса с переходом в хроническую болезнь почек (ХБП) [1–6]. Основные уропатогены, причастные к развитию острых воспалительных заболеваний почек, относятся преимущественно к семейству Enterobacteriaceae (E. coli, Klebsiella spp., Proteus spp. и др.) и узкому паттерну грампозитивной микрофлоры (S. aureus, S. saprophyticus, Enterococcus spp.) [7–9]. Очевидно, что результаты лечения ООП зависят от своевременности и рациональности стартовой эмпирической антибактериальной терапии [10–13]. Обычно период лечения антибиотиками ООП составляет 7–14 дней и следует за устранением обструкции, обусловившей развитие заболевания [14–17], только в отдельных случаях этиотропную терапию рекомендуется продолжать до 21 дня [18–20]. Однако общепринятая антибактериальная терапия, направленная на каузативные патогены, не позволяет в полной мере минимизировать риски хронизации патологического процесса после купирования острых проявлений заболевания, ввиду чего наблюдается высокая частота (30–40%) развития рецидивов [21–23]. В течение последнего десятилетия в мировой литературе крайне редко появлялись публикации об осложненных и неосложненных уроинфекциях с долгосрочным наблюдением за больными [24, 25]. С учетом этого факта с целью уточнения исходов ООП нами предпринято проспективное клиническое исследование.
Материалы и методы. Проведен клинико-статистический анализ данных 51 последовательно отобранного больного (12 мужчин и 39 женщин) с ООП, возникшим в результате односторонней обструкции мочеточника конкрементом. Протокол исследования был одобрен Локальным независимым этическим комитетом при Ростовском государственном медицинском университете (№ 20/12 от 20.12.2012).
Критерии включения в исследование: отсутствие урологической патологии в анамнезе, отсутствие конкрементов в мочевыводящих путях в анамнезе, первое обращение за специализированной медицинской помощью с ООП, уровень мочепузырной бактериурии до дренирования обструктивной почки ≥103 КОЕ/мл.
Дизайн исследования предусматривал забор пузырной мочи катетером для бактериологического исследования, что проводили до ликвидации калькулезной обструкции мочеточника в ближайшие 3 ч с момента госпитализации. Средний возраст пациентов составил 51,6±3,4 года, длительность ООП до обращения в стационар – от 1 до 12 сут. Большинство (40; 78,4%) пациентов госпитализированы в первые трое суток от начала заболевания. Высокая тяжесть течения ООП у 23 (45,1%) пациентов сопровождалась проявлениями почечной и печеночной недостаточности.
Деривация мочи у всех больных осуществлена j-j-стентом. Стартовую эмпирическую антибактериальную терапию провели препаратами фторхинолонового ряда (рекомендации EAU) с последующим переходом на этиотропную терапию на 5–6-е сутки при получении результатов расширенного бактериологического исследования мочи на 9–10 питательных средах для идентификации широкого спектра факультативных аэробных (ФАБ) и неклостридиальных анаэробных бактерий (НАБ). Этиотропную антибиотикотерапию с использованием комбинации 2–3 групп препаратов (цефалоспорины, фторхинолоны, карбапенемы) продолжали в течение 2 нед.
Через 1, 3 и 6 мес. после окончания лечения всем больным проведен общеклинический и бактериологический мониторинг средней порции мочи, полученной при самостоятельном мочеиспускании. Оценка эффективности лечения осуществлена путем корреляционного анализ динамики частоты лейкоцитурии и бактериурии в связи с возрастом пациентов, длительностью течения ООП до ликвидации обструкции и с наличием осложненного течения ООП в виде почечно-печеночной недостаточности.
Статистический анализ результатов проведен непараметрическими методами с использованием пакета прикладных программ STATISTICA (StatSoft 8.1). Корреляционные связи признаков оценивали методом ранговой корреляции Спирмена. Критический уровень значимости при проверке статистических гипотез был принят равным 0,05.
Результаты. Бактериологическое исследование пузырной мочи до дренирования верхних мочевыводящих путей (ВМП) во всех случаях выявило бактериурию в виде микробных ассоциаций. В 5,6% случаев последние были аэробно-аэробными, в 94,4% – аэробно-анаэробными. Частота обнаружения патогенов семейства Enterobactericeae составила 82,3% с доминированием E. coli (69,1%). Уропатогены группы грампозитивной флоры выявлены у 17,7% пациентов с преобладанием Coagulase negative staphylococci коагулазонегативных стафиллококков (CNS).
В динамике всего периода наблюдения (рис. 1) констатировали статистически значимое (p<0,05) снижение частоты лейкоцитурии. Максимально выраженное снижение данного показателя более чем вдвое (p<0,05) имело место через 1 мес., затем темпы снижения замедлялись и к 6-му месяцу после ООП лейкоцитурия сохранялась у 20,7–23,8% пациентов.
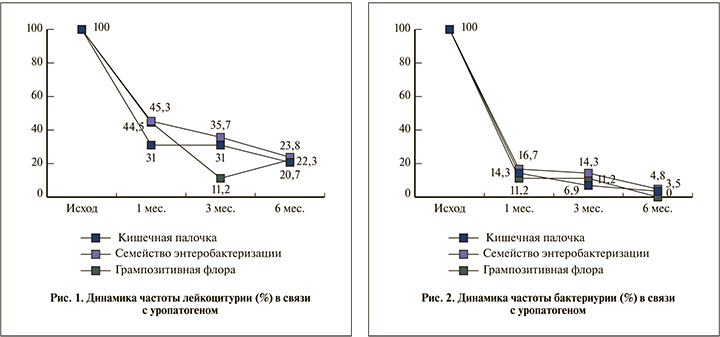
Динамика эрадикации Enterobactericeae и CNS (рис. 2) в исследуемый период была аналогичной, причем нормализация бактериологического анализа мочи шла быстрее, чем показателя содержания лейкоцитов в моче. Важно отметить, что к 6-му месяцу CNS не определялись в моче, тогда как патогены семейства Enterobactericeae (4,8%), в том числе E. coli (3,5%), в небольшом проценте случаев верифицировались в моче. Следует подчеркнуть, что на протяжении 6 мес. ни в одном случае в исследуемой когорте больных не получено стерильных посевов мочи. По мере снижения частоты присутствия в моче каузативных патогенов бактериурия характеризовалась ростом частоты обнаружения Peptococcus spp., Eubacterium spp., Bacteroides spp. (р<0,05).
 Динамика лейкоцитурии (рис. 3) и бактериурии в связи с возрастом пациентов демонстрировала различия в подгруппах пациентов младше и старше 45 лет. Так, для более молодых пациентов была характерной более выраженная положительная динамика уровней частоты лейкоцитурии и бактериурии в срок 1 мес. Однако по прошествии 3–6 мес. оба параметра в этих двух возрастных подгруппах практически не различались (p>0,05).
Динамика лейкоцитурии (рис. 3) и бактериурии в связи с возрастом пациентов демонстрировала различия в подгруппах пациентов младше и старше 45 лет. Так, для более молодых пациентов была характерной более выраженная положительная динамика уровней частоты лейкоцитурии и бактериурии в срок 1 мес. Однако по прошествии 3–6 мес. оба параметра в этих двух возрастных подгруппах практически не различались (p>0,05).
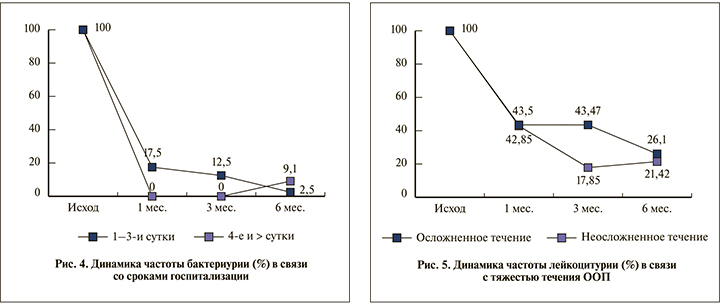
Мониторинг лейкоцитурии и бактериурии (рис. 4) в связи с длительностью догоспитального этапа ООП показал, как это ни парадоксально, более интенсивное снижение обоих параметров (р<0,05) к концу 1-го месяца у пациентов с более длительным сроком догоспитальной болезни, аналогичные соотношения и на сроке 3 мес. (р<0,05), однако к 6-му месяцу картина менялась: показатели в подгруппе более длительно болевших были выше (p<0,05), чем у пациентов с коротким догоспитальным периодом.
У пациентов с осложненным и неосложненным течением ООП на протяжении 6 мес. частота выявления лейкоцитурии не различалась (р>0,05), а вот различия по частоте выявления бактериурии были статистически значимыми (р<0,05) (рис. 5, 6). Однако изменения изучаемых показателей носили однотипный характер.
Как видно из рис. 7, процесс нормализации анализа мочи по показателям лейкоцитурии и бактериурии происходил параллельно, но эрадикация уропатогенов не отражала процесс нормализации лейкоцитурии, который так и не завершился практически в каждом четвертом случае спустя 6 мес. после окончания лечения ООП.
Обсуждение. Острый обструктивный пиелонефрит довольно часто встречается в урологической практике, и тактика его лечения детально разработана [14]. Вместе с тем особенности выздоровления и хронизации инфекции мочевых путей после рекомендуемой EAU терапии остаются малоизученными. Крайне мало публикаций о результатах длительного мониторинга (до 6–12 мес.) анализов мочи после острого пиелонефрита, в том числе обструктивного [23, 25]. Имеющиеся публикации касаются краткосрочного (2–4 нед.) изучения и то только неосложненных инфекций ВМП [25].
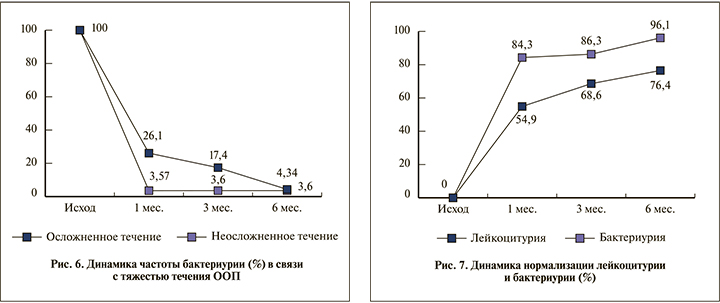
В нашем проспективном контролируемом исследовании когорты больных после перенесенного ООП (калькулезного) общеклинический и бактериологический мониторинг анализов мочи показал, что эрадикация уропатогенов, вызвавших ООП, происходит в течение 1 мес. после завершения лечения у 84,3% больных, а к 6-му месяцу их число возрастает до 96,1%. В то же время нормализация уровня лейкоцитурии на протяжении всего периода наблюдения достоверно отстает от процесса эрадикации и сохраняется к полугоду у 23,5% пациентов.
Нами установлено, что на скорость процесса эрадикации уропатогенов влияют возраст больных, длительность догоспитального периода ООП, тяжесть его клинического течения (почечная и печеночная дисфункции). У больных старше 45 лет, у пациентов с развитием дисфункции паренхиматозных органов процессы эрадикации патогенов и нормализации лейкоцитурии протекают медленнее по сравнению с больными молодого возраста и не имеющими осложнений ООП. Не удивительно, что больные с более длительным догоспитальным периодом ООП характеризуются более быстрой эрадикацией бактерий. Объяснение этому факту мы находим в том, что эти больные имеют менее тяжелое течение ООП на момент госпитализации и ООП лучше поддается терапии, чем в подгруппе более тяжелых больных, госпитализированных в 1–3-и сутки ООП.
Важно понять, почему нормализация лейкоцитурии происходит медленнее, чем снижение бактериурии <103 КОЕ/мл. Можно предположить, что процесс воспаления не завершается в момент исчезновения бактериурии, а поддерживается уропатогенами, сохраняющими в остаточной концентрации <103 КОЕ/мл. С другой стороны, наблюдается процесс «замещения» в моче каузативных уропатогенов недоминантными уропатогенами и НАБ, которые в течение 1–6 мес. приобретают доминирующую роль в микробном спектре мочи. Так или иначе, патофизиологию установленного нами явления в этой группе больных еще предстоит изучить.
Вместе с тем совершенно очевидно, что к моменту завершения стандартной антибиотикотерапии ООП выздоровление от почечной инфекции не происходит у значительной части больных по параметрам как бактериологического, так и общеклинического контроля мочи. И потом, что брать за основу выздоровления: эрадикацию общедоказанных уропатогенов или нормализацию лейкоцитурии? Ведь нами ранее было доказано в эксперименте, что ООП может быть вызван и различными анаэробами [26] и не они ли поддерживают лейкоцитурию у части больных через 6 мес. контроля?
Очевидно, что больные после ООП нуждаются в долгосрочном мониторинге мочи (не менее 6 мес.) с целью выявления больных с высоким риском перехода заболевания в ХБП. С другой стороны, понятно, что следует искать новые терапевтические подходы к предотвращению развития ХБП.
Выводы
- После завершения антибиотического лечения ООП эрадикация уропатогенов из мочи происходит в течение 6 мес. у 96,1% больных, а лейкоцитурия к этому времени сохраняется в 23,5% случаев. Наиболее высокие темпы снижения частоты выделения уропатогенов из мочи и частоты лейкоцитурии имеют место в первый месяц после терапии ООП.
- Уменьшение частоты бактериурии каузативных патогенов сопровождается ростом частоты присутствия в моче других таксонов аэробных и анаэробных бактерий, т.е. стерильные посевы мочи не наблюдаются ни в одном случае.
- На темпы эрадикации уропатогенов влияют возраст больных, длительность догоспитального этапа ООП, осложненное течение ООП.
- Целесообразно проводить мониторирование в течение не менее 3 мес. после ООП с целью выявления пациентов, имеющих риск развития ХБП.



