Введение. Проблема предвидения исходов заболеваний в результате лечения обусловила развитие самостоятельного направления в медицине – прогнозирования. В XIX в. впервые показано, что применение математического анализа в медицине помогает в достижении точности получаемых результатов [1, 2].
В многочисленных исследованиях показано, что применение информационных технологий с использованием математического аппарата позволяет прогнозировать эффективность того или иного метода лечения в зависимости от индивидуальных особенностей пациента [3, 4]. Как свидетельствуют данные литературы, при использовании современных информационных технологий можно рассчитывать уверенность в выборе методов лечения мочекаменной болезни (МКБ), а также повышать качество лечения за счет выбора адекватной комбинации лечебных методов [5–7].
Искусственные нейросетевые программы имеют несколько преимуществ. Во-первых, это простота в использовании [8]. Пользователь нейронной сети подбирает представительные данные, затем запускает алгоритм обучения, который автоматически воспринимает структуру данных. Однако от пользователя требуется какой-то набор эвристических знаний о том, как следует отбирать и подготавливать данные, выбирать нужную архитектуру сети и интерпретировать результаты [9]. Во-вторых, качество работы экспертной системы всегда стабильно и не зависит от настроения и состояния здоровья. Очень часто ошибки в прогнозировании определяются субъективными причинами, на работоспособность врача влияют его самочувствие в данный момент, условия труда, материальное положение, возможные проблемы в семье или конфликты на работе [10, 11]. В-третьих, и это главное, используя возможность самообучения, нейронная сеть способна решать задачи современной медицины, в которых не известны закономерности развития событий и зависимости между входными и выходными данными [12–14]. В-четвертых, решения, принимаемые нейросетью, не категоричны. Сеть выдает решение, оставляя пользователю возможность критически оценивать ответ. И наконец, нейросети обладают сверхвысоким быстродействием за счет использования массового параллелизма обработки информации, что позволяет использовать их в разных динамических системах, требующих незамедлительного принятия решения.
Цель исследования: оценить возможность применения нейросетевых алгоритмов в выборе метода оперативного лечения МКБ.
Материалы и методы. Исследование проведено на материале 625 историй болезни пациентов с камнями почек, находившихся на лечении в урологическом отделении НУЗ «Дорожная клиническая больница» (ст. Красноярск ОАО «РЖД») с 2013 по 2015 г. Основным критерием отбора резидентных больных МКБ служило наиболее полное обследование каждого госпитализированного пациента.
Для создания реестра сформирована единая система признаков, призванных выдавать единое решение по выбору метода лечения при диагнозе «МКБ, камень почки». Значения вводных признаков формировали на основании данных, получаемых при обследовании пациентов согласно стандартам оказания помощи, утвержденным Минздравом РФ.
Путем совместной экспертной оценки группой высококвалифицированных врачей-урологов определен вклад каждого признака в определение классификационной принадлежности объекта к выделенным классам. Составлен перечень из 50 признаков хi для определения тактики лечения пациентов с МКБ.
В базе данных были представлены:
1. Общие данные (возраст и пол пациента, пульс и показатели артериального давления, анамнез МКБ, предшествующие операции на мочевых путях, выбор метола лечения МКБ).
2. Значения лабораторных результатов пациентов в предоперационном периоде: показатели периферической крови (эритроциты, лейкоциты, тромбоциты, СОЭ, гемоглобин, гематокрит, АЧТВ, протромбиновое время, фибриноген); показатели мочи (удельный вес, pH, белок, эритроциты, лейкоциты, результаты бактериологического посева мочи); биохимические показатели крови (креатинин, мочевина, мочевая кислота, глюкоза, общий белок, билирубин).
3. Данные инструментального обследования: ультразвукового сканирования (толщина паренхимы почки, степень нарушения органного кровотока, при эходопплерографии сосудов почки возможность визуализации камня, степень гидронефроза); радиоизотопной реносцинтиграфии (время накопления и выведения радиоактивного препарата каждой почкой); рентгенологического исследования (визуализация конкремента, количество камней, размер камней, четкость контуров камня, наличие просветлений тени камня, плотность камня по результатам МСКТ, обтурация нижележащего отдела мочеточника, перегиб мочеточника ниже камня, уретероцеле, компрессия мочеточника извне).
4. Сопутствующие заболевания: сердечно-сосудистые, урологические, легочные, эндокринные.
В представленном ниже списке перечислены параметры, которые вводили в базу данных пациентов. В количественном эквиваленте представлены показатели: количественные данные инструментальных методов исследования, лабораторные данные. Качественные показатели, такие как визуализация конкремента по данным рентгенографии, наличие или отсутствие сопутствующей патологии, представлены в двоичном ключе, наличие патологии обозначается «1», ее отсутствие – «0».
Признаки, получаемые по результатам опроса:
- х1 – Возраст пациента.
- х2 – Пол пациента.
- х3 – Длительность заболевания.
- х4 – Хронический пиелонефрит в анамнезе.
- х5 – Мочекаменная болезнь в анамнезе.
- х6 – Предшествующие операции на мочевых путях в анамнезе.
Признаки, получаемые в результате осмотра:
- х7 – Симптом поколачивания по поясничной области.
- х8 – Болезненность при пальпации живота в проекции почки.
- х9 – Гипертермия.
- х10 – ЧСС.
- х11 – АД.
- Х12 – Степень развития подкожно-жировой клетчатки.
Лабораторные признаки на момент поступления (и после оперативного лечения):
- х13 – Уровень мочевины, ммоль/л.
- х14 – Уровень креатинина, мкмоль/л.
- х15 – Скорость клубочковой фильтрации, мл/мин.
- х16 – Уровень мочевой кислоты.
- х17 – Уровень глюкозы, ммоль/л.
- х18 – Уровень билирубина, ммоль/л.
- х20 – Уровень протеина, г/л.
- х21 – Фибриноген.
- х22 – АЧТВ.
- х23 – Протромбиновое время.
- х24 – Уровень гемоглобина в общем анализе крови, г/л.
- х25 – Уровень лейкоцитоза в общем анализе крови.
- Х26 – Уровень палочкоядерного сдвига нейтрофилов в общем анализе крови, %.
- х27 – Количество эритроцитов в осадке мочи, в поле зрения.
- х28 – Количество лейкоцитов в осадке мочи, в поле зрения.
- х29 – Уровень рН мочи.
- х30 – Удельный вес мочи.
- х30 – Бактериологическое исследование мочи.
Признаки, получаемые по результатам УЗИ:
- Х31 – Толщина паренхимы почки, мм.
- х32 – Визуализация камня при УЗИ.
- х33 – Степень гидронефроза по данным УЗИ.
- х34 – Степень нарушения органного кровотока, при эходопплерографии сосудов почки.
- х35 – Время накопления фармпрепарата при реносцинтиграфии, мин.
- х36 – Время выведения фармпрепарата при реносцинтиграфии, мин.
Признаки, получаемые по результатам рентгенологического обследования:
- х37 – Визуализация конкремента.
- х38 – Количество камней, шт.
- х39 – Размер камней, мм.
- х40 – Четкость контуров камня.
- х41 – Наличие просветлений тени камня.
- х42 – Плотность камня по результатам МСКТ.
- х43 – Обтурация нижележащего отдела мочеточника.
- х44 – Перегиб мочеточника ниже камня.
- х45 – Уретероцеле.
- х46 – Компрессия мочеточника извне.
Сопутствующие заболевания:
- х47 – легочная патология.
- х48 – урологическая патология.
- х49 – сердечно-сосудистая патология.
- х50 – сахарный диабет.
Таким образом, нами был создан реестр пациентов, в котором каждому человеку соответствует информация по 50 параметрам.
Информация о каждом больном представлена в виде многомерного вектора, характеризующегося вышеперечисленными входными данными предоперационного обследования пациентов.
Каждый пример имеет выходной параметр, представляющий заранее известную тактику лечения (в данном случае дистанционная ударно-волновая литотрипсия [ДУВЛ] – 1, перкутанная нефролитолапаксия [ПНЛЛ] – 2, пиелолитотомия или нефролитотомия – 3). Обучающую выборку нейронной сети составили данные всех 625 пациентов, получавших лечение в урологическом отделении.
При проведении проспективного исследования группы пациентов формировались путем независимой рандомизации при помощи таблиц случайных чисел, сгенерированной в программе Statistica.
Оценку клинической эффективности рекомендаций нейростевых алгоритмов проводили по критериям и показателям, характеризующим эффективность лечения: количество резидуальных фрагментов конкремента после проведения сеансов ДУВЛ, среднее количество сеансов ДУВЛ, количество инверсий метода лечения, частота развития воспалительных осложнений, повторные госпитализации, средний койко-день, элиминация конкремента за срок госпитализации.
Чтобы свести к минимуму вероятность случайных ошибок, на этапе планирования исследования с помощью статистических методов определен необходимый набор выборки, обеспечивающий репрезентативность исследования. Для определения скрытых закономерностей и связей признаков, определяющих выбор различных методов оперативного лечения нефролитиаза, проводили математическое моделирование структуры заболевания на основе анализа многофакторной информации о пациентах, вышеописанных выборочных совокупностей. Математическая обработка полученных данных включала определение статистических характеристик выборочных совокупностей, расчеты t-критерия Стьюдента. Различия считали статистически значимыми при p<0,05. Для сравнения непараметрических количественных учетных признаков использовали критерий Манна–Уитни (U-test). Степень сопряженности признаков оценивали при помощи корреляционного анализа. Использовали метод парной корреляции с вычислением коэффициента r. При значении r выше 0,7 корреляция признавалась сильной, при значении 0,5–0,7 – средней. В случаях когда коэффициент корреляции был менее 0?5, связь признавалась слабой. Обработку данных проводили с помощью компьютерных программ Statistica 10 (StatSoft), Panalayser 5.0, Microsoft Excel.
Результаты и обсуждение. Обученная нейросеть провела расчет значимости отдельных входных параметром и автоматически удалила наименее значимые из них. В результате были выделены 28 параметров, которые оказывали наибольшее влияние на выбор метода оперативного лечения при камнях почек (табл. 1).

Наиболее важными факторами (p<0,01), определяющими выбор метода оперативного лечения, стали возможность визуализации конкремента по данным обзорной урографии, число камней на стороне поражения, четкость контуров камня, гипертермия, скорость клубочковой фильтрации, число лейкоцитов в осадке мочи, обтурация нижележащего отдела мочеточника, операции на мочевых путях в анамнезе, наличие просветлений в тени камня по данным рентгенографии, плотность камня по данным МСКТ, лейкоцитоз в периферической крови, уровень палочкоядерного сдвига и результаты данных УЗИ, такие как степень гидронефроза.
Менее значимыми (р<0,05) параметрами оказались наличие сердечно-сосудистой и легочной патологии, уровни мочевины и креатинина, степень развития подкожно-жировой клетчатки, результаты бактериологического исследования мочи, наличие перегиба мочеточника ниже камня.
Были подчеркнуты некоторые особенности в определении значимости вводных параметров. Например, лейкоцитоз в общем анализе мочи оказался достоверно более важным показателем, чем лейкоцитоз в общем анализе крови и сдвиг лейкоцитарной формулы, рентгенологические методы обследования имели большее, чем ультразвуковые, значение при выборе методики элиминации конкрементов. Наличие сопутствовавших заболеваний (сахарного диабета, легочной и сердечно-сосудистой патологии) имело малое значение для выбора оперативного лечения. Ожирение, как и возраст пациента, не имеет определяющего значения (р<0,05).
Аналогичную методику обучения нейросети мы применили на примере ДУВЛ, выходной величиной в данном случае стал факт полного отхождения всех фрагментов конкремента в послеоперационном периоде. После того как нейросеть произвела автоматическое сокращение наименее значимых входных величин, мы повторили эту процедуру несколько раз, пока не остался минимум наиболее значимых предоперационных данных (рис. 1).
Так, наиболее значимыми (р<0,05) данными стали локализация камня, рентгенинтенсивность камня (сюда также входила четкость контуров конкремента и участки просветления на рентгенограммах), плотность камня в HU, наличие ожирения у пациентов, нарушение уродинамики, а также лейкоцитоз в общем анализе крови.
Для оценки клинической эффективности реализации рекомендаций системы нами проведено проспективное исследование. Из 150 пациентов, поступивших в урологическое отделение ДКБ на ст. Красноярск в 2015–2016 гг., рандомно сформировано две группы по 75 человек. Пациенты 1-й группы получали лечение по традиционным схемам, согласно рекомендациям лечащих врачей. Во 2-й группе лечение проводилось в соответствии с рекомендациями по результатам нейросетевого анализа. Группы были сопоставимыми по возрасту пациентов, локализации и размерам камней.
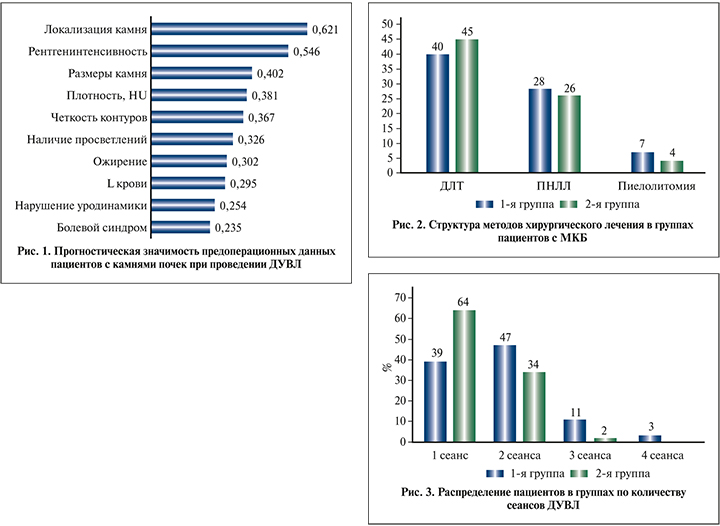
Как видно на рис. 2, частота выполнения операций статистически значимо не различалась в исследуемых группах. При этом применение рекомендаций нейростевой системы позволило сократить количество пиелолитотомий и перкутанных вмешательств во второй группе. За счет большего количества инверсий лечебной тактики количество хирургических манипуляций, приходящих на одного больного, было выше в 1-й группе.
Дистанционная ударно-волновая литотрипсия выполнена 40 (53,3%) больным 1-й группы. Среднее количество сеансов составило 1,8. Резидуальные фрагменты остались на момент выписки у 12 (30%) пациентов: у 4 в почке, у 8 в нижней трети мочеточника («каменная дорожка»). Из-за отсутствия фрагментации конкремента после двух сеансов ДУВЛ инверсия лечебной тактики потребовалась в 10 случаях – всем пациентам выполнена перкутанная нефролитолапаксия. В 4 случаях развилась клиника острого пиелонефрита, что потребовало выполнения катетеризации почки и последующей терапии на катетере. Таким образом, эффективность ДУВЛ в 1-й группе составила 75 % (рис. 3). Во 2-й группе ДУВЛ выполнена 45 (60%) больным. Среднее количество сеансов составило 1,4. Резидуальные фрагменты на момент выписки остались у 7 (15,6%) пациентов: у 4 в почке, у 3 в нижней трети мочеточника («каменная дорожка»). Инверсия потребовалась в 4 случаях – выполнена перкутанная нефролитолапаксия. Эффективность ДУВЛ во 2-й группе составила 91,1%.
Показатели эффективности ДУВЛ в группах сравнения статистически значимо различались: во 2-й группе она была выше за счет большего числа фрагментаций камня при меньших энергетических затратах (среднее число сеансов меньше на 0,4). По этой причине реже происходила инверсия лечебной тактики, меньше пациентов выписывались с резидуальными фрагментами.
Усовершенствование тактики лечения за счет применения нейросетевых алгоритмов привело к снижению сроков госпитализации, а также к улучшению показателей качества лечения в целом. Низкая эффективность ДУВЛ как изначально выбранного метода оперативного лечения обусловила изменение лечебной тактики в отношении 25% пациентов 1-й группы и лишь 8,9 % пациентов 2-й.
Как видно из табл. 2, применение рекомендаций нейросетевых алгоритмов приводит к значительному повышению качества оказания медицинской помощи пациентам с МКБ. Используя данные алгоритмы, нам удалось добиться снижения сроков госпитализации, инверсий тактики лечения, уменьшения количества взаимодополняемых манипуляций, снижения повторных госпитализаций, частоты развития воспалительных осложнений и количества резидуальных фрагментов после ДУВЛ.

Заключение. Таким образом, определены диагностические критерии, влияющие на выбор метода лечения при МКБ. Визуализация конкремента по данным обзорной урографии при ПНЛЛ имеет сравнимо меньшее значение, чем при ДУВЛ. Такие параметры, как количество камней на стороне поражения, четкость контуров конкремента по данным обзорной урографии, а также состояние нижележащего отдела мочеточника, имеют определяющее значение при выборе программой метода ДУВЛ по сравнению с такими же параметрами при ПНЛЛ. Показана возможность применения методики нейросетевого прогнозирования на предоперационном этапе лечебно-диагностического процесса у пациентов с камнями почек. Представленная методика может помочь практикующему врачу-урологу принимать решение о выборе оптимального метода лечения каждого конкретного пациента, тем самым сводя к минимуму риск возникновения ранних послеоперационных осложнений, и вести лечебный процесс, основываясь на индивидуальных особенностях пациента, т.е. реализовывать принципы персонифицированной медицины.



