Введение. Назначение нестероидных противовоспалительных препаратов (НПВП) для купирования болевого синдрома при нефролитиазе и после выполнения литотрипсии считается «золотым» стандартом в урологической практике [1]. Возникающие после малоинвазивного оперативного вмешательства геморрагии, гематурия и пиелонефрит относятся к ожидаемым осложнениям; тем не менее недостаточная эффективность существующих методов профилактики и лечения диктует необходимость исследования механизмов нарушения функции тромбоцитов и лейкоцитов, принимающих участие в тромбогенезе и развитии воспаления [2]. До настоящего времени отсутствует понимание механизмов, поддерживающих воспалительную реакцию в слизистой оболочке мочеточника при литокинетической терапии (ЛКТ), а также после уретеролитотрипсии на фоне отмены нестероидных противовоспалительных препаратов (НПВП), ингибирующих функциональную активность клеток крови. Одним из методических подходов, позволяющих решать указанные задачи, может быть анализ активности рецепторов на тромбоцитах (Тц) и лейкоцитах, модулирующих инфильтрацию стенки мочевыводящих путей (МВП) [3–5]. Установлено, что в циркулирующей крови Тц взаимодействуют с различными подгруппами лейкоцитов, формируя тромбоцитарно-лейкоцитарные агрегаты (ТЛА) [6]. Такое взаимодействие обеспечивает рекрутирование клеток крови из сосудистого русла в ткани органов, регулирует автономные функции лейкоцитов, включая образование и освобождение внеклеточных ловушек нейтрофилов, а также поддерживают обратную связь, позволяющую ограничивать распространение воспаления и защищать орган от альтерации, вызванной чрезмерной активацией иммунной системы [7]. В связи с этим перспективным методом установления таргетных методов коррекции послеоперационных осложнений служит моделирование in vitro развития острой воспалительной реакции в органах.
Цель исследования – выявить факторы риска развития острого пиелонефрита после контактной антеградной уретролитотрипсии (КУЛТ) и установить механизмы поддержании воспаления после отмены введения НПВП.
Материалы и методы. Исследование носило проспективный характер и включило 61 пациента с визуализационными признаками наличия конкрементов в верхней трети мочеточника, который находился на стационарном лечении в отделении рентген-ударно-волнового дистанционного дробления камней и эндоурологии ДОКТМО с 2020 по 2022 г. Всем пациентам на этапе госпитализации проведено комплексное клиническое обследование по традиционной схеме, принятой для диагностики МКБ (жалобы, сбор анамнеза, физикальный осмотр, клинико-инструментальные исследования, ультразвуковое обследование и компьютерная томография почек, микробиологический посев мочи, лабораторные исследования крови и мочи). В соответствии с поставленной целью отобран 21 пациент (10 мужчин и 11 женщин; средний возраст – 60,3±3,5 года), у которого на фоне стандартной литокинетической терапии (включившей диклофенак натрия, 100–150 мг/сут.) в течение 7 сут., по данным контрольных визуализационных исследований, не произошло перемещения конкремента из пиело-уретеральной зоны в среднюю треть мочеточника. Средний размер конкремента составил 14,3±0,9 мм (minmax – 8,0–30,0 мм). По показаниям проведена антеградная перкутанная уретеролитотрипсия (КУЛТ) с использованием электроимпульсного литотриптора «Уролит» (ООО «МедЛайн»), ультразвукового литотриптора Karl Storz CALCUSON, гольмиевого лазерного литотриптора KARL STORZ Calculase II или их комбинации. После операции в течение 2 сут. пациентам вводили НПВП и антибиотики. Контрольными точками исследования были 1-е сутки после КУЛТ, 2-е (последний срок назначения НПВП, общая длительность назначения препарата составила 9 сут.) и 3-и сутки (24 ч после отмены НПВП). Лейкоцитурию определяли при наличии 11 и более лейкоцитов в поле зрения при микроскопии осадка мочи; при этом выделяли легкую степень – 11–15 л/пз, среднюю –16–25 и тяжелую степень лейкоцитурии более 25 л/пз. Для оценки процесса рекрутирования лейкоцитов из сосудистого русла в ткани рассчитывали количество циркулирующих в крови ТЛА. С этой целью проводили микроскопию мазков крови, окрашенных по методу Паппенгейма; число ТЛА рассчитывали в процентном отношении на 100 клеток (в %). Группа контроля включила 10 здоровых лиц, у которых при диагностическом обследовании не выявлены клинико-лабораторные признаки сердечно-сосудистых и урологических заболеваний. Контрольная группа была сопоставимой по возрасту с таковой при наличии нефролитиаза; кровь здоровых лиц использовалась для определения контрольных значений количества ТЛА.
Анализ функциональной активности тромбоцитов (Тц) проведен in vitro, для чего из периферической крови путем центрифугирования выделили обогащенную тромбоцитами плазму. В пробе содержание тромбоцитов в 1 мкл составило 200 тыс. ±20 тыс. В исследовании применяли агонисты рецепторов, участвовавшие в модуляции воспалительной реакции, в частности АДФ (лиганд пуриновых Р2Yрецепторов), АТФ (лиганд пуриновых РХ-рецепторов), ангиотензин-2 (лиганд АТ1-рецептора), адреналин (неселективный лиганд α2-адренорецептора), коллаген IV-типа (лиганд GPVI-рецептора), фактор активации тромбоцитов (лиганд ФАТ-рецептора), аденозин (лиганд А2Арецептора), изадрин (лиганд β2-адренорецепторов) в концентрации ЕС50. Оценка агрегации Тц проведена турбидиметрическим методом на анализаторе ChronoLog (США).
В работе также использованы субпороговые концентрации агонистов, которые в контрольной группе (5 здоровых доноров) вызвали АТц, не превышавшую 10% (ЕС10). Взаимодействие рецепторов в формировании ТЛА in vitro анализировали при совместной инкубации 250,0 мкл периферической крови с каждым агонистом и комбинации агонистов, использованных в концентрации ЕС10. Условия ингибирования ЦОГ-1 в Тц воспроизводились добавлением к суспензии Тц Аспирина (500,0 мкМ). От всех обследованных пациентов получено информированное согласие на участие в исследовании. Статистический анализ осуществлен с использованием пакета MedCalc 18.10.2. Во всех случаях отличие считалось статистически значимым при р<0,05.
Результаты. На фоне введения пациентам НПВП через 1 сутки после КУЛТ уровень лейкоцитурии уменьшился на 19,4% (р<0,001) по сравнению с таковой на момент госпитализации, соответственно 17,5±0,8 п/з (95% ДИ: 15,8–19,3) и 21,7±0,8% (95%ДИ: 20,1–23,4%); через 2 сут. показатель снизился на 22,3% (р<0,05) по сравнению с предыдущим сроком наблюдения – до 13,6±0,7 п/з (95% ДИ: 12,4–14,8 п/з). Через 3 сут. после КУЛТ выявлено повышение выраженности лейкоцитурии на 46,3% (р<0,001) до 19,9±0,8 п/з (95% ДИ: 19,3–21,6 п/з), т.е. происходило восстановление тяжести пиелонефрита на фоне отмены введения пациентам НПВП. Приведенная динамика отражает включение механизмов, усиливающих рекрутирование клеток крови из сосудистого русла. В связи с этим целесообразно сопоставить количество циркулирующих в крови ТЛА и выраженность лейкоцитурии после малоинвазивного оперативного вмешательства.
У пациентов с МКБ на момент госпитализации число ТЛА в циркулирующей крови достигло 12,1±0,3% (95% ДИ: 11,5–12,8%); через 1 сут. после КУЛТ численность ТЛА существенно не изменилась – 11,2±0,6% (95% ДИ: 9,8–12,6%). Снижение количества ТЛА обнаружено через 2 сут. – на 25,0% (р<0,05) по сравнению со сроком наблюдения 1-е сутки); при этом численность агрегатов составила 8,4±0,9% (95% ДИ: 6,7–10,3%). Через 3 сут. число циркулирующих ТЛА увеличилось на 26,2% (р<0,05) до 10,6±0,5% (95% ДИ: 9,5–11,5%), т.е. восстанавливалось до уровня ТЛА через 1 сут. после КУЛТ. Таким образом, на фоне применения НПВП значимое снижение числа ТЛА наблюдалось через 2 сут. после КУЛТ, что связано с блокированием ЦОГ в клетках крови и по сути отражает эффективность противовоспалительной терапии. Через 3 сут. после КУЛТ (24 ч после прекращения введения НПВП) наблюдалось увеличение количества ТЛА в крови, что отражает усиление процессов рекрутирования лейкоцитов из сосудистого русла для поддержания защитной реакции в слизистой оболочке мочеточника.
Исследовательский вопрос: какие рецепторы участвуют в модуляции функции тромбоцитов через 24 ч после прекращения введения НПВП? Выявлена нормореактивность α2-адренорецептора, GPVI-, АТ1-, ФАТ-, Р2Х1и А2Арецептора, а также гипореактивность β2-адренорецептора и P2Y-рецепторов (табл. 1). Таким образом, потенциальными индукторами активации клеток крови после оперативного вмешательства на фоне отмены НПВП могут быть адреналин, коллаген IV-типа, ангиотензин-2, ФАТ и АТФ. Нельзя исключить участие других рецепторов в модуляции воспалительной реакции после КУЛТ, если будет доказано, что их взаимодействие связано с формированием ТЛА и тяжестью воспаления. В связи с этим целесообразно проанализировать наличие корреляционных связей между активностью рецепторов, принимающих участие в рекрутировании лейкоцитов из сосудистого русла. Анализ множественной корреляции позволил выявить положительную связь между количеством ТЛА и активностью α2-адренорецептора (rТЛА-α2АР=0,754; р<0,05), GPVI-рецептора (rТЛАGPVI=0,513; р<0,05), Р2Х1-рецептора (rТЛА-Р2Х1=0,404; р<0,05), АТ1-рецептора (rТЛА-АТ1=0,640; р<0,05) и ФАТ-рецептора (rТЛА-ФАТ=0,347; р<0,05).
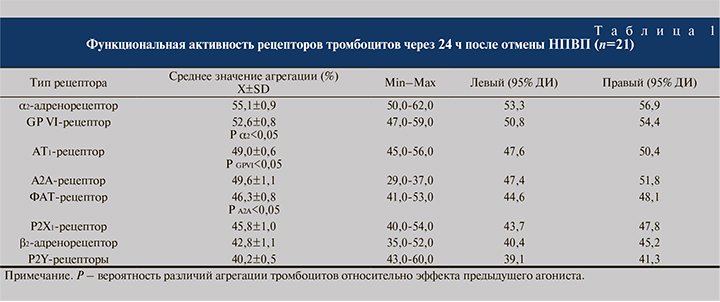
Таким образом, триггерами формирования ТЛА, обеспечивающими усиление тяжести воспалительной реакции в МВП, являются как системные регуляторы – адреналин и ангиотензин-2, так и локальные модуляторы функциональной активности клеток крови – ФАТ, АТФ и коллаген IV-типа базальной мембраны стенки сосудов. Наличие, с одной стороны, нормореактивности α2-адренорецептора, GPVI-, Р2Х1-, АТ1-, ФАТ-рецептора, с другой – подтверждение связи активности рецепторов с количеством циркулирующих ТЛА свидетельствуют: через 24 ч после отмены НПВП возможно восстановление воспалительной реакции за счет рекрутирования клеток крови в стенку МВП. Если судить по силе корреляционных связей, то ключевую роль в формировании ТЛА играют α2-адренорецептор, АТ1и GPVI-рецептор. Можно предположить, что активация САС, РАС и ремоделирование базальной мембраны стенки сосудов являются факторами риска усиления тяжести лейкоцитурии.
Исследовательский вопрос: действительно ли α2-адренорецептор, АТ1и GPVI-рецептор участвуют в формировании ТЛА и рекрутировании клеток крови для реализации защитной воспалительной реакции в поврежденной слизистой оболочке мочеточника через 24 после отмены НПВП? Установлено, что субпороговая доза адреналина, Анг-2 и коллагена IV типа обеспечивала формирование ТЛА, причем последний агонист воспроизводил минимальный эффект (табл. 2).

Полученные результаты подтверждают, что α2-адренорецептор, GPVI-, АТ1-рецептор играют ключевую роль в рекрутировании клеток крови из сосудистого русла. Инкубация клеток крови одновременно с несколькими агонистами позволила оценить взаимодействие рецепторов, способное потенцировать формирование ТЛА. Оказалось, что максимальный эффект формирования ТЛА in vitro воспроизводился при взаимодействии α2-адренорецептора и АТ1-рецептора. При этом количество образовавшихся ТЛА при одновременной стимуляции двух рецепторов превышало таковое при изолированной стимуляции α2-адренорецептора на 65,8% (р<0,001) и АТ1рецептора на 47,2% (р<0,001). Одновременная стимуляция АТ1-а и GPVI-рецептора моделировала формирование ТЛА на 15,3% (р<0,001) меньше, чем комбинация α2-адренорецептора и АТ1-рецептора. Тем не менее имела место синергия этих рецепторов, поскольку количество ТЛА было выше, чем при изолированной стимуляции АТ1-рецептора, на 24,7% (р<0,001) и коллагена на 88,1% (р<0,001). Минимальный стимулирующий эффект отмечен при активации α2-адренорецептора и GPVI-рецептора.
Количество образовавшихся ТЛА при одновременной стимуляции этих рецепторов превысило таковое при изолированной стимуляции α2-адренорецептора на 16,4% (р<0,05) и GPVI-рецептора на 55,9% (р<0,001). Выявленное количество ТЛА было на 28,9% (р<0,001) меньше, чем при взаимодействии α2-адренорецептора и АТ1-рецептора и на 17,1% (р<0,001) меньше по сравнению с эффектом комбинации АТ1и GPVI-рецепторов. Моделирование взаимодействия других рецепторов не сопровождалось значимой стимуляцией клеток крови, позволившей формировать ТЛА, по сравнению с изолированной стимуляцией этих рецепторов.
Обсуждение. Насколько обоснованна концепция, что активация САС является фактором риска развития послеоперационного пиелонефрита? Участие катехоламинов в рекрутировании лейкоцитов представляется логичным, поскольку экспрессия α2-адренорецепторов на тромбоцитах, лейкоцитах и эндотелии [8,9] создает оптимальные условия для формирования ТЛА при развитии пиелонефрита [10]. Провоспалительный эффект адреналина может быть связан с тем, что (а) цитокины влияют на экспрессию адренергических рецепторов лейкоцитов; последние в свою очередь способны самостоятельно синтезировать катехоламины при развитии воспалительной реакции [11, 12]; (б) стимуляция αи β-адренорецепторов сопровождается увеличением фагоцитарной способности макрофагов, экспрессией индуцибельной синтазы оксида азота (iNOS) и повышением продукции NO; в основе данных процессов, вероятно, лежит активация ядерного фактора каппа B (NF-κВ) [13]. В связи с этим R. Sud et al. [14] предлагают рассматривать α2-адренорецепторы макрофагов как триггер воспалительной реакции, поскольку их лиганды индуцируют продукцию фактора некроза опухоли (ФНОα). Что касается ангиотензинового АТ1-рецептора, то его присутствие на эндотелии, тромбоцитах и лейкоцитах [15, 16] создает условия для их взаимодействия в процессе миграции клеток крови. Данное утверждение базируется на следующих эффектах ангиотензина-2, который: (а) вызывает активацию и агрегацию Тц [17]; (б) способствует адгезии лейкоцитов к эндотелию и увеличивает проницаемость стенки сосудов микроциркуляторного русла [18, 19]; (в) является триггером воспалительной реакции в эндотелии [20]; (г) участвует в активации Т-клеток и продукции ИЛ-2 [21]. В настоящее время считается доказанным существование функциональной перекрестной связи между сигнальными путями AT1-рецептора и других рецепторов [22]. Взаимодействие α2-адренорецептора и АТ1-рецептора представляет интерес, поскольку сопряженность сигнальных путей модулирует функциональную активность тромбоцитов и лейкоцитов [23]. Выяснение механизмов активации клеток крови после отмены НПВП позволит наметить перспективные направления фармакологической коррекции, направленной на профилактику послеоперационного пиелонефрита.
Заключение. У пациентов после контактной антеградной уретеролитотрипсии и отмены введения НПВП развивается лейкоцитурия, развитие которой связано с формированием тромбоцитарно-лейкоцитарных агрегатов и рекрутированием лейкоцитов из сосудистого русла в ткани стенки мочевыводящих путей. Факторами риска усиления тяжести лейкоцитурии являются активация симпато-адреналовой и ренин-ангиотензиновой систем, а также ремоделирование базальной мембраны стенки сосудов микроциркуляторного русла. Моделирование in vitro развития острой воспалительной реакции продемонстрировало, что максимальный эффект формирования тромбоцитарно-лейкоцитарных агрегатов воспроизводится при взаимодействии α2-адренорецептора и АТ1-рецептора.



