Введение. В настоящее время радикальная цистэктомия (РЦЭ) остается наиболее объемной и сложной операцией в онкоурологической практике, которая сопровождается высокой частотой осложнений и летальности [1, 2].
Применение протокола ERAS (Enhanced recovery after surgery) при РЦЭ направлено на снижение частоты послеоперационных хирургических осложнений, летальности, послеоперационного пребывания пациента в стационаре и тем самым на снижение затрат на пациента; в настоящее время протокол ERAS активным образом применяется в современной онкоурологической практике [3].
Цель работы: мультицентровый проспективный анализ результатов применения протокола ERAS у пациентов, перенесших РЦЭ в реальной клинической практике.
Материалы и методы. Мультицентровое исследование проводилось в четырех клиниках России: (ГКБ № 1 им. Н. И. Пирогова, Москва; Клиника урологии им.
Р. М. Фронштейна ПМГМУ им. И. М. Сеченова, Москва; НМИЦ онкологии им. Н. Н. Петрова, Санкт-Петербург; Клиника БГМУ, Уфа).
Задачи исследования:
- оценка частоты осложнений и летальность после РЦЭ с применением протокола ERAS;
- оценка частоты применения пунктов протокола ERAS.
Проспективному анализу подверглись 134 пациента, перенесших РЦЭ с применением протокола ERAS в 2017 г.
Частота осложнений, летальности и каждый пункт протокола ERAS анализировались как в общей выборке пациентов, так и отдельно при открытом и лапароскопическом доступе.
Распределение пациентов по возрасту, полу и методу оперативного доступа представлены в табл. 1.

По данным дооперационного обследования пациентов: гидронефроз до операции выявлен у 43 (32,1%) пациентов, при этом односторонний – у 38 (28,4%) пациентов, двусторонний – у 5 (3,7%). Наличие гидронефроза в дооперационном периоде преобладало в группе пациентов с лапароскопическим доступом.
РЦЭ по поводу локализованной формы рака pT1–T2 выполнена 67 (50%) пациентам, по поводу местнораспространенного рака рT3-T4 выполнена 61 (45,5%) пациенту. Также в исследование были включены 6 (4,5%) пациентов, которым выполнена простая цистэктомия. Неоадъювантной химиотерапии подверглись 13 (9,7%) пациентов. Степень дифференцировки опухолевого процесса после операции была следующей: high grade – 116 (86,6%), low grade – 6 (4,5%), у 12 (8,9%) пациентов степень дифференцировки не указана. Поражение лимфатических узлов pN1-2 выявлено у 49 (36,6%) пациентов.
Деривация мочи осуществлялась как инконтинентной, так и континентной методиками, при этом преобладала операция Брикера. В табл. 2 представлены методы деривации мочи.
Коррекция сопутствующей патологии сужила одним из важнейших этапов в дооперационной подготовке пациентов перед РЦЭ. Из сопутствующих патологий гипертоническая болезнь отмечена у 89 (66,4%) пациентов, сахарный диабет 2 типа без инсулинотерапии встречалась у 8 (6%) пациентов, с инсулинотерапией – у 2 (1,5%), ИБС отмечен у 72 (53,7%) пациентов. ОИМ в анамнезе встречался у 11 (8,2%) , а ОНМК в анамнезе – у 4 (6,2%) пациентов. Средний уровень фракции выброса составил 62,8±6%. Низкомелекулярные гепарины до операции применяли 90 (67,2%) пациентов.
Из 134 пациентов курящим был 51 (38,1%) пациент, 78 (58,2%) пациентов не курили, более 3 мес. назад отказались от курения 5 (3,7%) пациентов.
В дооперационном периоде состояние большинства пациентов по шкале ASA соответствовало категории II и III, что преобладало при лапароскопическом доступе.
По данным лабораторных анализов: средний уровень об. белка крови до операции – 74,3±6 г/л, на утро после операции – 55,9±7,3 г/л. Средний уровень гемоглобина до операции – 130,9±21,8 г/л, на утро после операции – 109,1±17,4 г/л. Средний уровень креатинина до операции – 119,3±46,9 мкмоль/л. Данные дооперационного протокола ведения пациентов представлены в табл. 3.

Анальгезия выполнялась преимущественно эпидуральным способом, при этом низкий блок выполнялся 13 (9,7%) пациентам, высокий блок (Th 9–10) – 103 (76,9%), 18 (12,6%) пациентам эпидуральная анальгезия не проводилась. Среднее количество дней проведения эпидурального обезболивания – 3 (2–3).
Экстубация по окончанию операции в ОРИТ выполнялась 26 (19,4%) пациентам, сразу после операции 108 (80,6%). Обезболивание наркотическими препаратами в послеоперационном периоде понадобилось 47 (35,1%) пациентам, таких пациентов было больше в группе открытого доступа.
Данные интра- и послеоперационного протокола ведения пациентов представлены в табл. 4.
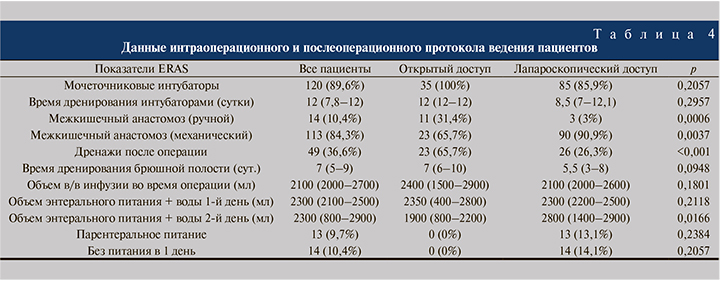
Назогостральный зонд 94 (70,1%) пациентам не устанавливался, 14 (10,4%) только во время ИВЛ (операции), в послеоперационном периоде – 23 (17,2%) пациентам. При наличии НГЗ, числа дней дренирования желудка – 1 (1–2). Повторная установка НГЗ по поводу гастростаза выполнена 16 (11,9%) пациентам, гастростаз, не требующий установки НГЗ, отмечен у 31 (23,1%) пациента.
Статистическая обработка данных выполнена с помощью электронных таблиц «Microsoft Excel» и пакета прикладных программ «Statistica for Windows» v. 7.0 (StatSoft Inc., США). При нормальном виде распределения числовых данных применялись методы параметрической статистики (критерий Стьюдента). При отсутствии нормального распределения данных применялись методы непараметрической статистики – U-тест Манна–Уитни. Показатели, изменяющиеся в динамике, оценивались с помощью парного критерия Вилкоксона. Статистически значимыми считались различия при р<0,05 (95%-й уровень значимости) и при р<0,01 (99%-й уровень значимости).
Количественные показатели были представлены в виде M±SD, а в случае отсутствия нормального распределения – в виде медианы и интерквартильного размаха Me (Q1-Q3). Для оценки характера и степени влияния различных факторов на риск послеоперационных осложнений или смерти пациентов был использован метод бинарной логистической регрессии. В качестве зависимой переменной (переменной отклика) был взят показатель наличия послеоперационных осложнений или смерти.
В ходе построения математической модели проведен многофакторный анализ возможного влияния на зависимую переменную следующих факторов: возраста пациентов, данных анамнеза пациентов, антропометрических характеристик, биохимических показателей, УЗИ-параметров и данных других проведенных исследований. При построении математической модели был произведен поэтапный анализ влияния вышеперечисленных показателей на наличие послеоперационных осложнений или смерти. В результате данного анализа в модели остались только факторы, достоверно оказывающие влияние на исход (p<0,05).
Результаты. Полученные результаты также были отдельно анализированы как для всех пациентов, так и отдельно при открытом и лапароскопическом доступе. В табл. 5 представлены интра- и послеоперационные результаты.

Возникшие в послеоперационном периоде осложнения были классифицированы по шкале Clavien–Dindo. Суммарно за 90-дневный период после операции зафиксировано 95 (70%) осложнений. В табл. 6 представлены осложнения и смертность в течение первых 30 дней после РЦЭ.
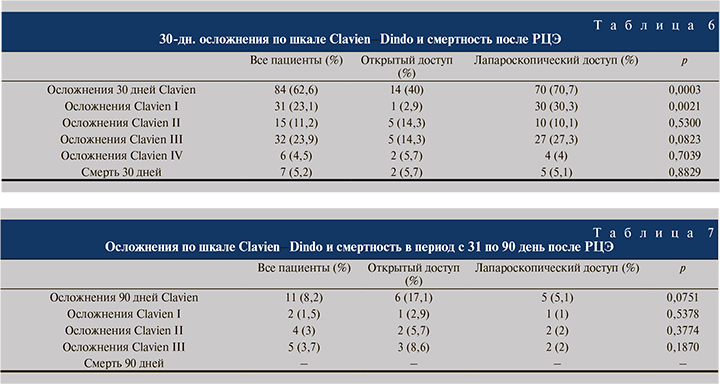
В табл. 7 представлены осложнения и смертность в период с 31-го по 90-й день после РЦЭ.
Преобладали осложнения со стороны желудочно-кишечного тракта: гастростаз, требующий установки назогастрального зонда, отмечался у 16 (11,9%) пациентов, парез кишечника – у 43 (32,1%): консервативному лечению подверглись 22 (16,4%) пациента, операция потребовалась 21 (15,7%) пациенту, из них механическая кишечная непроходимость отмечена у 14 (10,4%), динамическая кишечная непроходимость у 7 (5,2%), эвентрация кишечника выявлена у 4 (2,9%) пациентов. Несостоятельность уретероилеоанастомоза выявлена у 18 (13,4%) пациентов.
Смертность в течение первых 30 дней после операции – 7 (5,2%) случаев. Причина смерти четырех пациентов: полиорганная недостаточность после перенесенного перитонита; трех пациентов – острая сердечная недостаточность после перенесенной ОИМ и массивного кровотечения.
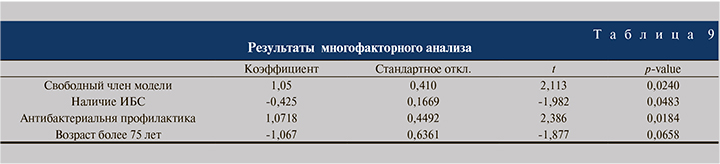
По данным проведенного нами однофакторного и многофакторного анализов выявлено, что отсутствие антибактериальной профилактики, ИБС в анамнезе и возраст пациентов старше 75 лет служат предиктором увеличения частоты осложнений.
Статистически значимые результаты одно- и многофакторного анализа представлены в табл. 8, 9.

С помощью бинарного регрессионного анализа нами была получена достоверная модель (Хи-квадрат=11,543 р=0,00913) для выявления возможных осложнений в 90-дневый п/о период.
Чувствительность полученной модели составила 88,7%, т.е. были правильно предсказаны осложнения 63 из 71 человека.
Обсуждение. Как отмечалось выше, применение протокола ERAS (Enhanced recovery after surgery) при РЦЭ направлено на снижение частоты ранних послеоперационных хирургических осложнений и летальности. В 2013 г. опубликованы первые рекомендации по применению протокола ERAS при РЦЭ, данные рекомендации включали дооперационное, интраоперационное и послеоперационное ведение пациентов [4]. Однако изначально протокол ERAS был разработан для колоректальной хирургии, проведено всего лишь 15 исследований после РЦЭ и оценены только 7 из 22 пунктов ERAS, результаты которых оказались неоднозначными.
По нашему мнению, одним из основных пунктов в предоперационном ведении пациентов является коррекция сопутствующей патологии, в рамках нашего исследования преобладала сердечно-сосудистая патология, при этом ИБС при однофакторном и многофакторном анализах продемонстрировала статистически значимое влияние на увеличение частоты послеоперационных хирургических осложнений. Учитывая объем оперативного вмешательства, преобладание пациентов пожилого возраста и высокий уровень сердечно-сосудистой патологии до 67% пациентов получали низкомолекулярные гепарины как метод профилактики тромбообразования. Также, по нашему мнению, в дооперационном ведении пациентов немаловажны отсутствие голодания, подготовка кишечника и прием углеводного напитка за несколько часов до операции.
Важными пунктами в интраоперационном ведении пациентов считаем применение обогрева пациента и переливаемых растворов, антибактериальной профилактики, применение назогастрального зонд только во время операции, использование высокого эпидуралного блока (Th 9–11), дренирование ВМП наружными стентами, отсутствие дренажей.
В послеоперационном периоде наиболее важным аспектом служит ранняя активизация и энтеральное кормление пациентов, в рамках нашего исследования первые дни после операции средний объем энтерального питания и воды составил 2300 (2100–2500) мл. По нашему мнению, ранняя активизация и кормление пациентов – это основа профилактики пареза кишечника. При первых признаках пареза кишечника пациентам показаны продление эпидуральной анальгезии и стимуляция кишечника (антихолинэстеразных препаратов и очистительных клизм), при подозрении на гастростаз рекомендуется повторная установка назогастрального зонда.
По данным современной литературы (Shabsigh A. et al., Darenkov S.P. et al., Nosov A.K. et al., Perepechai V.A. et al., Loran O.B. et al.), в раннем послеоперационном периоде в первые (90) дней после РЦЭ частота осложнений варьируется от 30 до 80%, из которых преобладают осложнения со стороны желудочно-кишечного тракта, повторной госпитализации подвергаются до 30% пациентов. Средняя продолжительность послеоперационного пребывания в стационаре от 8–10 дней, при этом при наличии осложнений значимо увеличивается продолжительность лечения и затраты на пациента [1–2, 5–7, 12]. Летальность после РЦЭ (в течение первых 90 дней) колеблется от 3,0–9,0% [7–8].
В 2016 г. (Tyson and Chang) опубликован единственный мета-анализ по применению протокола ERAS при РЦЭ. Мета-анализ включил 13 сравнительных рандомизированных исследований, 1493 пациента. Пациенты были разделены на 2 группы: в первой к 801 пациента применялся протокол ERAS, во второй группе 692 пациента без протокола ERAS [9].
Авторы не отметили отличия в частоте повторной госпитализации и летальности в течение первых 90 дней после операции, однако частота послеоперационных осложнений преобладала в группе больных без применения протокола ERAS – 51,5% (237/461) пациентов, и 39,6% (209/527) с применением протокола ERAS.
Авторы также отметили, что продолжительность госпитализации в группе пациентов с применением протокола ERAS в среднем на 5,4 дня меньше.
В рамках нашего мультицентрового проспективного исследования за 30-дневный период после операции зафиксировано 84 (62,6%) осложнений: из них преобладала категория Clavien I–II у 46 (34,3%) пациентов, осложнения категории Clavien III–IV отмечены у 38 (28,4%) пациентов. При этом следует отметить, что частота осложнений в течение первых 30 дней преобладала при лапароскопическом доступе и достигала до 71%, а при открытом доступе до 40%. Однако при дальнейшем анализе частоты осложнений было отмечено, что 90-дневные осложнения преобладают в группе пациентов с открытым доступом и достигают до 17%, а при лапароскопическом доступе – до 5%. Из осложнений преобладали таковые со стороны желудочно-кишечного тракта: гастростаз, требующий установки назогастрального зонда, отмечался у 16 (11,9 %) пациентов, парез кишечника отмечен у 43 (32,1%) пациентов, при этом консервативному лечению подверглись 22 (16,4%) пациента, операция потребовалась 21 (15,7 %) пациенту.
Повторная операция понадобилась 25 пациентам, из них по поводу механической кишечная непроходимость – 14 (10,4%) пациентам, по поводу динамической кишечной непроходимость – 7 (5,2%), по поводу эвентрации кишечника – 4 (2,9%). Несостоятельность уретероилеоанастомоза выявлена у 18 (13,4%) пациентов, в связи с чем выполнялась дренирование верхних мочевых путей путем ЧПНС.
Летальность в течение первых 90 дней после операции достигла 5,2%. Причины летальности: полиорганная недостаточность после перенесенного перитонита, острая сердечная ньедостаточность после перенесенной ОИМ и массивного кровотечения.
Повторная госпитализация потребовалась 13 (9,7%) пациентам.
Частота применения пунктов протокола ERAS при РЦЭ в каждой из клиник, участвовавшей в мультицентровом исследовании, разнилась и использовались не в полном объеме во всех учреждениях, при этом открытый и лапароскопический доступы при РЦЭ имеют незначительные различия по некоторым интра- и послеоперационным пунктам, но в целом сопоставимы по основным пунктам.
Результаты одно- и многофакторного анализов продемонстрировали, что отсутствие антибактериальной профилактики, ИБС в анамнезе и возраст пациентов старше 75 лет служат предиктором увеличения частоты осложнений.
В рамках нашего мультицентрового проспективного исследования не проводился анализ экономической стороны применения протокола ERAS при РЦЭ, хотя изначально данный протокол направлен на снижение послеоперационного пребывания пациента и снижение затрат стационара на пациента, однако данные современной литературы не однозначны.
Так, например, в 2017 г. J., Chipollini et al. в своей работе продемонстрировали, что при применении протокола ERAS затраты на одного пациента составили 59,539 долл. (112 пациентов), без применения протокола ERAS – 60,655 (145 пациентов); через 1 год в своей работе A. Semerjian et al. продемонстрировали, что применение протокола ERAS снижает затраты стационара на пациента до 31,090 долл. (66 пациентов), затраты на одного пациента без применения протокола ERAS составило 35,448 долл. (54 пациента) [10, 11].
В настоящее время проведенное нами сравнительное исследование является первой в отечественной научной медицинской литературе, которое позволило получить ранние результаты по применению протокола ускоренного восстановления пациентов ERAS при РЦЭ, для получения более отдаленных результатов планируется продолжение исследования.
Выводы:
- Несмотря на применение протокола ERAS, РЦЭ сопровождается высокой частотой осложнений – до 70%, большинство из них – Clavien I–II. Летальность составляет 5,2% (первые 30 дней), частота повторной госпитализации – 9,7%.
- Одно- и многофакторный анализы продемонстрировали, что отсутствие антибактериальной профилактики, ИБС в анамнезе и возраст пациентов старше 75 лет являются предиктором увеличения частоты осложнений.
- Открытый и лапароскопический доступы при РЦЭ имеют незначительные различия по некоторым интра- и послеоперационным пунктам, но в целом сопоставимы по осложнениям, летальности, времени пребывания в стационаре.
- Для получения однозначных данных по применению протокола ERAS при РЦЭ требуются долгосрочные исследования.



