Введение. Проблема лечения первичных и вторичных стриктур лоханочно-мочеточникового сегмента (ЛМС) остается актуальной в урологии. Традиционно методом выбора в лечении данной категории больных служили открытые реконструктивно-пластические операции, направленные на восстановление анатомической и функциональной целостности мочевыводящих путей и сохранение органа [1]. За последние годы открытые операции практически полностью были заменены менее инвазивными транс- и экстраперитонеальными лапароскопическими и роботическими операциями [2]. В течение трех последних десятилетий активно развиваются методики внутрипросветных суправезикальных эндоурологических вмешательств в лечение стриктур верхних мочевыводящих путей (ВМП), которые по своей эффективности незначительно уступают открытым и лапароскопическим хирургическим вмешательствам, а по ряду характеристик превосходят последние [3]. До широкого внедрения эндотомии для коррекции стриктур ВМП активно применялись бужирование и баллонная дилатация [4]. В настоящее время данные методы коррекции во многом утратили свое значение прежде всего благодаря большей эффективности и приемлемой клинической безопасности метода эндотомии [5, 6]
Трансуретральная лазерная эндопиелотомия – один из сравнительно новых и активно развивающихся методов лечения непротяженных стриктур ЛМС. Ранее были проведены исследования эффективности трансуретральной гольмиевой (Ho:Yag) эндопиелотомии [1,2], однако внедрение в клиническую практику тулиевого волоконного лазера (Tm Fiber) открывает новые перспективы в лечении данной категории пациентов [3]. В связи с этим нами была поставлена следующая цель исследования – оценить эффективность трансуретральной тулиевой лазерной эндопиелотомии. Для достижения поставленной цели были выдвинуты следующие задачи: определить критерии отбора пациентов на выполнение трансуретральной тулиевой эндопиелотомии при стриктурах ЛМС, разработать методику выполнения трансуретральной тулиевой эндопиелотомии, оценить эффективность метода, сравнить результаты трансуретральной тулиевой эндопиелотомии с лапароскопической пластикой ЛМС.
Материалы и методы. Проспективное исследование проведено на базе отделения урологии ГБУЗ ГКБ им. Д. Д. Плетнёва с декабря 2016 по декабрь 2018 г. В исследование включены 94 пациента со стриктурами ВМП. Дизайн исследования был одобрен этическим комитетом ГБУЗ ГКБ им. Д. Д. Плетнёва. Перед включением в исследование нами получено информированное согласие всех пациентов. Пациенты, его не подписавшие, были исключены из исследования.
В основную группу включены 48 пациентов (возраст от 19 до 74 лет, 26 мужчин), которым выполняли трансуретральное рассечение стриктур ЛМС (эндопиелотомии) с использованием отечественного тулиевого волоконного лазера («FiberLase U1», ИРЭ-Полюс, Россия). В контрольную группу вошли 46 пациентов (возраст от 29 до 64 лет, 27 мужчин), которым провели лапароскопическую пластику ЛМС по технике Andersen–Hynes.
Всем больным на предоперационном этапе провели клинико-лабораторное обследование, включившее сбор анамнеза, жалоб, анализов крови и мочи, ультразвуковое исследование (УЗИ) с допплерографией (оценивали степень пиелоэктазии, камни, наличие добавочного сосуда), МСКТ-урографию или экскреторную урографию (определялась протяженность стриктуры, камни, добавочный сосуд), радиоизотопное исследование функции почек и антеградную пиелографию (для уточнения стояния нефростомического дренажа или сомнений в локализации уровня обструкции). Основное интраоперационное диагностическое мероприятие заключалось в проведении ретроградной уретеропиелографии и уретеропиелоскопии (табл. 1, 2).


На основании ранее изученных нами критериев эффективности эндопиелотомии [3] основными критериями включения пациентов в основную группу были первичные или рецидивные стриктуры ЛМС протяженностью не более 1 см, с дефицитом почечной секреции легкой или умеренной степени и пиелоэктазией не более 4 см. Мы также не включали в основную группу пациентов, имевших перекрестный (добавочный) сосуд в зоне ЛМС. Как видно из табл. 1 и 2, в основной группе (трансуретральная тулиевая эндопиелотомия) по сравнению с контрольной (лапароскопическая пластика ЛМС) было значительно больше пациентов с более сохранной функцией ипсилатеральной почки, с короткими (менее 1 см) и рецидивными стриктурами ЛМС, с меньшей выраженностью пиелоэктазии и отсутствовали стриктуры, причиной которых стал перекрестный сосуд.
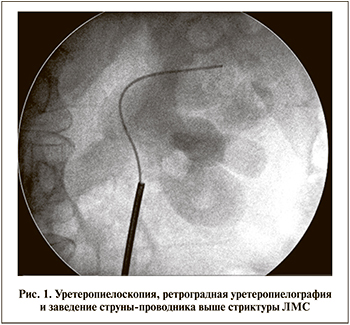 Техника трансуретральной тулиевой эндопиелотомии. Под спинномозговой или эпидуральной анастезией пациента укладывали в типичное для трансуретральных вмешательств литотомическое положение. В качестве первого этапа проводили диагностическую трансуретральную уретеропиелоскопию ригидным эндоскопом (наружный диаметр – 7,5–9 Fr, диаметр инструментального канала – 3,5–5 Fr) и выполняли ретроградную уретеропиелографию (рис. 1). Заведение ригидного уретеропиелоскопа в мочеточник в большинстве случаев не требует дилатации мочеточникового устья, позволяет осматривать сужение на глазах и максимально атравматично проводить струну-проводник выше сужения. После осмотра стриктуры и проведения через нее струны-проводника уретеропиелоскоп удаляли и вновь заводили его в мочеточник до сужения помимо проводника. Рассечение стриктуры проводили в латеральном или заднелатеральном направлении лазерным аппликатором диаметром 400–600 мкм, который подводили к сужению по рабочему каналу уретеропиелоскопа. Селективно рассекали все слои и рубцовые ткани суженного участка по всей длине с заходом на визуально неизмененную ткань (рис. 2а, б). Обычно использовали энергию импульса 1 Дж и частоту 10 Гц. К ряду пациентов применяли лазерное волокно 200 мкм, в этом случае оно находилось в одном рабочем канале со страховым проводником. С учетом отличного гемостатического эффекта тулиевого волоконного лазера, обеспечивающего качественную эндоскопическую картину, у ряда пациентов при непосредственном рассечении стриктуры страховой проводник, когда он мешал выполнять инцизию, убирали из операционного поля, подтягивая его в дистальном направлении.
Техника трансуретральной тулиевой эндопиелотомии. Под спинномозговой или эпидуральной анастезией пациента укладывали в типичное для трансуретральных вмешательств литотомическое положение. В качестве первого этапа проводили диагностическую трансуретральную уретеропиелоскопию ригидным эндоскопом (наружный диаметр – 7,5–9 Fr, диаметр инструментального канала – 3,5–5 Fr) и выполняли ретроградную уретеропиелографию (рис. 1). Заведение ригидного уретеропиелоскопа в мочеточник в большинстве случаев не требует дилатации мочеточникового устья, позволяет осматривать сужение на глазах и максимально атравматично проводить струну-проводник выше сужения. После осмотра стриктуры и проведения через нее струны-проводника уретеропиелоскоп удаляли и вновь заводили его в мочеточник до сужения помимо проводника. Рассечение стриктуры проводили в латеральном или заднелатеральном направлении лазерным аппликатором диаметром 400–600 мкм, который подводили к сужению по рабочему каналу уретеропиелоскопа. Селективно рассекали все слои и рубцовые ткани суженного участка по всей длине с заходом на визуально неизмененную ткань (рис. 2а, б). Обычно использовали энергию импульса 1 Дж и частоту 10 Гц. К ряду пациентов применяли лазерное волокно 200 мкм, в этом случае оно находилось в одном рабочем канале со страховым проводником. С учетом отличного гемостатического эффекта тулиевого волоконного лазера, обеспечивающего качественную эндоскопическую картину, у ряда пациентов при непосредственном рассечении стриктуры страховой проводник, когда он мешал выполнять инцизию, убирали из операционного поля, подтягивая его в дистальном направлении.
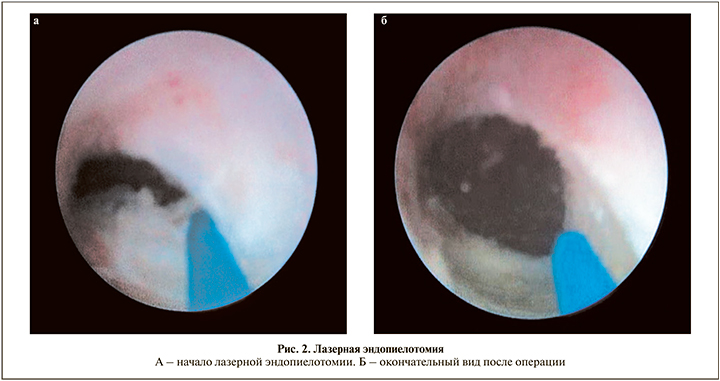
Операцию заканчивали установкой по струне-проводнику внутреннего стента диаметром 6–8 Fr на срок 6–8 нед. В послеоперационном периоде всем больным проводили антибактериальную, противовоспалительную и по показаниям инфузионную терапию на фоне дренирования ВМП внутренним стентом.
 Лапароскопическую пиелопластику по Andersen–Hynes выполняли по стандартной методике (рис. 3). Всем пациентам дренирование осуществляли с помощью внутреннего стента диаметром 6–8 Fr также на срок 6–8 нед.
Лапароскопическую пиелопластику по Andersen–Hynes выполняли по стандартной методике (рис. 3). Всем пациентам дренирование осуществляли с помощью внутреннего стента диаметром 6–8 Fr также на срок 6–8 нед.
Спустя 6–8 нед. после операции интубирующие трубки удаляли. Контрольные обследования на основе оценки субъективных данных (наличия болей, дискомфорта в поясничной области на стороне операции), а также оценки объективных параметров (ультрасонографического и радиоизотопного исследований почек, в ряде случаев – экскреторной урографии и МСКТ) проводили через 8 нед., 6, 12 и 24 мес. после операции. Показателями, позволившими расценивать отдаленные результаты как положительные, считали отсутствие клинической симптоматики, снижение (отсутствие) пиелокаликоэктазии, отсутствие нарушения (улучшение) пассажа контрастного вещества по ВМП, улучшение функции почек.
Сопутствующие камни почки чаще всего удаляли во время операций, при невозможности – после них, используя различные варианты перкутанной и трансуретральной нефролитотрипсии и дистанционную литотрипсию.
Полученные результаты заносились в базу данных Microsoft Excel, и с помощью встроенных статистических формул производился расчет среднего значения, стандартного отклонения. Достоверность межгрупповых отличий оценивалась с помощью критерия Стьюдента, достоверным считалось р<0,05.
Результаты. Интраоперационные и ранние послеоперационные результаты представлены в табл. 3. Ни в одном случае не возникло послеоперационного кровотечения.
У всех пациентов после удаления стента было отмечено уменьшение лоханки в размерах.
В сроки наблюдения 24 мес. и более контрольное обследование прошли 36 (75%) пациентов основной группы и 29 (63%) контрольной. Основной причиной пропуска контрольных обследований стало проживание в другом населенном пункте.
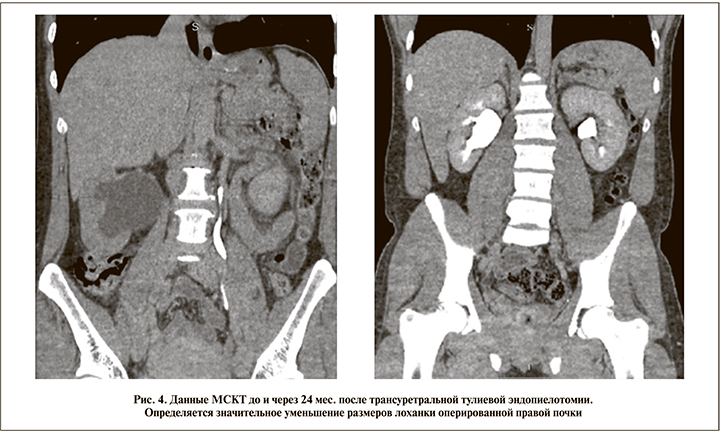
В обеих группах отмечен положительный результат оперативного лечения (отсутствие клинической симптоматики), хорошая (удовлетворительная) проходимость ВМП; уменьшение пиелокаликоэктазии отмечено у 34 (94,4%) пациентов основной и 28 (96,5%) контрольной групп, улучшение функции почки по данным радиоизотопного исследования – у 26 (72,2%) и 26 (89,6%) соответственно (рис. 4). Рецидив стриктуры после проведенного оперативного лечения отмечен лишь у 2 (4,2%) пациентов основной группы и 1 (2,2%) контрольной. Всем выполнена повторная трансуретральная тулиевая эндопиелотомия.
Обсуждение. Согласно полученным в ходе настоящего исследования данным, на выполнение лапароскопической пиелопластики уходило статистически значимо больше времени, чем на трансуретральную тулиевую эндопиелотомию. Кроме того, после пиелопластики пациентам на некоторое время устанавливали страховой дренаж, они дольше находились в стационаре и на уретральном дренировании. В то же время у пациентов после эндопиелотомии достоверно чаще отмечалось обострение воспалительного процесса в послеоперационном периоде, что, видимо, было связано с жидкостной ирригацией во время операции. В группе эндопиелотомии возникло одно интраоперационное кровотечение, купированное консервативными мероприятиями.
Следует отметить, что общее среднее время, затраченное на выполнение лапароскопической пиелопластики, было на 19±12 мин больше указанной в табл. 3, где приведено среднее время непосредственно лапароскопической операции. Дело в том, что всем больным перед данной операцией мы проводим трансуретральную уретеропиелоскопию не только для того, чтобы выполнить ретроградную уретеропиелографию, уточнить диагноз и установить внутренний стент, но и для того, чтобы исключить конфликт в зоне пузырно-мочеточникового соустья, где нередко встречается дисплазия тканей с сужением мочеточника, особенно при первичных идиопатических стриктурах ЛМС, в дальнейшем приводящая к обструктивной уропатии и неэффективности хорошо выполненной пластики ЛМС. Так, в нашем исследовании подобные изменения зоны пузырно-мочеточникового соустья определились у 5 (13,9%) пациентов из 36 с первичными стриктурами в группе лапароскопической пиелопластики и у 3 (15,8%) из 19 в группе эндопиелотомии.
На основании полученных клинических результатов можно сделать вывод об эффективности трансуретральной тулиевой (Tm Fiber) эндопиелотомии в лечении стриктур ЛМС. К преимуществам данной операции относятся значительное снижение операционной травмы, возможность выполнять вмешательство в отношении больных с невозможностью проведения эндотрахеального наркоза, а также значительное снижение сроков госпитализации и послеоперационной реабилитации пациентов. Среди других преимуществ трансуретральной тулиевой эндопиелотомии следует назвать отсутствие травмы почечной паренхимы, необходимости в нефростомии, более контролируемую инцизию места сужения (в отличие, например, от эндопиелотомии «холодным» ножом или гольмиевым лазером) и, видимо, из-за особенностей тулиевого волоконного лазера, проникающего вглубь тканей только на 0,2 мм, формирование более мягкого послеоперационного рубца, что может препятствовать формированию рецидивной стриктуры в области операции.
При выборе показаний к данной операции, с нашей точки зрения, следует учитывать ряд факторов [3].
- Этиология стриктуры является одним из наиболее важных факторов, влияющих на отдаленные результаты вмешательства. В литературе продолжаются обсуждения касаемо того, в лечении первичных или рецидивных (вторичных) стриктур удается получить лучшие результаты при использовании трансуретральных эндоскопических вмешательств [4, 5].
- Протяженность стриктуры является одним из главных факторов, определяющих успех вмешательства [2, 3, 6]. Согласно проведенным ранее исследованиям, результаты эндотомии коротких стриктур ВМП статистически значимо (p<0,05) отличаются в лучшую сторону от результатов лечения протяженных стриктур. Так, в работе [3] при протяженности стриктуры до 0,5 см успешный результат был достигнут в 97,6% наблюдений, от 0,6 до 1 см – в 89,1% и при длине стриктуры более 1 см – лишь в 63,2% случаев. Таким образом, протяженная (более 1 см) стриктура ВМП может оказаться относительным противопоказанием к проведению эндотомии. Так как в ходе операции участок сужения не удаляют, а лишь рассекают, то чем протяженнее стриктура, тем на большем расстоянии нарушено кровообращение и иннервация, следовательно, более вероятно, что данный участок в дальнейшем не сможет адекватно функционировать, несмотря на отсутствие механической обструкции. Также при протяженных стриктурах необходимо производить и более протяженный разрез, что повышает вероятность развития мочевого затека и прогрессирования парауретерального фиброза и как следствие – может приводить к рецидиву стриктуры в отдаленном периоде. В связи с вышеизложенным в нашем исследовании всем пациентам с протяженностью сужения более 1,0 см выполнялась лапароскопическая ампутационная пластика по Andersen–Hynes.
- Степень пиелоэктазии также является важным аспектом в выборе метода оперативной коррекции стриктуры ЛМС. В связи с наличием зависимости развития дистрофических изменений в стенке лоханки от возрастающей дилатации ЧЛС, в перспективе приводящих к нарушению сократительной способности ЧЛС и нарушению пассажа мочи вне зависимости от устраненной обструкции, нами определен допустимый порог пиелокаликоэктазии для выполнения тулиевой лазерной эндопиелотомии не более 4 см.
- Функциональное состояние почки. Следует отметить, что снижение результатов эндопиелотомии у больных с выраженным дефицитом секреторной функции почки также связано и с выраженностью пиелокаликоэктазии, с длительностью существования стриктуры. Дефицит секреторной функции почки более 75% статистически значимо (р<0,05) снижает отдаленные результаты эндотомии стриктур ЛМС [3, 6]. Таким образом, применение тулиевой эндопиелотомии оправданно при сохранной функции почки или легкой степени нарушения ее функции.
- Методом оперативного лечения стриктуры ЛМС, обусловленной наличием пиело-вазального конфликта, во всех случаях была антевазальная пластика из лапароскопического доступа из-за невозможности устранить причину образования стриктуры ЛМС при трансуретральной уретеропиелоскопии, а также для предотвращения осложнений, связанных с повышенным риском кровотечения из перекрестного сосуда [6].
Заключение. Еще несколько лет назад ограничивающими факторами при выборе метода эндоскопической коррекции стриктур ЛМС были удаленность стриктуры от зоны доступа, манипуляционная ограниченность, плохая оптическая видимость зоны воздействия. С усовершенствованием технического оснащения, улучшением видеопередачи и уменьшением размеров рабочего инструментария вышеуказанные проблемы отошли на второй план. И, хотя тулиевая ретроградная эндопиелотомия не сможет полностью заменить такой метод хирургической коррекции, как лапароскопическая пластика ЛМС, признанная во всем мире «золотым» стандартом в лечении данной категории пациентов, при определенных показаниях она может стать достойной альтернативой малоинвазивного лечения. Преимущества этой операции в виде хорошего клинического эффекта при значительном сокращении времени операции и более быстрой реабилитации пациентов выглядят весьма многообещающе.
В заключение следует отметить, что данная работа направлена на решение одной из многочисленных научных проблем, стоящих на данном этапе развития суправезикальной эндоурологии. Требуют ответа многие вопросы, связанные со сроками, способами и методами шинирования стриктуры. Поскольку это наш первый опыт в применении данного метода лечения стриктур ЛМС, необходимо дальнейшее более глубокое изучение данного вопроса.



