Введение. Пластика пиелоуретерального сегмента (ПУС) из лапароскопического доступа успешно применяется в коррекции врожденного гидронефроза у детей разного возраста во многих лечебных учреждениях [1–3]. При формировании пиелоуретероанастомоза в основном используется методика пиелопластики по Хайнс–Андерсену [3–5].
Лапароскопический трансперитонеальный доступ к почке в большинстве случаев не определяет длительности вмешательства и не сопровождается значимыми техническими трудностями для врачей с разным опытом выполнения подобных операций [6, 7].
Сложности в эргономике и необходимость интракорпорального завязывания массы узлов служат основным фактором увеличения продолжительности пластического этапа операции [8], что требует усовершенствования его техники. Для решения данной проблемы мы использовали разработанную нами нисходящую двухузловую технику (НДУТ) создания анастомоза.
Цель исследования: оценить хирургическую кривую обучения и преимущества двухузловой лапароскопической пиелопластики (ЛП) при обструкции ПУС у детей.
Материалы и методы. Проведен ретроспективный анализ историй болезней 98 пациентов, находившихся на лечении в Детской городской клинической больнице № 9 им. Г. Н. Сперанского, Москва, и в Клинической больнице скорой медицинской помощи № 7, Волгоград, в возрасте 3–24 мес. с односторонним гидронефрозом III–IV степеней по классификации SFU в модификации Onen [9]. Исследование одобрено локальными этическими комитетами двух клиник. Лапароскопическая пиелопластика всем детям выполнена по методике Хайнс–Андерсена с минимальной резекцией лоханки.
Для сравнения различных техник формирования пиелоуретерального анастомоза пациенты разделены на две группы: в первой (n=59) применена НДУТ, во второй (n=39) – стандартная узловая техника (УТ) пиелопластики (табл. 1).

Пациенты оперированы двумя хирургами из разных клиник. Хирург 1 обладал большим опытом проведения ЛП и использовал обе сравниваемые техники. Хирург 2 не имел достаточного навыка интракорпорального завязывания узлов и находился на этапе освоения НДУТ.
Оперативное лечение проводили детям, которым ранее не выполнялось хирургического вмешательства на верхних мочевых путях. Дооперационная диагностика гидронефроза включала помимо общеклинических и лабораторных исследований стандартные методы визуализации: УЗИ с оценкой ренальной гемодинамики, диуретическую пиелоэхографию с определением характера нарушения уродинамики, экскреторную урографию. В сомнительных случаях для уточнения причины обструкции ПУС применяли МРТ и мультислайсовую КТ с 3D-реконструкцией, что позволяло выбирать оптимальный операционный доступ.
Показания к операции: гидронефроз III–IV степеней со снижением объема функционирующей паренхимы и подтвержденной обструкцией ПУС. Критерии исключения: в исследование не включались пациенты с гидронефрозом подковообразной или дистопированной почки, а также с патологией почечной ротации.
Критерии сравнения двух групп: среднее время операции, кривые обучения, частота послеоперационных осложнений и функциональные результаты лечения. Для определения уровня сложности двух техник формирования анастомоза использовали сравнение кривых обучения обоих хирургов при НДУТ и при УТ пиелопластики, выполняемой только хирургом 1.
Все реконструктивные операции осуществляли трансперитонеальным доступом. Устанавливали три троакара (3–5 мм), оптический порт вводили параумбиликально, инструментальные – в подвздошной области и в мезогастрии по среднеключичной линии на стороне пораженного органа. Давление в брюшной полости при создании карбоксиперитонеума не превышало 9–10 мм рт.ст. Визуализировали почку с расширенной лоханкой, вскрывали капсулу Герота. Затем выделяли ПУС и проксимальную часть мочеточника, определяли причину гидронефротической трансформации и оценивали состояние почечной паренхимы. На лоханку накладывали шов-держалку (монофиламент 4/0).
Техника выполнения – НДУТ. После отсечения мочеточника, его спатуляции формирование анастомоза начинали с наложения первого шва (нить Vicryl или PDS 5–6/0) на верхнюю часть разрезов лоханки и мочеточника. После завязывания узла начинали сшивание задней губы сверху вниз со стороны просвета мочеточника и лоханки в отличие от УТ, когда сшивание выполняется с внешней стороны (рис. 1).
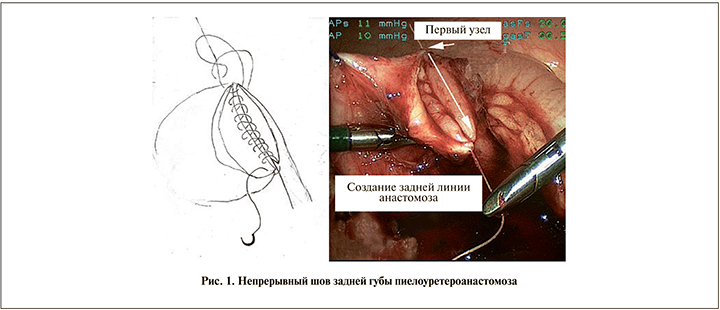
При этом иглу проводили через стенки лоханки и мочеточника в направлении снаружи вовнутрь. Проведение иглы заканчивали на уровне апикальной части разреза мочеточника так, что она оставалась снаружи. После установки наружного стента-пиелостомы формирование передней губы анастомоза начинали со вкола иглы в мочеточник в направлении снаружи. В результате получался П-образный шов, выворачивающий слизистую мочеточника и лоханки и обеспечивающий хорошую адаптацию стенок анастомоза. Далее той же иглой сшивали переднюю губу анастомоза и после закрытия просвета лоханки завязывали второй узел рядом с первым в начальной точке шва (рис. 2).
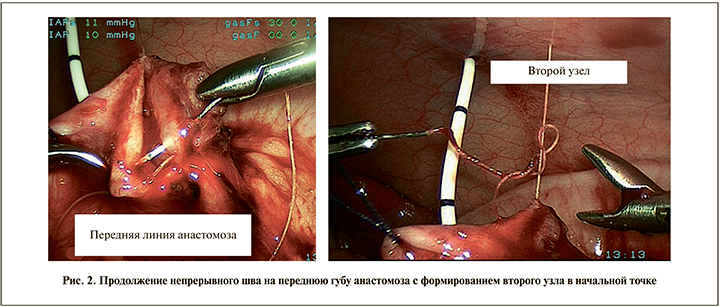
При выполнении операции по стандартной методике анастомоз создавали, сшивая заднюю и переднюю губы отдельными узловыми швами [10]. Зону анастомоза дренировали наружным или внутренним стентом.
После наложения анастомоза независимо от техники шов-держалку на лоханке удаляли, дренаж в паранефральное пространство проводили через нижний порт и фиксировали к коже. При наличии показаний устанавливали дренаж (8–10 Ch) в брюшную полость на 48–72 ч. Наружный стент-пиелостому удаляли через 18±6 сут. после пиелопластики.
В послеоперационном периоде амбулаторно проводили УЗ-контроль анатомо-функционального состояния почек через 1, 3 и 6 мес. после пиелопластики.
Статистическая обработка данных выполнена с использованием пакетов прикладных программ Statistica 10. Проверку на нормальность распределения анализируемых непрерывных переменных осуществляли с помощью теста Колмогорова–Смирнова. При нормальном распределении значения количественных показателей представлены в виде среднего (М) и стандартного отклонения (SD). Разность статистических показателей считали значимой при р<0,05. Для определения статистической значимости при бинарных переменных использовали точный критерий Фишера.
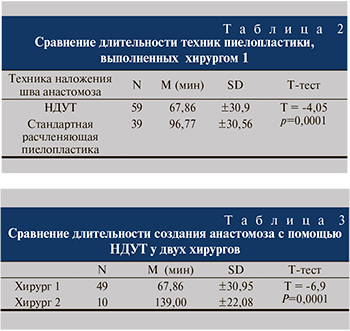 Результаты. Лапароскопическая нисходящая двухузловая пиелопластика во всех случаях была успешной и прошла без конверсии и интраоперационных осложнений. В группе НДУТ среднее время операции у хирурга 1 составило 67,85 мин, у хирурга 2 – 139 (табл. 2, 3), тогда как во второй группе, в которой использовалась традиционная УТ, среднее время составило 96,76 мин (табл. 2). Разница во времени вмешательства была статистически значимой.
Результаты. Лапароскопическая нисходящая двухузловая пиелопластика во всех случаях была успешной и прошла без конверсии и интраоперационных осложнений. В группе НДУТ среднее время операции у хирурга 1 составило 67,85 мин, у хирурга 2 – 139 (табл. 2, 3), тогда как во второй группе, в которой использовалась традиционная УТ, среднее время составило 96,76 мин (табл. 2). Разница во времени вмешательства была статистически значимой.
Ни одного интраоперационного осложнения зафиксировано не было. Послеоперационные осложнения у хирурга 1 (подтекание мочи по паранефральному дренажу и болевой синдром) отмечены только у двух пациентов группы НДУТ и были связаны с дисфункцией внешнего стента, а также с самопроизвольным его извлечением. У хирурга 2 осложнений в послеоперационном периоде не отмечено.
В группе УТ после пластической операции возникли два осложнения – длительное подтекание мочи по паранефральному дренажу и стент-ассоциированная инфекция (табл. 4). Это сопоставимо с данными литературы [11, 12].

Динамику накопления опыта выполнения лапароскопических операций принято иллюстрировать с помощью кривой обучения [13–15]. В качестве критерия в нашем исследовании созданы кривые обучения для каждого вида операции на основании динамики продолжительности вмешательства.
При выполнении хирургом 1 операции стандартным способом отмечено, что имелась явная кривая обучения и линия тренда с увеличением количества операций снижалась (коэффициент достоверности аппроксимации R2 составил 0,74). Минимальная продолжительность вмешательства достигалась после проведения первых 26 операций (рис. 3), длительность выполнения которых была значимо больше, чем последующих (149,9±45,7 и 73,0±15,4 мин соответственно, р=0,0001). В период освоения метода НДУТ кривая обучения у хирурга 1 практически отсутствовала, коэффициент достоверности аппроксимации R2 составлял 0,2 (рис. 3).
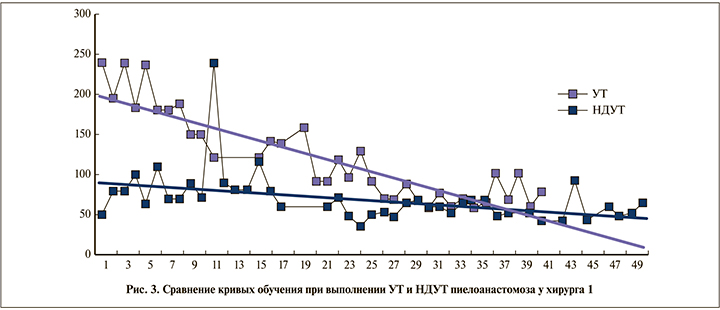
Сравнение длительности операций, выполненных хирургом 1 после освоения им УТ формирования анастомоза, не выявило статистически значимых различий – 73,2±15,9 (УТ) и 67,9±30,9 мин (НДУТ) (t=0,6; p=0,54).
Среднее время операции у хирургов 1 и 2 значимо отличалось, что объяснялось отсутствием достаточного опыта выполнения ЛП у хирурга 2. Вместе с тем имелось статистически значимое различие в длительности вмешательств методом НДУТ у хирурга 2 (144,5±25,1 мин) и при освоении стандартной УТ пиелопластики хирургом 1 (194,0±37,7 мин, t=3,7; p=0,002).
Разработанная нисходящая двухузловая техника позволила сократить время оперативного вмешательства на 30%. По прошествии года в обеих группах были получены положительные результаты, выраженные в уменьшении степени гидронефротической трансформации и увеличении объема функционирующей паренхимы, что свидетельствовало о хорошей проходимости созданного неопиелоуретероанастомоза.
Обсуждение. Лапароскопическая пиелопластика (ЛП) у ребенка впервые была выполнена в 1995 г. С. Peters et al. [16] и приобрела огромную популярность в качестве хирургического лечения обструкции ПУС даже у маленьких детей/младенцев.
Опыт эндовидеохирургической пиелопластики был представлен в ретроспективном исследовании S. Sukumar et al. в 2015 г. [9]. Отмечено, что до 2010 г. доля ЛП составляла не более 5% от открытых вмешательств. Время операции достигало 3–7 ч, причем большая его часть уходила на создание анастомоза, что связано со сложностью его наложения при данном доступе и определило необходимость поиска новых технических решений данной проблемы.
Отработка шва анастомоза на тренажере помогает получать необходимые технические навыки и сокращать время операции [17]. Для упрощения трудоемкого процесса интракорпорального ушивания анастомоза и сглаживания кривой обучения для неопытных хирургов S-Y. Huang et al. [18] предложили гибридную процедуру пиелопластики, заключающуюся в выполнении основного этапа операции экстракорпорально путем продлевания разреза в месте установки одного из портов (эпигастральной области) до 2–3 см в длину после трансперитонеального выделения и мобилизации лоханки и зоны ПУС.
Ряд авторов [19–22] считает, что нерасчленяющая пиелопластика не только упрощает технику вмешательства, но и сокращает время операции за счет меньшего числа интракорпоральных швов.
Однако сравнительный анализ лоскутной техники с расчленяющим способом пластики ПУС показал отсутствие статистически значимой разницы в продолжительности вмешательств [23].
Для уменьшения времени операции, облегчения наложения швов и интракорпорального завязывания узлов разрабатывались различные модификации мануальных швов анастомоза — LASDISS-шов [24], шов W-типа [25], а также механических сшивающих устройств Endo-Stitch [26], EndoGia [27]. R.L. Crubb рекомендовал использовать линейный степлерный аппарат [28], A.L. Shalval et al. – Lapra-Ty-клипсы [29].
Результаты нашего исследования созвучны с данными, полученными A. Mandhani et al. [11], согласно которым разработка новых техник наложения пиелоуретероанастомоза и приобретение опыта выполнения лапароскопических пиелопластик приводят к сокращению времени операции при обструкции ПУС в среднем до 106 мин (диапазон – 65–145 мин), что особенно важно в лечении пациентов первых лет жизни с данной патологией.
Заключение. Использование НУДТ при гидронефрозе в отношении детей вне зависимости от причины его формирования позволяет хирургу с опытом ЛП сокращать продолжительность операции до 67,86 мин и положительно влияет на кривую (на индивидуальный этап) обучения менее опытного уролога.



