Введение. Этапное хирургическое лечение проксимальных форм гипоспадии у детей по методике Bracka – это один из методов, позволяющий получать хорошие функциональные и косметические результаты [1–4]. Данная методика предполагает использование свободного лоскута крайней плоти, а при ее отсутствии – слизистой щеки. Применение лоскута крайней плоти менее травматично по сравнению с лоскутом из слизистой щеки. В то же время у взрослых урологи используют лоскут из слизистой щеки для уретропластики при стриктурах уретры и считают его наилучшим материалом [5]. Обращает на себя внимание крайне малое число исследований, посвященных сравнительной оценке лоскутов крайней плоти и слизистой щеки, применяемых для лечения гипоспадии у детей [2].
Целью исследования стало проведение сравнительного анализа результатов гистологического исследования свободных лоскутов крайней плоти и слизистой щеки, использованных в качестве материала для уретропластики при проксимальных формах гипоспадии у детей.
Материалы и методы. Проанализированы результаты гистологического исследования свободных лоскутов, использованных в лечении 10 пациентов с проксимальными формами гипоспадии (7 – мошоночная и 3 – промежностная), прооперированных по методике Bracka в отделении уроандрологии Российской детской клинической больницы Минздрава России с 2013 по 2016 г. Возраст больных варьировался от 1 года до 17 лет (средний возраст – 4 года). Первую группу составили 5 пациентов с первичной проксимальной гипоспадией, у которых использован лоскут крайней плоти. Во вторую группу включены 5 пациентов, прооперированных с применением лоскута слизистой щеки; все пациенты перенесли от 1 до 4 повторных уретропластик по месту жительства и при поступлении имели множественные кожные рубцы, свищи, деформации полового члена.
Техника операции Bracka с использованием лоскута крайней плоти и слизистой щеки. На первом этапе выполняли выпрямление полового члена путем мобилизации кожи ствола полового члена до основания, удаление хорды и/или рубцов на вентральной поверхности полового члена. Головку полового члена срединно рассекали от основания до дистального края предполагаемой области неомеатуса.
При использовании крайней плоти свободный лоскут необходимого размера выкраивали для укрытия образовавшегося дефекта на вентральной поверхности полового члена. Поскольку у всех пациентов была проксимальная форма гипоспадии, лоскута только внутреннего листка было недостаточно и применяли участок наружного листка крайней плоти. При использовании лоскута слизистой щеки последний выкраивали из боковой поверхности щеки с переходом на нижнюю губу.
Перед подшиванием в обоих случаях лоскуты тщательно освобождали от жировой клетчатки. Фиксацию лоскутов проводили по всей поверхности путем подшивания к половому члену узловыми швами в шахматном порядке. В конце операции накладывали компрессионную повязку с целью лучшего приживления лоскутов.
Ко второму этапу приступали спустя 6 мес., когда полностью завершался процесс приживления лоскута. Выполняли продольные параллельные разрезы по краям лоскута с огибанием меатуса. Осуществляли мобилизацию краев лоскута сформированной уретральной пластинки. На уретральном стенте тубуляризировали лоскут непрерывными швами. Артифициальную уретру укрывали мясистой оболочкой и кожей. Для всех пациентов способом отведения мочи в послеоперационном периоде служила пункционная цистостомия.
У всех пациентов, включенных в исследование, сформировался свищ уретры, ушитый через 6 мес. после уретропластики.
Забор материала для гистологического исследования выполняли через 6 мес. после уретропластики во время пластики свища уретры. В течение этого времени через артифициальную уретру происходило мочеиспускание. Изъятие материала осуществляли путем инцизионной биопсии. Окраску лоскутов проводили гематоксилином и эозином, использовали увеличение от 45 до 170. Гистологическую картину артифициальной уретры сравнивали с таковой нативной уретры.
Результаты. Гистологические особенности лоскутов крайней плоти. Ниже представлены результаты гистологического исследования артифициальной уретры, взятой у пациентов спустя 6 мес. после формирования ее из лоскута крайней плоти (рис. 1–3).
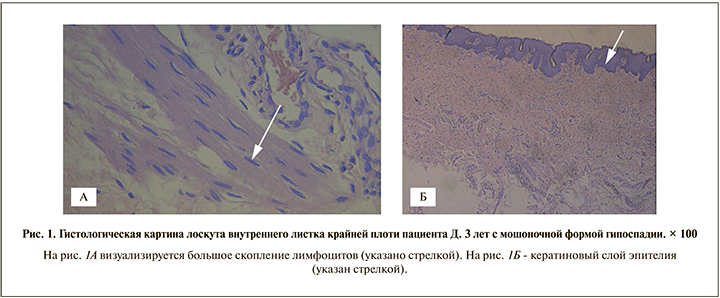
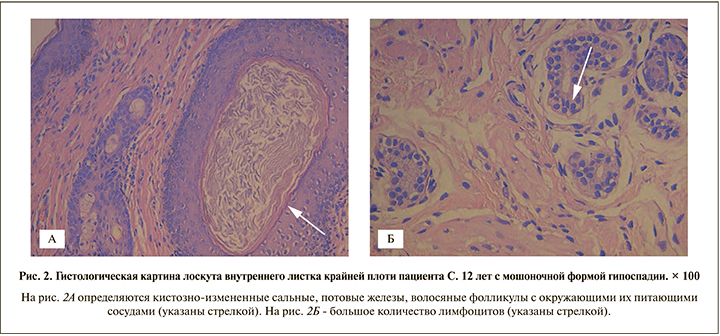
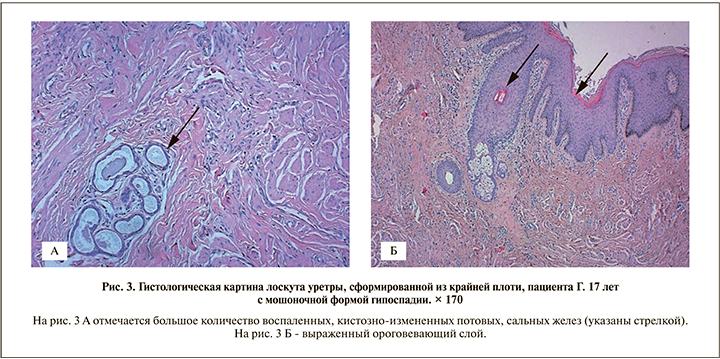
Во всех случаях в гистологических препаратах лоскутов из кожи крайней плоти определялись ороговевающий многослойный плоский эпителий, масса расширенных потовых и сальных желез с признаками воспаления, волосяных фолликулов.
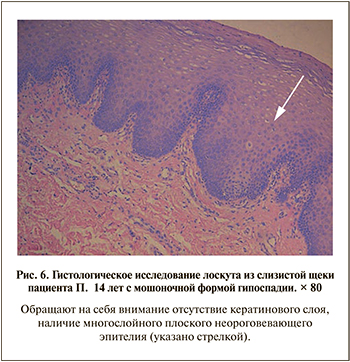
 Гистологические особенности лоскутов слизистой щеки. Как видно на рис. 4–6, всем пациентам второй группы лоскуты сохранили структуру тканей слизистой оболочки – многослойный плоский неороговевающий эпителий, при этом во всех лоскутах отсутствовали потовые и сальные железы.
Гистологические особенности лоскутов слизистой щеки. Как видно на рис. 4–6, всем пациентам второй группы лоскуты сохранили структуру тканей слизистой оболочки – многослойный плоский неороговевающий эпителий, при этом во всех лоскутах отсутствовали потовые и сальные железы.
Обсуждение. Стандарт результата лечения при всех формах гипоспадии остается высоким – реконструкция уретры с формированием меатуса на головке полового члена и обеспечение внешнего вида, приближенного к естественному. Достичь этого при проксимальных формах гипоспадии по сравнению с дистальными гораздо сложнее из-за большей протяженности дефекта уретры, наличия искривления полового члена, у части больных – расщепления и транспозиции мошонки.
Урологи применяют множество различных методик, однако одной из наиболее широко используемых и надежных служит этапная уретропластика по Bracka. Все методы лечения проксимальных форм гипоспадии характеризуются высокой частотой осложнений (от 27 до 68%), что свидетельствует о сложности проблемы [6, 7]. По мнению ведущих урологов [3, 5, 9], этапное оперативное лечение с применением свободных трансплантатов (лоскутов) позволяет получать надежные положительные функциональные и косметические результаты, а в случаях повторных неудачных операций остается единственно возможным методом из-за наличия рубцово-измененных тканей.
Первое описание применения лоскута слизистой щеки для формирования уретры при гипоспадии опубликовано в 1941 г. G. Humby в журнале «British Journal of Urology» [8]. Данный метод был популяризован хирургом R. A. Burger, в 1992 г. представившим результаты его успешного применения пациентам с гипоспадией [9]. В то же время широкой популярностью стал пользоваться метод этапной пластики уретры лоскутом крайней плоти, предложенный A. Bracka, из-за простоты применения и хороших функциональных результатов. Слизистую щеки предлагалось использовать в крайних случаях, когда необходимо создать уретру большой протяженности в условиях дефицита местных тканей при отсутствии крайней плоти. Связывали это с часто встречающимся рубцовым перерождением лоскута [10].
 В настоящее время урологи используют преимущественно лоскуты слизистой щеки, называя их «золотым» стандартом для уретропластики [5].
В настоящее время урологи используют преимущественно лоскуты слизистой щеки, называя их «золотым» стандартом для уретропластики [5].
Среди преимуществ слизистой щеки отмечают следующие:
- возможность получить трансплантат и, соответственно, артифициальную уретру большей протяженности даже для маленьких детей, что особенно важно при мошоночной и промежностной формах гипоспадии;
- при повторных операциях пациентам с множественными рубцами на коже только использование слизистой щеки делает возможным выполнение уретропластики;
- близость ее гистологического строения структуре слизистой нативной уретры [11, 12].
Большой интерес представляют результаты долгосрочного наблюдения за изменениями в неоуретре пациентов с гипоспадией. Опыт проведения операций при гипоспадии, превысивший 20 лет, имеет очень небольшое число реконструктивно-пластических хирургов. Один из немногих – это известный сербский уролог С. Перович, собственный опыт которого превысил 40 лет и учеником которого является Р. Джинович [13]. В статье доктора Джиновича приведен анализ результатов лечения 1176 пациентов со средним сроком наблюдения 60 мес. Количество осложнений после использования слизистой щеки в отдаленном периоде достоверно меньше по сравнению с лоскутом крайней плоти [13].
Выбор пластического материала для проведения уретропластики – слизистая щеки или кожа крайней плоти – остается предметом дискуссии. К сожалению, в литературе мы не встретили исследований, посвященных изучению изменений в неоуретре после уретропластики по поводу гипоспадии под действием мочи.
В нашей работе для всех пациентов время воздействия мочи на лоскут и срок забора материала для исследования составил 6 мес. – именно по прошествии этого срока после уретропластики мы выполняли ушивание свища уретры. Показано, что в группе пациентов, в отношении которых была использована крайняя плоть, неоуретра выстлана ороговевающим многослойным плоским эпителием с массой расширенных потовых и сальных желез с признаками воспаления, волосяных фолликулов. Воспалительная инфильтрация кожного лоскута была связана с длительным воздействием мочи. В норме внутренний листок крайней плоти покрыт многослойным плоским неороговевающим эпителием, однако при гипоспадии возможна его трансформация из-за аномального строения в виде капюшона по дорсальной поверхности. При таком строении лоскут крайней плоти подвергается еще более выраженному воздействию травмирующего фактора.
В группе пациентов со слизистой щеки стенка неоуретры представлена многослойным плоским неороговевающим эпителием при полном отсутствии потовых, сальных желез и воспалительных изменений в лоскуте.
Таким образом, в обеих группах с течением времени принципиальных изменений эпителия лоскутов не происходит, при этом эпителий лоскута из слизистой щеки продолжает быть некератинизированным, а в лоскуте из крайней плоти отмечается ороговение.
Заключение. По данным проведенного сравнительного гистологического анализа лоскутов крайней плоти и слизистой щеки, для лечения проксимальных форм гипоспадии у детей преимущество имеет лоскут слизистой щеки, обладающий такими особенностями, как ранняя реваскуляризация за счет развитой сосудистой сети, гистологическая схожесть (многослойный плоский неороговевающий эпителий) с тканью нативной уретры (многослойный цилиндрический эпителий), отсутствие потовых и сальных желез, являющихся причиной очагов хронического воспалительного процесса в уретре.



