Введение. Стриктура уретры (СУ) у мужчин – распространенное, склонное к рецидивированию и в ряде случаев сопряженное с трудностями при выборе оптимального метода лечения заболевание. Так, в США, по данным R.A. Santucci (2007), стриктуры уретры выявлены у 0,6% мужчин и обусловливают ежегодные расходы системы здравоохранения в размере 200 млн долл. [1]. Об относительной сложности достижения успеха при хирургическом лечении СУ можно судить по результатам недавно проведенной работы C. R. Benson et al. [2], согласно которой неудачу после передней и задней уретропластики в течение первого года и 5 лет констатируют в 18 и 25%, из них у 40 и 25% пациентов рецидивы развивались с медианой времени 5,1 и 4,1 мес. соответственно.
В зависимости от этиологии выделяют следующие основные виды СУ: идиопатическую, ятрогенную, воспалительную и травматическую [3–5]. Причины СУ варьируются в зависимости от стран и регионов, что определяется социально-экономическими, демографическими, географическими, медицинскими и другими факторами. Однако с увеличением частоты выполнения эндоскопических лечебно-диагностических манипуляций и использования уретральных катетеров, с развитием хирургии и лучевой терапии по поводу опухолей таза, а также с ростом оперативной активности по поводу гипоспадий частота ятрогенного повреждения уретры в последние годы заметно возросла. В настоящее время считается, что в развитых странах ятрогении служат самой частой причиной СУ, составляя более 45% всех случаев [6–8]. Тем не менее проблема ятрогенных СУ у мужчин остается недостаточно изученной.
 Цель исследования: изучить этиологию ятрогенных СУ, результаты оперативного лечения этой категории больных, а также влияние различных факторов риска на вероятность наступления послеоперационных рецидивов.
Цель исследования: изучить этиологию ятрогенных СУ, результаты оперативного лечения этой категории больных, а также влияние различных факторов риска на вероятность наступления послеоперационных рецидивов.
Материалы и методы. Наша работа была выполнена в дизайне ретроспективного сравнительного исследования с использованием нескольких групп сравнения. В него были включены 230 мужчин с ятрогенной стриктурой (облитерацией) уретры, которым проводили хирургическое лечение с 2008 по 2017 г. Возраст пациентов варьировался от 7 до 89 лет, составив в среднем 58,7±15,3 года (табл. 1). Большинство (60,5%) мужчин с ятрогенными СУ в изученной выборке были старше 60 лет, и чаще всего (52,2%) заболевание диагностировали у пациентов в возрасте от 60 до 74 лет.
Критерии включения в исследование: наличие у пациентов с СУ ятрогенного этиологического фактора, применение одного из методов оперативного лечения (реконструктивная операция или внутренняя оптическая уретротомия), отсутствие других этиологических факторов СУ.
Как видно из табл. 2, преимущественной локализацией СУ служил бульбозный отдел уретры изолированно или с вовлечением ряда расположенных отделов уретры (53,5%).
Длина СУ составила в среднем 5,8±4,7 см, варьируясь в диапазоне значений от 1 до 24 см. При этом почти у половины (47,8%) обследованных больных длина СУ превышала 4 см, что подразумевало использование аугментационных или заместительных методик уретропластики (табл. 3).
К пануретральным отнесены стриктуры протяженностью более 10 см, к мультилокусным – стриктуры, имеющие несколько обособленных участков сужения, между которыми расположены зоны здоровой ткани уретры независимо от длины и локализации (в одном или разных отделах уретры). В соответствии с указанными определениями в 143 (62,2%) наблюдениях СУ локализовались в передней уретре, в 29 (12,6%) – в задней, в 58 (25,2%) – одновременно в передней и задней уретре. Обращает на себя внимание, что протяженные стриктуры, расположенные в нескольких отделах уретры, а также пануретральные и мультилокусные стриктуры в целом составили более половины (50,5%) случаев.
В анализируемой группе СУ имела первичный характер (т.е. не было предшествовавшего лечения по этому поводу) у 107 (46,5%) пациентов, рецидивный – у 123 (53,5%).
Было выделено семь основных групп ятрогенных при-чин СУ:
- Трансуретральные операции на нижних и верхних мочевыводящих путях, включая трансуретральную резекцию предстательной железы (ТУРП) и мочевого пузыря (ТУРМП), контактную уретеролитотрипсию (КУЛТ).
- Катетеризация уретры, в том числе травматичное введение катетера или продолжительное нахождение катетера в уретре. Катетерная травма, которая чаще всего заключалась в насильственном удалении катетера Фоли с частично или полностью неспущенным баллоном.
- Последствия оперативной коррекции гипоспадии в детском возрасте (стенозы неоуретры, нередко в сочетании со свищами и конкрементами).
- Осложнения хирургического лечения (радикальная простатэктомия) и различных видов лучевой терапии рака предстательной железы (РПЖ).
- Последствия открытого хирургического лечения аденомы предстательной железы (чреспузырная аденомэктомия).
- Инстилляция в уретру химически агрессивных веществ (различные растворы нитрата серебра, спиртовой раствор хлоргексидина биглюконата) с целью лечения инфекций, передаваемых половым путем (ИППП).
- Другие причины, включающие такие оперативные вмешательства и их осложнения, как пенэктомия по поводу рака полового члена, экстирпация прямой кишки по поводу рака, удаление остроконечных кондилом уретры, эрозия уретры из-за сдавления манжеткой искусственного мочевого сфинктера.
Статистическую обработку данных проводили с помощью пакета прикладных программ StatSoftSTATISTICAv. 10.0 (США). Для оценки роли различных прогностических факторов в возникновении рецидива стриктуры уретры после оперативного лечения был проведен унивариантный анализ с расчетом показателя отношения шансов (ОШ) с 95% доверительным интервалом (ДИ) для каждого рассматриваемого признака. Различие считали достоверным при уровне значимости (p)<0,05. Роль различных прогностических факторов в возникновении рецидива СУ после оперативного лечения определена путем оценки независимого вклада каждого рассматриваемого признака в исход операции. Такой анализ предполагал расчет показателя ОШ с 95% ДИ для всех признаков. При этом статистически значимым считали различие при уровне значимости p<0,05. В число потенциальных предикторов наступления рецидива были включены следующие параметры: возраст пациента, техника операции, этиология, локализация, длина и характер клинического течения стриктуры уретры. При выполнении данного анализа каждый из изучаемых признаков был подразделен на две альтернативные категории. Градация признаков проведена с таким расчетом, чтобы выделенные категории максимально отличались по их возможному влиянию на результат лечения. При этом исходили из такого принципа: показатель с наиболее высокой частотой неудачи оперативного лечения противопоставляли с остальными вариантами данного признака. С учетом этого критерия выделены следующие категории исследуемых параметров для сопоставления по риску развития рецидива СУ после оперативного вмешательства: 1) возраст пациента: >44 и ≤44 лет; 2) техника операции: аугментационная и заместительная уретропластика и все остальные методики; 3) этиология стриктуры: коррекция гипоспадии и все остальные причины; 4) локализация стриктуры: передняя уретра и все остальные варианты; 5) длина стриктуры: ≥5,5 и <5,5 см; 6) характер клинического течения СУ: рецидивная и первичная стриктура.
 Обследование пациентов перед проведением оперативного лечения включало следующие методы: изучение жалоб, анамнеза заболевания и жизни; физикальное обследование; лабораторные исследования; урофлоуметрию с последующим определением объема остаточной мочи ультразвуковым методом; уретроскопию, уретрографию, по показаниям УЗИ уретры и других органов мочеполовой системы, МРТ малого таза с контрастированием. По результатам обследования, с учетом локализации и протяженности СУ, степени сужения мочеиспускательного канала, состояния местных тканей и возможности использования различных аутотрансплантатов выбирали один из следующих методов оперативного лечения: различные варианты анастомотической уретропластики, аугментационную уретропластику с использованием свободных графтов слизистой полости рта или кровоснабжаемых лоскутов крайней плоти, заместительную этапную уретропластику с использованием свободных графтов полости рта или крайней плоти.
Обследование пациентов перед проведением оперативного лечения включало следующие методы: изучение жалоб, анамнеза заболевания и жизни; физикальное обследование; лабораторные исследования; урофлоуметрию с последующим определением объема остаточной мочи ультразвуковым методом; уретроскопию, уретрографию, по показаниям УЗИ уретры и других органов мочеполовой системы, МРТ малого таза с контрастированием. По результатам обследования, с учетом локализации и протяженности СУ, степени сужения мочеиспускательного канала, состояния местных тканей и возможности использования различных аутотрансплантатов выбирали один из следующих методов оперативного лечения: различные варианты анастомотической уретропластики, аугментационную уретропластику с использованием свободных графтов слизистой полости рта или кровоснабжаемых лоскутов крайней плоти, заместительную этапную уретропластику с использованием свободных графтов полости рта или крайней плоти.
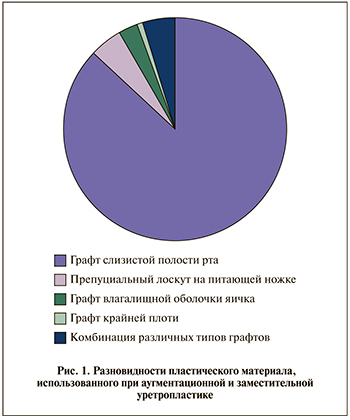
В общей сложности использовано 29 разновидностей оперативных вмешательств в виде одной техники либо комбинации из нескольких техник реконструктивной операции. Чаще всего применяли различные способы аугментационной и заместительной уретропластики – 108 (47%) пациентов. При этом в качестве пластического материала в большинстве наблюдений использовали графт слизистой полости рта (слизистая щеки или нижнелатеральной поверхности языка), тогда как другие типы свободных графтов и лоскутов на питающей ножке были применены намного реже (рис. 1). Наша тактика выбора пластического материала при аугментационных и заместительных уретропластиках состоит в том, что при первичных операциях мы практически в 100% случаев отдаем предпочтение свободным графтам полости рта. Использование лоскутов крайней плоти на питающей ножке допускаем при первичных стриктурах пенильной уретры (лоскут Orandi, который считаем самым надежным), локализованной в проекции безволосой кожи ствола полового члена и при рецидивных стриктурах, когда возможности забора слизистой полости рта уже исчерпаны. Использовать препуциальные лоскуты также может побудить отсутствие надежного питающего ложа для свободных графтов в области реконструкции.
Анастомотические варианты уретропластики в чистом виде (без сочетания с аугментационной техникой) были выполнены 90 (39,1%) пациентам. К анастомотической уретропластике отнесена и простатэктомия, выполненная позадилонным либо преректальным промежностным доступом, так как основной целью данной операции было формирование уретровезикального анастомоза после удаления облитерированного простатического отдела уретры и коррекции рубцовых изменений шейки мочевого пузыря. Основными видами анастомотической уретропластики в нашем исследовании для бульбозной уретры стали операция иссечения рубцово-измененного участка и анастомоза здоровых концов уретры по Хольцову, для бульбомембранозного отдела – операция Webster с выполнением необходимых стандартных приемов уменьшения натяжения области анастомоза. На долю этих операций пришлось по 32% всех анастомотических уретропластик (рис. 2). Третьей часто используемой нами методикой анастомотической уретропластики стала реконструкция стеноза везикоуретрального анастомоза (СВУА) после радикальной простатэктомии из преректального супрасфинктерного доступа по Young. Ранее мы показали преимущество этого доступа перед другими при реконструкции СВУА [9].

Остальные виды оперативных вмешательств были применены к 32 (13,9%) пациентам: промежностная либо пенильная уретрокутанеостомия – к 23 (10%), меатопластика – к 4 (1,7%) и внутренняя оптическая уретротомия (ВОУТ) – к 5 (2,2%).
Послеоперационный мониторинг включал выполнение следующих исследований: 1) уретрографии – перед удалением уретрального катетера (перикатетерная уретрография) или сразу после его удаления и через 6 и 12 мес. после операции всем пациентам; 2) урофлоуметрии – сразу после удаления уретрального катетера и через 3, 6 и 12 мес. после операции; 3) уретроцистоскопии – по показаниям при ухудшении качества мочеиспускания. По прошествии первого года наблюдения последующие обследования проводили с периодичностью 1 раз в год. При появлении жалоб обследование проводили вне зависимости от установленных протоколом сроков.
Успешной считали операцию, после которой в течение всего периода динамического наблюдения:
- регистрировали свободное самостоятельное мочеиспускание с нормальной максимальной скоростью при урофлоуметрии (Qmax), превышающей 13 мл/с без значимого количества (менее 100 мл) остаточной мочи;
- не возникало необходимости в выполнении дополнительных манипуляций и оперативных вмешательств (бужирование уретры, внутренняя оптическая уретротомия, повторная реконструктивная операция), направленных на восстановление нормального пассажа мочи.
В противном случае состояние расценивали как рецидив СУ, который подтверждали с помощью уретрографии и/или уретроскопии. Относительное сужение просвета мочеиспускательного канала после уретропластики, которое не приводило к нарушению акта самостоятельного мочеиспускания, не трактовали как неудачу оперативного лечения СУ.
Результаты. Сроки послеоперационного наблюдения пациентов составили 14–102 мес. при медиане 43 мес. Суммарная эффективность оперативного лечения ятрогенных СУ составила 84,8% (195/230). При этом успех лечения при всех вариантах анастомотической уретропластики достигнут 88,9% (80/90) пациентов, аугментационной и заместительной уретропластики – 81,5% (88/108) и при других видах операций – 84,4% (27/32) пациентов.
При СУ после трансуретральных вмешательств чаще всего были применены анастомотические методики уретропластики – в 57,1% (52/91). Это обстоятельство во многом обусловлено тем, что самой частой локализацией стриктур после трансуретральных операций оказались бульбозный и бульбомембранозный отделы. Различные варианты аугментационной и заместительной уретропластики использованы 31,9% (29/91) пациентов, другие виды операций –11% (10/91). Общая эффективность лечения стриктур после трансуретральных операций составила 87,9% (80/91).
При стриктурах, ассоциированных с катетеризацией уретры, наиболее часто использовали аугментационную или заместительную уретропластику – в 69,5% (41/59) наблюдений. Это стало следствием частой локализации посткатетерных стриктур в бульбозном и пенильно-бульбозном отделах уретры, а также достаточно большой долей среди них пануретральных и мультилокусных стриктур. Анастомотическая техника без дополнительного использования элементов аугментационной уретропластики применена только к 10,2% (6/59) пациентов, остальные виды операций, в том числе и ВОУ, –20,3% (12/59). Суммарная эффективность лечения стриктур после катетеризаций уретры составила 84,7% (50/59).
У пациентов с СУ после коррекции гипоспадии наиболее часто применяли аугментационную и заместительную техники уретропластики – 85,7% (24/28). Эффективность лечения стриктур после коррекции гипоспадии составила 78,6% (22/28).
При стриктурах уретры и СВУА после различных хирургических и лучевых методов лечения РПЖ в подавляющем числе наблюдений (78,6% [22/28]) выполняли различные варианты анастомотической уретропластики. При этом лишь к 10,7% (3/28) применена аугментационная уретропластика и к такому же числу – ВОУТ. Такое соотношение использованных при данной форме стриктуры видов лечения можно расценивать как закономерный итог того, что стриктуры после различных вариантов лечения РПЖ в основном локализованы в задней уретре, когда предпочтение отдается анастомотической уретропластике. В целом эффективность лечения стриктур и СВУА, возникших как осложнения лечения РПЖ, составила 82,1% (23/28).
В лечении СУ после открытой аденомэктомии большинством (77,8%) пациентов использована анастомотическая уретропластика, остальными – аугментационная техника. Общая эффективность операций при данном варианте СУ составила 77,8% (7/9).
При СУ после уретральных инстилляций во всех наблюдениях использовали различные варианты аугментационной или заместительной уретропластики. Лечение расценено как эффективное в 85,7% (6/7) случаев.
При стриктурах, возникших по другим причинам, были использованы все указанные разновидности оперативных техник, в том числе и промежностная уретрокутанеостомия. Эффективность лечения для этой группы пациентов составила 87,5% (7/8).
Таким образом, эффективность оперативного лечения всех этиологических подгрупп ятрогенных СУ оказалась довольно высокой и превысила 80%, за исключением подгруппы пациентов после коррекции гипоспадии в детском возрасте.
Завершающим этапом данного исследования был анализ влияния различных факторов риска на вероятность наступления рецидива СУ (табл. 4).
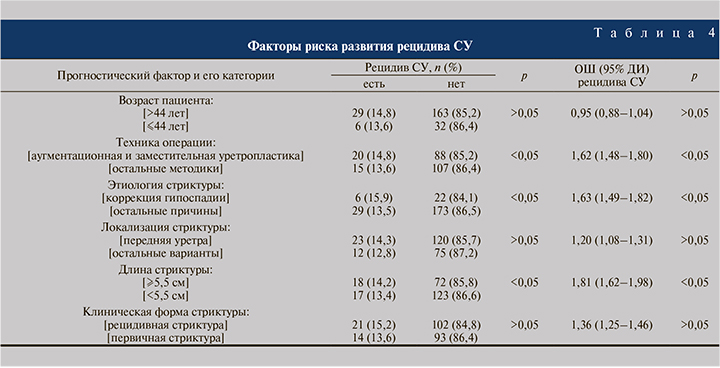
На основе полученных данных статистически значимыми независимыми факторами риска рецидива СУ после оперативного лечения признаны:
- аугментационная и заместительная техники уретропластики – повышение риска рецидива СУ в 1,62 раза;
- негативные последствия (осложнения) коррекции гипоспадии в детском возрасте – повышение риска рецидива СУ в 1,63 раза;
- протяженность стриктуры ≥5,5 см – повышение риска рецидива СУ в 1,81 раза.
Таким образом, протяженность СУ стала самым существенным фактором риска возможного послеоперационного рецидива.
Обсуждение. Изучение клинических характеристик ятрогенных СУ, эффективности их лечения и факторов риска послеоперационных рецидивов дало весьма интересные и практически значимые результаты. Как и СУ других этиологий [10], ятрогенные СУ преимущественно располагаются в бульбозном отделе уретры, который анатомически отличается большим диаметром просвета и окружен самым толстым спонгиозным телом по сравнению с другими отделами мочеиспускательного канала. Это позволяет широко применять различные методы уретропластики, включая анастомотическую без пересечения спонгиозного тела, а также вентральную аугментационную пластику с использованием оральных графтов. Эти щадящие методики сокращают время оперативного вмешательства и уменьшают количество таких побочных эффектов операции, как транзиторное расстройство эрекции, снижение чувствительности и синдром холодной головки полового члена. В целом выборка пациентов с ятрогенными СУ отличается сложностью оперативного лечения, что обусловлено большой частотой пануретральных, мультилокусных и рецидивных стриктур с выраженным спонгиофиброзом. Это требует применения широкого спектра методик реконструктивных операций на уретре и предъявляет высокие требования к оперирующему хирургу. Необходимость владения обширным хирургическим репертуаром при лечении стриктурной болезни уретры в современных условиях показана в работе М. И. Когана и соавт. [11]. Авторы отметили, что выполнение анастомотической уретропластики оказалось возможным только для 51,8% наблюдаемых ими пациентов, остальным же пришлось выполнять различные виды аугментационных и заместительных уретропластик. Как показали результаты нашего исследования, адекватное владение современным хирургическим арсеналом лечения СУ позволяет добиваться хороших технических результатов с общей эффективностью, приближающейся к 85%, что оказалось даже выше, чем в одном из последних обширных исследований [12].
Отдельного рассмотрения заслуживает тот факт, что в этиологии ятрогенных СУ преобладают повреждения уретры, полученные при трансуретральных эндоскопических операциях, при травматичных катетеризациях и в результате катерных травм (раздувание в уретре баллона катетера Фоли и длительное оставление его в раздутом состоянии, удаление катетера Фоли с не сдутым до конца баллоном). Такая находка заставляет уделить внимание причинам развития СУ после ТУРП по поводу доброкачественной гиперплазии простаты (ДГП) и других трансуретральных вмешательств. В последние годы появилась тенденция к выполнению различных вариантов ТУРП даже при ДГП очень больших размеров, что неизбежно и существенно увеличивает продолжительность операции. Это в свою очередь приводит к росту частоты СУ в связи с увеличением длительности травматического воздействия тубуса резектоскопа на мочеиспускательный канал [13].
Несовершенная техника катетеризации, неадекватная любрикация катетеров и недостаток качественных любрикантов без минеральных масел, некачественные катетеры, неадекватно продолжительный период катетеризации, особенно для пациентов с ишемической сосудистой болезнью, и другие факторы обусловливают высокую частоту так называемых катетер-ассоциированных СУ. В связи с этим в лечебных учреждениях следует уделять особое внимание обучению медицинского персонала правильной технике катетеризации уретры, особенно мужчин, а также основам профилактики катетер-ассоциированных инфекций и СУ.
В последние годы вырос интерес к изучению факторов риска рецидива СУ. Так, D. Chapman et al. [14] изучали факторы риска послеоперационных рецидивов стриктур бульбозного отдела уретры и, по их данным, таковыми оказались наличие сопутствующих заболеваний, ожирение и инфекционная этиология СУ. В нашем исследовании основными и статистически значимыми факторами риска рецидивов ятрогенных СУ всех локализаций были длина стриктуры, применение для уретропластики аугментационных и заместительных техник, а также коррекция гипоспадии в детском возрасте как этиологический фактор. Безусловно первый и второй факторы риска тесно взаимосвязаны, так как большая длина стриктуры диктует применение этих «рискованных» методов уретропластики, надежность и успешность которых в среднем меньше, чем у анастомотических методов пластики уретры [15]. Оперативное лечение гипоспадии характеризуется активным использованием местных тканей, в прошлом – и частым применением несущей волосы мошоночной кожи для создания неоуретры. В случае развития СУ в большинстве случаев приходится полностью удалять неоуретру и замещать ее графтами слизистой оболочки щеки (этапная заместительная уретропластика). Плохое состояние местных тканей, в особенности дефицит tunica dartos полового члена в значительной степени снижает качество приживления трансплантатов, а значит, и эффективность операции. С учетом полученных результатов следует тщательно консультировать пациентов, имеющих указанные факторы риска, предупреждать их о более высокой вероятности послеоперационного рецидива.
Полученные данные с учетом единичных исследований в этой области, безусловно, представляют научный и практический интерес, стимулируют нас к проведению дальнейших исследований. Проведя анализ литературы, мы обнаружили, что наша работа стала самой крупной по размеру выборки пациентов из числа опубликованных исследований, посвященных изучению различных аспектов проблемы ятрогенных СУ. Так, до настоящего времени работа S. K. Zhou et al. [16] была исследованием с наибольшим количеством пациентов с ятрогенной СУ – 172 человека, что намного меньше, чем в нашей работе (230 человек). Определение ведущих причинных факторов ятрогенных СУ, оценка эффективности применявшихся методов оперативного лечения и определение ведущих факторов риска его рецидивов, по нашему мнению, представляют наибольший научный и практический интерес. Дальнейшего изучения в более крупных выборках требует проблема оперативного лечения СВУА после РПЭ, а также осложнений оперативного лечения гипоспадий в детском возрасте, возникающих у взрослых. Заслуживают внимания новые методики пластики уретры, использование клеточных и тканеинженерных технологий, комбинированное использование методов открытой и эндоскопической хирургии. С ростом интенсивности оперативного лечения и лучевой терапии заболеваний тазовых и мочеполовых органов частота ятрогенных СУ и актуальность изучения связанной с ними проблематики будут только расти. Выявленные нами факторы риска рецидивов ятрогенных СУ после оперативного лечения, такие как длина стриктуры и как следствие – более частое использование аугментационных и заместительных методик уретропластики, служат в том числ следствием предшествовавшего рецидивного характера течения стриктурной болезни уретры для значительной части изученной нами категории больных. Большинство же рецидивов обусловлено либо не вполне корректным, либо избыточным использованием ВОУТ в качестве предпочтительного метода лечения до обращения этих пациентов к нам. Отрицательное влияние предшествовавших ВОУТ на эффективность реконструктивных операций при СУ было наглядно показано в работе М. И. Когана и соавт. [17]. Мы разделяем точку зрения авторов, согласно которой использование ВОУТ не по показаниям снижает вероятность благоприятного исхода операции, а использование уретропластики в качестве первичного метода лечения может существенно повысить его эффективность.
Выводы. Анализ результатов проведенного исследования позволяет сделать следующие выводы:
- Ятрогенные СУ локализуются преимущественно в бульбозном отделе и часто распространяются на соседние отделы уретры, имеют большую протяженность, часто бывают рецидивными и требуют применения широкого перечня реконструктивных методик для их оперативной коррекции. Владение этим арсеналом позволяет добиваться высоких результатов в лечении ятрогенных СУ.
- В этиологии ятрогенных СУ ведущую роль играют трансуретральные эндоскопические операции, катетеризации уретры и катетерная травма и осложнения лечения РПЖ и гипоспадии.
- Применявшееся оперативное лечение ятрогенных СУ характеризуется высокой эффективностью, что обусловлено индивидуальным подходом к выбору оптимального вида реконструктивного вмешательства.
- Основными факторами риска рецидивов оперативного лечения ятрогенных СУ являются длина стриктуры, применение аугментационных и заместительных методов уретропластики и оперативное лечение гипоспадии в детском возрасте.
- Раннее применение методик уретропластики в оперативном лечении ятрогенных СУ, возможно, позволит повысить его эффективность.



