Введение. Несмотря на сравнительно небольшой (5–8%) удельный вес хронического бактериального простатита (ХБП) в общей структуре воспалительных заболеваний предстательной железы, он по-прежнему привлекает внимание клиницистов и исследователей, поскольку многие аспекты его патогенеза остаются не до конца изученными, а применяемые стандартные методы этиотропного лечения в виде антимикробной химиотерапии далеко не всегда эффективны, что сопровождается повышением риска рецидивов заболевания и существенным снижением качества жизни мужчин с данным заболеванием [1–5].
В настоящее время приходит понимание того, что в патогенезе и исходах лечения ХБП огромную роль играют не только прямые и/или косвенные негативные эффекты собственно патогенов в предстательной железе (инфекционно-воспалительные механизмы). При данной форме заболевания в процессе взаимодействия инфекционного агента с клетками предстательной железы неминуемо запускается множество каскадных цепных биохимических реакций неинфекционно-воспалительной природы. Последние либо запускаются патогенами и в дальнейшем протекают даже после их эрадикации из ткани предстательной железы на фоне курсов антибиотиков либо исходно существовали, и бактериальное обсеменение только усугубило нарушения простатического клеточно-тканевого метаболизма. Это отражает мультифакторность патогенеза ХБП, в рамках которого осуществляется тесное взаимодействие инфекционных и неинфекционных механизмов [6–9].
В настоящее время одним из универсальных неинфекционных механизмов клеточного повреждения, тесно ассоциированных с инфекционно-воспалительными процессами, рассматривается окислительный стресс (ОС). Согласно данным современной литературы, инфекционная агрессия в клетке неизбежно сопровождается активацией в ней окислительно-восстановительных реакций, лежащих в основе механизмов врожденного и приобретенного клеточно-гуморального иммунитета и направленных на борьбу с инфекционным агентом. При этом в разной степени активируются все составляющие так называемой антиоксидантной системы защиты клетки и прежде всего ключевые высокоспециализированные антиоксидантные ферменты, представленные во всех клетках организма (супероксиддисмутаза (СОД), каталаза, глутатион-пероксидаза). Результатом ответа клетки на инфекционное поражение становятся одновременное накопление в ней свободных радикалов и усиление реакций перекисного окисления липидов (ПОЛ), прежде всего в мембранах клеток (клеточные мембранопатии). Одновременно с этим развивается клеточная гипоксия вследствие выраженных нарушений функций митохондрий, которые при избытке свободных радикалов не в состоянии адекватно выполнять свои главнейшие клеточные функции детоксикации и синтеза энергии (митохондриальная дисфункция). Данные нарушения и составляют патофизиологическую сущность ОС. Дальнейшее развитие неблагоприятных гомеостатических событий в клетке при усилении ОС связано с выходом лизосомальных ферментов внутрь клетки, накоплением внутри клетки ионов кальция, закислением клетки (внутриклеточный ацидоз), нарушением клеточной рецепции и перцепции (арефлексия клетки), апоптозом, некрозом и смертью клетки [10–12].
Таким образом, возникающие на фоне инфекционного воспаления многообразные нарушения оксидативного статуса клетки, с одной стороны, являются прямым следствием данной инфекции, с другой стороны, дополнительно усиливаются при проведении антимикробной химиотерапии. С третьей стороны, они способны длительно персистировать в клетке даже после полноценной эрадикации возбудителя, поддерживая в ней стойкие анатомо-функциональные нарушения, мешающие полноценному восстановлению структуры и функций клетки после перенесенной инфекции и снижающие ее устойчивость к новой инфекции. При ХБП такой «патологический порочный круг» уже давно описан в литературе, поэтому включение в современные стандартные схемы фармакотерапии ХБП антиоксидантов, по мнению ведущих экспертов, представляется целесообразной и необходимой опцией с точки зрения улучшения результатов стандартного лечения и более полноценной ликвидации резидуальных оксидативных нарушений, мешающих нормализации механизмов клеточного саногенеза в предстательной железе [13–15].
К настоящему времени в доступной зарубежной и отечественной литературе накоплены обширные клиникоэкспериментальные данные об эффективности самых различных антиоксидантов, перечисление которых не входит в задачи данной работы.
В российской урологической практике наиболее часто в качестве антиоксиданта используются различные препараты цинка, поскольку двусторонняя патогенетическая связь между хроническим простатитом и концентрацией цинка в предстательной железе получила свое высокодоказательное подтверждение в систематических обзорах и мета-анализах, из которых следует, что, с одной стороны, при хроническом простатите существенно снижается способность предстательной железы захватывать и утилизировать цинк, а с другой стороны, дефицит цинка повышает риски развития хронического простатита [16]. Из других доказанных антиоксидантов, которые пока не нашли своего широкого клинического применения при ХБП, следует упомянуть L-карнитин, широко применяющийся в нашей стране в качестве средства антиоксидантной терапии мужского бесплодия. Однако его универсальный и точно известный механизм антиоксидантного действия делает необходимым тестирование его эффективности и при ХБП, поскольку подобных исследований в доступной отечественной литературе мы не нашли.
Цель исследования: сравнить эффективность стандартной антимикробной монохимиотерапии и двух режимов комбинированной фармакотерапии с дополнительным назначением различных антиоксидантов больным хроническим бактериальным простатитом (ХБП).
Материалы и методы. Обследованы 90 больных ХБП в возрасте 24–46 лет (средний возраст – 38,2±1,4 года) (основная группа) и 30 клинически здоровых мужчин в возрасте 20–45 лет (средний возраст – 35,5±1,5 года), у которых в ходе комплексной диагностики были исключены какие-либо заболевания предстательной железы (контрольная группа). Исследование носило текущий проспективный сплошной характер. Все мужчины в ходе исследования подвергались однотипному комплексному обследованию, а результаты обследования мужчин контрольной группы принимались в качестве референсных значений условной нормы изучаемых параметров. Все пациенты, вошедшие в настоящее исследование и закончившие его, как и клинически здоровые мужчины контрольной группы, были предварительно информированы о целях и задачах исследования, и каждый заполнил информированное согласие об участии в данном исследовании и использовании полученных результатов для научных целей.
Для анализа влияния различных режимов фармакотерапии на микробиологические исходы заболевания использовались стандартные бактериологические исследования секрета предстательной железы до и после проведения фармакотерапии, направленные на идентификацию патогенного микроорганизма и определение его чувствительности к наиболее распространенным антимикробным химиопрепаратам [17].
Для оценки клинических параметров ХБП использовали опросник CPSI–QL, на основании которого оценивали такие клинические характеристики заболевания, как оценка выраженности симптомов (ОВС) (баллы), общая оценка симптомов (ООС) (баллы), индекс боли (ИБ) (баллы), индекс качества жизни (ИКЖ) (баллы) [18].
Цитологические исследования секрета предстательной железы, полученного после ее диагностического массажа, выполняли по общепринятой методике (микроскопия исходного нативного материала и после его окраски по Граму) с последующей оценкой ключевых лабораторных параметров (содержание лейкоцитов, лецитиновых зерен; наличие или отсутствие макрофагов, эритроцитов; предварительное заключение о наличии и количестве бактериальных клеток в изучаемом материале) [19].
Для оценки параметров оксидативного статуса предстательной железы выполнялись различные модификации биохимических исследований секрета предстательной железы.
Для определения уровня активных форм кислорода (АФК) в секрете предстательной железы использовали метод люминолзависимой хемилюминесценции (ЛЗХЛ), а основными показателями данного метода были светосумма (СС) и максимальная амплитуда свечения (МахС), которые соответствовали уровню образования активных форм кислорода (АФК) [20, 21]. Для оценки адекватности протекания окислительновосстановительных реакций в секрете предстательной железы выполняли определение в нем уровня промежуточных продуктов (диеновые конъюгаты, малоновый диальдегид) перекисного окисления липидов (ПОЛ) и оценивали активность одного из ключевых специализированных универсальных ферментов антиоксидатной системы защиты (АОСЗ) клеток – супероксиддисмутазы (СОД). Определение диеновых конъюгатов в секрете предстательной железы проводили по методике И. Д. Стальной (1977) [22]. Определение малонового диальдегида в секрете предстательной железы проводили спектрофлуориметрическим методом после реакции с тиобарбитуровой кислотой по методу Стальной И.Д. и Гаришвили Т.Г. (1977) [23]. Активность супероксиддисмутазы (СОД) в секрете предстательной железы определяли спектрофотометрическим методом по методике Н. Р. Mistra, I. Fridovich (1972) в модификации В. А. Костюка и соавт. (1990), основанным на определении степени торможения реакции аутоокисления кверцетина в связи с тем, что одним из промежуточных продуктов этой реакции является супероксидный анион-радикал [24]. Содержание цинка в секрете предстательной железы определяли методом рентгенофлуоресцентного анализа (РФА), основанным на характеристическом спектре вторичного флуоресцентного излучения пробы, который возникает под действием более жесткого рентгеновского излучения, на портативном российском анализаторе серии МАК-6 (Санкт-Петербург) [25].
Для сравнительного анализа результатов различных режимов терапии из основной группы было сформировано две новые группы больных ХБП. Группа 1 (n=15) получала только левофлоксацин перорально (per os) в дозе 500 мг/ сут. в течение 28 дней в «слепом» исследовании, т.е. уровни простатического цинка у больных исходно известны не были. Поскольку в рутинной клинической урологической практике при лечении данного заболевания определение цинка в крови и секрете предстательной железы не регламентировано имеющимися клиническими рекомендациями и стандартами ведения больных с данной патологией, то таким образом мы воссоздали типичную модель «стандартного» лечения «стандартного» хронического бактериального простатита, основанного, как принято, лишь на назначении этиотропной терапии (антимикробной химиотерапии в режиме монотерапии) без учета каких-либо других потенциальных факторов патогенеза заболевания. Группа 2 (n=15) была составлена из пациентов, у которых в простатическом секрете был выявлен дефицит цинка и которые получали комбинированную фармакотерапию левофлоксацином per os в дозе 500 мг/сут. и цинка пиколинатом per os в дозе 22 мг/сут. в течение 28 дней. Группа 3 (n=15) была составлена из больных ХБП и с нормальным уровнем цинка в секрете предстательной железы, которые получали комбинированную фармакотерапию левофлоксацином per os в дозе 500 мг/сут. и L-карнитина тартратом per os в дозе 1000 мг/сут. в течение 28 дней.
Статистическую обработку выполняли в программе Microsoft Excel, 2007 и Statistica, 6.0 (StatSoft, США). Для исследования взаимосвязи количественных признаков между собой определяли коэффициент корреляции Спирмена (r). Значение r интерпретировали следующим образом: <0,25 – слабая корреляция; 0,26–0,75 – умеренная корреляция; >0,75 – сильная корреляция. Для оценки межгрупповых различий значений признаков, имеющих непрерывное распределение, применяли t-критерий Стьюдента. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых межгрупповых различий или факторных влияний) принимали равным 0,05. Статистически значимой для всех показателей считали общепринятую в медикобиологических исследованиях величину, равную р<0,05 [26]. Результаты и обсуждение. Результаты сравнительной оценки эффективности и переносимости тестированных в данном исследовании режимов фармакотерапии ХБП представлены в таблице.
Как следует из таблицы, статистически достоверные различия между группами больных хроническим бактериальным простатитом, подвергшихся различным режимам фармакотерапии, наблюдались не по всем изучаемым параметрам. Прежде всего следует отметить достоверные различия в микробиологической эффективности тестированных режимов фармакотерапии, которая оказалась максимальной в группе комбинированной фармакотерапии «Антимикробный химиопрепарат+L-карнитина тартрат» у больных без дефицита цинка (100,0%). У больных ХБП с дефицитом цинка дополнительное назначение цинка пиколината к этиотропной терапии позволило достичь микробиологической эффективности 93,3%, а наихудшая микробиологическая эффективность оказалась в группе антимикробной монохимиотерапии в «слепом» исследовании (86,7%) (р<0,05). Но при этом именно в группе антимикробной монохимиотерапии наблюдалась достоверно наибольшая частота побочных эффектов, достигшая 20,1%, в то время как в обеих группах комбинированной фармакотерапии она была в 3 раза меньше, составив всего 6,7% для каждой из групп (р<0,05).
По результатам оценки влияния различных режимов фармакотерапии на клинические параметры хронического бактериального простатита выявлено, что к моменту завершения лечения у больных группы антимикробной монохимиотерапии сохранялись достоверно более выраженные остаточные клинические симптомы заболевания, более выраженный резидуальный болевой синдром (по индексу боли, ИБ) и худший индекс качества жизни (ИКЖ) по сравнению с аналогичными показателями обеих групп комбинированной фармакотерапии (р<0,05). В частности, ИБ у больных группы антимикробной монохимиотерапии был в среднем на 59,1% выше, чем в группе комбинированной фармакотерапии с цинка пиколинатом и на 66,2% выше, чем в группе комбинированной фармакотерапии с L-карнитина тартратом (р<0,05). Персистирование болевого синдрома после микробиологической эрадикации возбудителей из предстательной железы, по нашему мнению, подтверждает мультифакторный (а не только инфекционно-воспалительный) генез хронической боли при хроническом бактериальном простатите и является одной из главных причин снижения качества жизни данных пациентов на всех этапах клинического течения заболевания и после курса фармакотерапии (рис. 1).
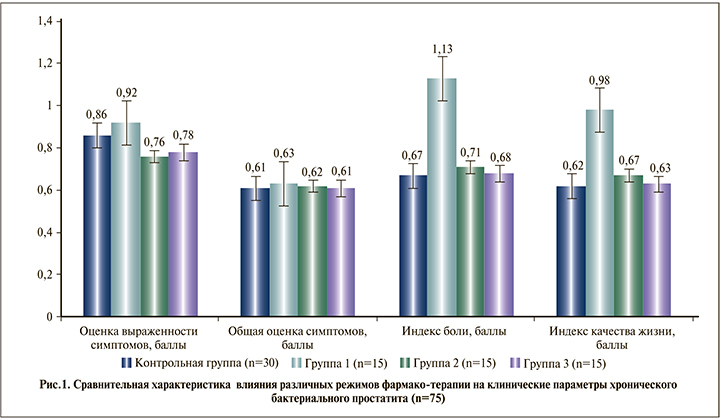
В отличие от группы антимикробной монохимиотерапии (группа 1) обе группы комбинированной фармакотерапии (группы 2 и 3) демонстрировали четкие тенденции к более выраженному снижению исходно повышенного количества лейкоцитов в секрете предстательной железы и лучшие показатели восстановления секреторной функции предстательной железы, оцененные по содержанию лецитиновых зерен в простатическом секрете после проведенного лечения, которые при этом все же не достигали показателей здоровых мужчин контрольной группы (р<0,1) и были худшими в группе 1 (рис. 2).
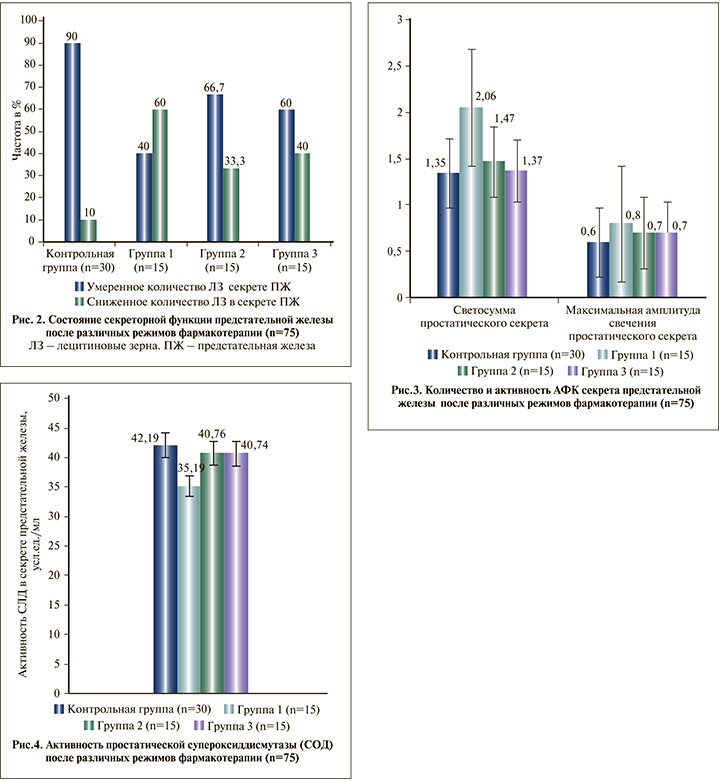
Оценка уровня остаточной свободно-радикальной агрессии предстательной железы после проведенного лечения показала, что в целом во всех группах фармакотерапии наблюдалась тенденция к снижению количества и активности АФК в секрете предстательной железы без достоверных различий между группами фармакотерапии и контрольной группой (р<0,1), однако абсолютный уровень АФК у больных группы 1 после проведенного лечения оставался на достоверно более высоком уровне по сравнению как с контрольной группой (на 52,6%), так и с группой 2 (на 40,1%) и группой 3 (на 50,4%) соответственно (р<0,05) (рис. 3.).
Полученные результаты свидетельствовали, очевидно, о продолжении цепных реакций свободно-радикального окисления в ткани предстательной железы даже после микробиологической эрадикации возбудителей. Подтверждением тому можно было рассматривать выявленные нарушения оксидативного статуса предстательной железы, которые характеризовались достоверным остаточным повышением уровня малонового диальдегида в секрете предстательной железы у больных группы 1, не получавших дополнительно антиоксидантов-антигипоксантов (р<0,05), а также достоверно более низким уровень активности простатической СОД у них же (р<0,05). Это в свою очередь свидетельствовало об истощении (декомпенсации) АОСЗ предстательной железы, вероятно, смешанного характера (за счет непосредственно инфекционно-воспалительного процесса и, очевидно, дополнительно медикаментозной индукции митохондриальной дисфункции на фоне антимикробной монохимиотерапии) (рис. 4).
Таким образом, традиционным и наиболее распространенным в клинической практике методом лечения хронического бактериального простатита остается этиотропная терапия, которая подразумевает эмпирическое или целенаправленное назначение антимикробного химиопрепарата чаще всего в режиме монотерапии. Однако проведенное исследование показало определенную ограниченность такого подхода и его неспособность эффективно решать ключевые цели лечения данного заболевания. Последние, по нашему мнению, должны состоять не только в максимально полной микробиологической эрадикации возбудителей из предстательной железы, но еще и в полной ликвидации болевого синдрома и максимальном восстановлении ее нарушенных вследствие инфекционно-воспалительного процесса основных функций, что предопределяет существенное улучшение качества жизни больных ХБП.
Заключение. Несмотря на то что этиотропная терапия ХБП, направленная на достижение эрадикации возбудителей из предстательной железы, является при данной форме заболевания терапией «первой линии», одних только ее возможностей сегодня явно недостаточно для его эффективного лечения. Так, в настоящем исследовании в 1-й группе пациенты, которые получали только антимикробный химиопрепарат, продемонстрировали наихудшие результаты с точки зрения микробиологической эффективности, динамики нормализации клинико-лабораторных параметров, оксидативного статуса предстательной железы и переносимости лечения по сравнению с группами 2 и 3, в которых антимикробная терапия сочеталась с дополнительным назначением антиоксидантов. С учетом одновременного присутствия выраженных оксидативных нарушений в ткани предстательной железы при ХБП, запускаемых инфекционным агентом и антимикробной химиотерапией, важной фармакотерапевтической опцией помимо достижения микробиологической эрадикации возбудителя является также полноценная ликвидация окислительного стресса, ассоциированного с инфекционно-воспалительным процессом в предстательной железе, который может персистировать после курса целенаправленной антимикробной монохимиотерапии и достижения лабораторной санации органа, вызывая дальнейшее усугубление анатомических потерь и функциональных дефицитов в предстательной железе. Эффективное решение данной проблемы, по нашему мнению, может быть достигнуто путем персонифицированного назначения комбинации антимикробного химиопрепарата с различными антиоксидантами в зависимости от результатов обследования пациента с ХБП. Дополнительное персонифицированное назначение к этиотропной антимикробной химиотерапии антиоксидантов (цинка или L-карнитина) достоверно улучшает клиниколабораторные результаты фармакотерапии ХБП, при этом снижая частоту побочных эффектов.



