Введение. Современная концепция патогенеза большинства заболеваний человека базируется на фундаментальной теории свободных радикалов, известной также как теория окислительного (оксидативного) стресса [1]. Окислительный стресс в широком смысле слова трактуется как разнообразные проявления на системном, органном и клеточном уровнях избыточных окислительно-восстановительных реакций, приобретающих неконтролируемый каскадный характер в связи с неконтролируемым (избыточным) поступлением извне или эндогенной гиперпродукцией свободных радикалов [2–5]. В условиях любого окислительного стресса существенно усиливается перекисное окисление липидов (ПОЛ), вызывающее разнообразные повреждения во всем организме, прежде всего в мембранах клеток (мембранопатия) [6]. Одновременно с этим развивается системная и клеточно-тканевая гипоксия вследствие выраженных нарушений функций митохондрий, которые при избытке свободных радикалов не в состоянии адекватно выполнять свои основные клеточные функции детоксикации и синтеза энергии (митохондриальная дисфункция) [7]. К активации реакций ПОЛ может приводить абсолютно любой экзогенный или эндогенный фактор, но чаще всего ПОЛ-индуцирующими факторами служат стрессы любого происхождения, ишемия, реперфузия тканей (реперфузионный синдром), воспаление (асептическое [цитокиновое]или инфекционно-бактериальное), а также недостаточная активность АОСЗ вследствие дефицита эндогенных антиоксидантов и/или антигипоксантов [8, 9]. Дальнейший сценарий неблагоприятных гомеостатических событий в клетке при усилении окислительного стресса связан с развитием мембранопатии, митохондриальной дисфункции и ряда других клеточных нарушений, которые приводят сначала к функциональной, а при персистенции и усилении окислительного стресса – и к органической клеточной патологии [10–12]. В связи с этим идентификация свободных радикалов как промоутеров патологических процессов позволила прийти к мысли о том, что их инактивация или полная блокада может стать основой эффективной терапии многих (если не большинства) заболеваний современного человека, а реальным воплощением этого стала разработка и внедрение в клиническую практику препаратов для борьбы с окислительным стрессом – антиоксидантов и антигипоксантов [3].
В последних научных публикациях показана важнейшая патофизиологическая роль гиперпродукции активных форм кислорода (АФК) на фоне ослабления факторов антиоксидантной системы защиты (АОСЗ) клеток в патогенезе воспалительных заболеваний предстательной железы, в частности хронического бактериального простатита (ХБП), при котором ключевыми триггерами свободно-радикальной агрессии предстательной железы становятся патогенные микроорганизмы и лейкоциты [13–15]. Однако многие вопросы данной проблемы остаются недостаточно изученными на людях, что связано со спецификой клинических исследований. В связи с этим для более глубокого изучения клеточных нарушений при окислительном стрессе возникает потребность выполнения экспериментального моделирования на лабораторных животных.
Цель исследования: изучить динамику основных параметров оксидативного статуса предстательной железы на фоне стандартной антимикробной монохимиотерапии и обосновать целесообразность дополнительного назначения антиоксидантной терапии в различных экспериментальных моделях ХБП.
Материалы и методы. Эксперименты проведены на 60 беспородных половозрелых здоровых самцах белых крыс массой тела 180–200 г, как правило имевших более широкий диапазон колебаний изучаемых признаков, чем линейные животные одной породы. С лабораторными животными работали в соответствии с действующими Правилами проведения работ с использованием экспериментальных животных, Международными рекомендациями по проведению медико-биологических исследований с использованием животных (1985) и российскими Рекомендациями по экспериментальному (доклиническому) изучению новых фармакологических веществ (2000) [16].
Все животные находились в одинаковых условиях обитания (древесная подстилка из опилок и стружки, температура помещения 22–24°С, 12-часовой режим смены освещения, стандартный брикетированный корм). В качестве контроля использовали 20 половозрелых интактных самцов белых крыс, которым выполняли катетеризацию мочевого пузыря и вводили стерильный физиологический раствор. Результаты биохимических исследований гомогенатов предстательной железы этих животных в соответствии с задачами исследования использовали в качестве референсных значений изучаемых показателей оксидативного статуса предстательной железы и принимали за «условную норму». Из оставшихся 40 животных было сформировано 2 экспериментальные группы по 20 животных в каждой, в которых было выполнено две серии опытов. В группе 1 (n=20) изучали влияние антимикробной монохимиотерапии на показатели оксидативного статуса предстательной железы, для чего однократно инфицировали предстательную железу по методике J.C. Nickel (1990) и T. Goto (1991) [17, 18]. Через 30 дней после экспериментального моделирования клинического эпизода ХБП половину лабораторных животных группы 1 (подгруппа 1А, n=10) выводили из эксперимента. Сначала выполняли декапитацию после предварительной наркотизации внутрибрюшинным введением этаминала натрия (4 мг на 100 г массы тела), затем удаляли предстательную железу, из ткани которой изготавливали гомогенаты, далее их подвергали необходимым биохимическим исследованиям, результаты которых принимали как исходные до лечения эпизода ХБП. Гомогенаты предстательных желез животных готовили по методике Д. Э. Коржевского (2010) [19]. В то же время в оставшейся половине группы 1 (подгруппа 1Б, n=10) начинали курс антимикробной монохимиотерапии (левофлоксацин per os по 12,5 мг/кг/сут), который продолжался 20 дней. По его завершении животных также выводили из эксперимента по ранее описанной методике, а результаты биохимического исследования гомогенатов их предстательных желез принимали как конечные после лечения эпизода ХБП. Результаты биохимических исследований гомогенатов ткани предстательных желез животных подгрупп 1А и 1Б сравнивали между собой и с соответствующими показателями условной нормы контрольной группы животных.
В группе 2 (n=20) также выполняли экспериментальное моделирование ХБП по описанной ранее методике, однако в отличие от группы 1, в которой моделировали эпизод ХБП, в группе 2 нами была предпринята попытка экспериментального воспроизведения клинического рецидива ХБП, для чего через 30 дней после первичного инфицирования предстательной железы выполняли ее повторное инфицирование по указанной выше методике. После этого половину животных группы 2 (подгруппа 2А, n=10) выводили из эксперимента, как описано выше. Гомогенаты предстательных желез подвергали необходимым биохимическим исследованиям, результаты которых принимали как исходные до лечения рецидива ХБП. В оставшейся половине группы 2 (подгруппа 2Б, n=10) начинали аналогичный группе животных 1Б 20-дневный курс антимикробной монохимиотерапии (левофлоксацин per os по 12,5 мг/кг/сут), по завершении которого животных так же выводили из эксперимента. Результаты биохимического исследования гомогенатов их предстательных желез принимали как конечные после лечения рецидива ХБП. Как и в группе 1, результаты биохимических исследований гомогенатов ткани предстательных желез животных подгрупп 2А и 2Б сравнивали между собой и с соответствующими показателями условной нормы контрольной группы животных.
Для определения уровня АФК в гомогенатах использовали метод люминолзависимой хемилюминесценции (ЛЗХЛ), а основными показателями данного метода были светосумма и максимальная амплитуда свечения (МахС), соответствовавшие уровню образования АФК [20–22].
С целью оценки адекватности протекания окислительно-восстановительных реакций в гомогенатах предстательных желез определяли в них уровень промежуточных продуктов (диеновые конъюгаты, малоновый диальдегид) ПОЛ и оценивали активность одного из ключевых специализированных универсальных ферментов АОСЗ клеток – супероксиддисмутазы (СОД). Определение диеновых конъюгатов проводили по методике И. Д. Стальной (1977) [23], малонового диальдегида – спектрофлуориметрическим методом после реакции с тиобарбитуровой кислотой по методу И. Д. Стальной и Т. Г. Гаришвили (1977) [24]. Активность СОД оценивали спектрофотометрическим методом по методике H. P. Mistra и I. Fridovich (1972) в модификации В. А. Костюка и соавт. (1990), основанным на определении степени торможения реакции аутоокисления кверцетина в связи с тем, что одним из промежуточных продуктов этой реакции является супероксидный анион-радикал [25]. Активность сукцинатдегидрогеназы (СДГ), очень специфичную для митохондрий клеток ферментом, активность которой рассматривается как один из объективных цитобиохимических маркеров митохондриальной дисфункции [26, 27], определяли методом П. Г. Сторожука и А. П. Сторожука (2004), основанным на способности данного фермента восстанавливать нитросиний тетразолий (НСТ) в формазан [28].
Статистическую обработку выполняли в программах Microsoft Excel 2007 и Statistica 6.0. (StatSoft, США). Для оценки межгрупповых различий значений количественных признаков, имевших непрерывное распределение, использовался метод оценки t-критерия Стьюдента. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых межгрупповых различий) принимали равным 0,05 [29].
Результаты и обсуждение. Девятью (90%) животными подгруппы 1Б, выведенными из эксперимента после 20-дневного курса антимикробной монохимиотерапии, к моменту его завершения была достигнута полная эрадикация возбудителя из предстательной железы, о чем свидетельствовали отрицательные результаты контрольных бактериологических исследований гомогенатов предстательных желез. Установлено, что первичное проникновение инфекционного агента в ткань предстательной железы сопровождалось выраженным усилением клеточно-тканевых свободно-радикальных реакций, отражением которых стало достоверное увеличение количества АФК (в 4,6 раза) и повышение их активности (в 2 раза) по сравнению с контролем (р<0,05; табл. 1).

Как видно из табл. 1, после курса антимикробной монохимиотерапии процессы гиперпродукции АФК в ткани предстательной железы сохранялись, поскольку, несмотря на отсутствие достоверных различий между показателями максимальной амплитуды свечения, отражающими функциональную активность АФК, контрольной и основной группы после лечения (0,20±0,05 отн. ед. против 0,34±0,08 отн. ед.; р>0,05), количество АФК в гомогенатах предстательных желез животных с моделью эпизода ХБП после лечения хоть и достоверно уменьшилось по сравнению с исходным до лечения показателем в 2,8 раза, тем не менее оставалось на достоверно более высоком уровне, превысившем аналогичный показатель здоровой предстательной железы в 1,6 раза (р<0,05).
Полученные данные свидетельствуют: на фоне первичного проникновения инфекта в ткань предстательной железы в ней повышается количество и активность АФК, что можно рассматривать как проявления усиливающегося локального окислительного стресса. При этом даже целенаправленная антимикробная монохимиотерапия не способна полностью его ликвидировать даже на фоне полной эрадикации возбудителя. Очевидно, что первичный инфект может играть роль своеобразного оксидативного триггера, запуская каскад патологически избыточного образования свободных радикалов в ткани предстательной железы, которые в дальнейшем теряют непосредственную связь с ним и патологический окислительный стресс развивается далее по разным сценариям в зависимости от состоятельности АОСЗ клеток и тканей, результаты исследования некоторых параметров которой в гомогенатах предстательных желез экспериментальных животных представлены в табл. 2.
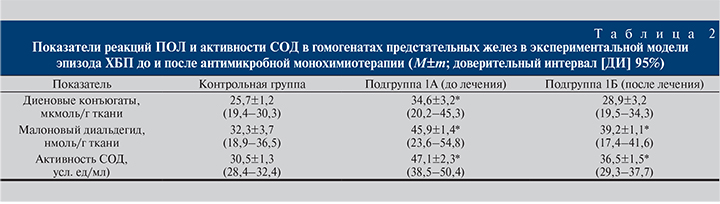
Данные табл. 2 дополняют полученные ранее результаты оценки уровня и активности АФК в предстательной железе и свидетельствуют о том, что первичный эпизод ХБП сопровождался не только избыточностью продукции АФК в предстательной железе, но и существенным усилением в ней процессов ПОЛ, отражением которых стало накопление избыточных количеств продуктов ПОЛ. Так, уровень диеновых конъюгатов у животных с экспериментальной моделью эпизода ХБП был повышен на 34,6%, уровень малонового диальдегида – на 42% по сравнению с аналогичными показателями интактных животных (р<0,05). Одновременно в предстательной железе экспериментальных животных по сравнению с интактными в 1,5 раза повышалась активность СОД (р<0,05). Такая динамика реакций ПОЛ и активации СОД в условиях повышенного содержания АФК в предстательной железе отражала исходную функциональную состоятельность АОСЗ предстательной железы в ответ на свободно-радикальную агрессию инфекционной природы. Однако к концу курса антимикробной монохимиотерапии результаты исследования оксидативного статуса предстательной железы свидетельствовали о незавершенности компенсаторных реакций, опосредуемых АОСЗ, что проявлялось сохранением в гомогенатах предстательных желез экспериментальных животных достоверно более высокого (на 20,1%) уровня промежуточных продуктов ПОЛ (малонового диальдегида) и повышенной на 19,7% активностью СОД по сравнению с контрольной группой на фоне нормализации уровня промежуточных продуктов ПОЛ (диеновых конъюгатов) в обеих группах (р<0,05).
Исследования маркера митохондриальной дисфункции – фермента СДГ показали, что при первичном инфицировании предстательной железы наблюдалось исходное повышение активности СДГ на 28,2% до 254,3±23,6 (244,5–289,6) усл. ед/мл по сравнению с показателем контрольной группой интактных животных (198,3±32,6 (129,2–235,3) усл. ед/мл; р<0,05). Однако после курса антимикробной монохимиотерапии показатель активности данного фермента (212,4±35,3 [189,3–254,3] усл. ед/мл) практически соответствовал контрольным значениям, отличаясь от последних статистически незначимо (р>0,05).
В соответствии с результатами оценки динамики митохондриальной СДГ можно сделать предварительное заключение, согласно которому при однократном первичном инфицировании ткани предстательной железы цитобиохимические признаки значимой митохондриальной дисфункции простатических клеток развиться не успевали.
У 8 (80%) животных подгруппы 2Б, выведенных из экспериментальной модели рецидива ХБП после 20-дневного курса антимикробной монохимиотерапии, к моменту его завершения была достигнута полная эрадикация патогенного возбудителя из предстательной железы, о чем свидетельствовали отрицательные результаты контрольных бактериологических исследований гомогенатов ткани предстательных желез. Экспериментальное моделирование показало, что повторное проникновение инфекционного агента в ткань предстательной железы сопровождалось выраженным усилением клеточно-тканевых свободно-радикальных реакций, отражением которых стало достоверное увеличение количества АФК (в 7,6 раза) и повышение их активности (в 3,5 раза) в гомогенатах предстательных желез экспериментальных животных по сравнению с контролем (р<0,05; табл. 3).
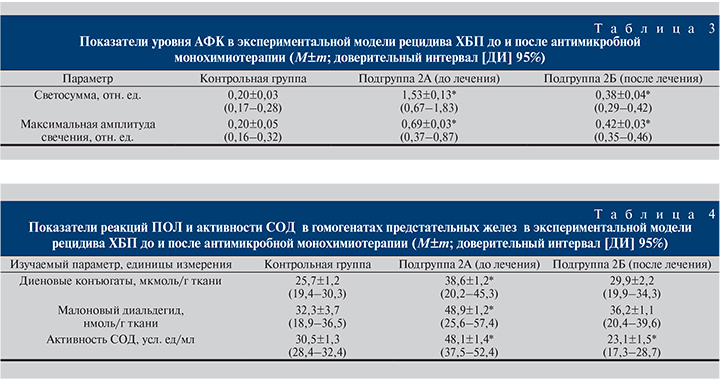
Как видно из табл. 3, после курса антимикробной монохимиотерапии в ткани предстательной железы у экспериментальных животных с моделью рецидива ХБП сохранялись явления гиперпродукции АФК с их повышенной функциональной активностью, поскольку они имели достоверно более высокие показатели светосуммы, отражавшие суммарную продукцию свободных радикалов (в 3,45 раза), и показатели максимальной амплитуды свечения, свидетельствовавшие об активности продуцируемых АФК (в 2,1 раза), по сравнению с аналогичными показателями здоровых животных контрольной группы (р<0,05). На фоне такой выраженной оксидативной агрессии (окислительного стресса) отмечены существенные сдвиги в протекании процессов ПОЛ, а динамика активности СОД свидетельствовала об истощении АОСЗ, поскольку на фоне статистически недостоверного повышения содержания продуктов ПОЛ в исследуемых образцах к моменту окончания курса антимикробной монохимиотерапии (эрадикации возбудителя) уровень данного антиоксидантного фермента в клетках предстательной железы оказался в 1,3 раза ниже, чем в группе контроля, хотя исходно был повышен на 57,8% относительно показателей условной нормы (р<0,05; табл. 4).
Данные табл. 4 свидетельствуют о том, что рецидив ХБП сопровождался не только избыточностью и повышенной активностью АФК в предстательной железе, но и существенным усилением в ней процессов ПОЛ, на что указывает накопление в ткани предстательной железы промежуточных продуктов ПОЛ. Динамика реакций ПОЛ и активации СОД в условиях повышенного содержания и активности АФК в предстательной железе отражала исходную функциональную состоятельность АОСЗ предстательной железы в ответ на свободно-радикальную агрессию повторной инфекционной природы. Однако к моменту окончания курса терапии в предстательной железе экспериментальных животных с моделью рецидива ХБП по сравнению с контрольной группой уровень СОД оказался в 1,3 раза ниже (р< 0,05), что, очевидно, указывало на формирующуюся недостаточность АОСЗ предстательной железы.
Исследования динамики маркера митохондриальной дисфункции СДГ показали, что при повторном инфицировании предстательной железы наблюдалось исходное повышение активности СДГ до 264,3±21,6 (244,5–289,2) усл. ед/мл, что на 33,3% больше, чем в контроле (198,3±32,6 (129,2–235,3) усл. ед/мл; р<0,05), однако после курса антимикробной монохимиотерапии уровень активности данного фермента оказался недостоверно ниже на 30,1% по сравнению с контролем, составив 151,4±25,3 (112,3–189,3) усл. ед/мл (р>0,05).
На основании полученных данных можно предположить, что при повторном инфицировании ткани предстательной железы на фоне начинающейся декомпенсации АОСЗ создаются условия и повышается риск развития митохондриальной дисфункции простатических клеток.
Итак, экспериментальное исследование в двух моделях ХБП позволило установить, что, несмотря на достаточно высокий процент достигаемой в ходе проведения антимикробной монохимиотерапии микробиологической эрадикации возбудителя из предстательной железы (90% для подгруппы эпизода ХБП и 80% для подгруппы рецидива ХБП), данный вид лечения сопровождался персистенцией исходно запущенных инфектом свободно-радикальных избыточных реакций (окислительного стресса) в ткани предстательной железы, что на фоне нарушений активности ферментов АОСЗ предстательной железы негативным образом сказывалось на показателях ее органного оксидативного статуса (табл. 5).

Как следует из табл. 5, в экспериментальной модели рецидива ХБП наблюдались достоверно более выраженные оксидативные нарушения в ткани предстательной железы по сравнению с экспериментальной моделью эпизода ХБП. Так, при рецидиве ХБП уровень образования АФК в гомогенатах предстательных желез экспериментальных животных (подгруппа 2Б) к концу курса антимикробной монохимиотерапии превышал таковой в контроле 1,75 раза, в подгруппе 1Б – в 1,65 раза (р<0,05), при этом подгруппы по данному параметру статистически значимо не различались (р>0,05). Более выраженные различия показателей экспериментальных моделей ХБП получены при сравнении активности АФК: максимальная амплитуда свечения в модели рецидива ХБП превышала таковую в группе контроля в 2,1 раза, в модели эпизода ХБП – только в 1,51 раза, при этом различия параметров активности АФК в подгруппах сравнения к конце лечения также оказались статистически значимыми (р<0,05). Эти результаты свидетельствуют о более выраженном окислительном стрессе в ткани предстательной железы в случае рецидива ХБП.
Изменения реакций ПОЛ в обеих моделях ХБП также подтверждали более выраженные процессы ПОЛ в случае рецидива ХБП по сравнению с его эпизодом, однако степень состоятельности механизмов АОСЗ клеток предстательной железы в исследуемых моделях заболевания оказалась различной. При эпизоде ХБП после курса антимикробной монохимиотерапии сохранялась более высокая (на 19,7% по сравнению с контрольной группой) активность фермента СОД, что на фоне одновременного повышения на 20,1% (по сравнению с контролем) уровня малонового диальдегида свидетельствовало о незавершенности процессов ПОЛ в клетках предстательной железы, несмотря на достигнутую эрадикацию возбудителя.
Диаметрально противоположная биохимическая картина протекания реакций ПОЛ сформировалась по окончании курса антимикробной монохимиотерапии в модели рецидива ХБП (подгруппа 2Б). В данной подгруппе животных к моменту окончания терапии уровень диеновых конъюгатов в предстательной железе оказался на 16,3% выше, малонового диальдегида – на 7,6%, чем в контроле (р<0,05). Кроме того, имело место снижение в 1,3 раза по сравнению с условной нормой уровня СОД (р<0,05). Такая динамика протекания реакций ПОЛ и активации СОД в условиях повышенного содержания и активности АФК в предстательной железе отражала исходную функциональную состоятельность АОСЗ предстательной железы в ответ на свободно-радикальную агрессию повторной инфекционной природы, однако к концу курса антимикробной монохимиотерапии результаты исследования оксидативного статуса предстательной железы свидетельствовали о начинающейся декомпенсации АОСЗ, о чем говорили так называемые оксидативные ножницы (разнонаправленные изменения уровней промежуточных продуктов ПОЛ в сочетании с достоверно более низким (на 32%), чем в группе контроля, уровнем активности СОД (р<0,05)). Кроме того, более выраженные нарушения оксидативного статуса в экспериментальной модели рецидива ХБП сопровождались более выраженными нарушениями митохондриальной функции, оцененной по динамике активности СДГ, уровень которой к окончанию курса лечения оказался на 30,1% ниже в экспериментальной модели рецидива ХБП (р<0,1), в то время как в модели эпизода ХБП ее уровень достоверно превышал исходный нормальный показатель животных группы контроля на 7,1% (р<0,05). Если в случае модели эпизода ХБП несколько повышенный уровень СДГ, по нашему мнению, отражал незавершенность локальных простатических реакций оксидативной направленности, то дефицит СДГ, выявленный в модели рецидива ХБП, может свидетельствовать о более высоком риске развития митохондриальной дисфункции простатических клеток.
Заключение. Экспериментальное моделирование эпизода и рецидива ХБП выявило существенные различия динамики оксидативного статуса предстательной железы на фоне антимикробной монохимиотерапии при сравнительно сопоставимых результатах микробиологической эрадикации возбудителя из ткани предстательной железы, достигаемых в каждой из моделей ХБП (90 и 80% соответственно). Полученные в ходе экспериментального моделирования данные свидетельствуют о том, что на фоне первичного и особенно повторного проникновений инфекционного агента в ткани предстательной железы закономерно усиливаются разнонаправленные патологические реакции окислительного стресса, которые продолжают персистировать на различном функциональном уровне после полноценного курса целенаправленной антимикробной монохимиотерапии, не способной, таким образом, полностью ликвидировать локальные оксидативные нарушения в предстательной железе даже при условии достижения удовлетворительной степени микробиологической эрадикации патогена из нее. Данные экспериментальные находки могут быть использованы для обоснования патогенетической целесообразности дополнительного к любой антимикробной химиотерапии назначения антиоксидантов и антигипоксантов, что особенно актуально с фармакотерапевтической точки зрения при рецидивирующем течении ХБП.



