Введение. Термином «тепловая ишемия почки» (ТИП) обозначают временную приостановку кровенаполнения почки посредством интраоперационного пережатия почечной артерии во время открытой или лапароскопической резекции данного органа. Временное интраоперационное обескровливание почки — метод выбора при хирургическом лечении локализованной формы почечно-клеточного рака (ПКР) [1, 2].
Потребность в операциях такого рода увеличивается год от года. По данным Российского Центра информационных технологий и эпидемиологических исследований в области онкологии в составе МНИОИ им. П. А. Герцена, в 2011-2014 гг. встречаемость ПКР среди взрослого населения Российской Федерации повышалась в среднем за год на 1,2%; с 2014 по 2016 г. ежегодный прирост составил уже 1,7%, с 2016 по 2017 г. - 2,6%. Распространенность ПКР за период с 2011 по 2017 г. увеличилась с 78,5 случаев на 100 тыс. человек до 114,7 на 100 тыс. населения. При этом частота ПКР в стадиях Т1 и Т2 за тот же промежуток времени выросла с 54,2 до 63,9% [3].
Включение ТИП в сценарий таких вмешательств безусловно - один из факторов их успешности, так как позволяет предотвращать развитие паренхиматозного кровотечения, оптимизирует условия оперирования, существенно повышает эффективность гемостаза [4]. Однако ТИП при этом остается ишемией - типовым патологическим процессом с комплексом патологических и защитно-приспособительных реакций, проявляющихся морфологическими, метаболическими и функциональными нарушениями со стороны ишемизированной (почечной) ткани.
Выделяют три элемента патогенеза структурно-функциональной дезорганизации ренальной ткани при хирургическом удалении пораженного раком участка почки: сосудистый, обструктивный и реперфузионный. Причиной активации двух первых из них служит пережатие почечной артерии, последнего - снятие ограничений для поступления артериальной крови во внутрипочечное русло [5, 6].
При пережатии почечной артерии в условиях прекращения поступления крови в микрососудистую сеть ренальной паренхимы первичным специфическим фактором, поражающим клетки почки, является гипоксия. Непосредственным ее последствием становится торможение АТФ-синтетической функции митохондрий и формирование недостатка АТФ в эффекторных нефроцитах. Доказано, что в условиях кислородной депривации максимально уязвимы эпителиоциты сегмента S-3 проксимальных канальцев, обладающие наибольшей гликолитической активностью. По мере реализации механизмов гипоксического повреждения формируются или усиливаются нарушения функций нефронов [7-13].
Традиционно по времени выделяют ТИП, продолжающуюся до 10 мин, от 10 до 30 мин и более 30 мин. По мнению многих исследователей, в первом случае функциональные расстройства почечной ткани не возникают, во втором - наблюдаются обратимые нарушения структуры и функции. Ограничение кровотока более 30 мин характеризуется высокой вероятностью летального повреждения эффекторных нефроцитов. В целом принято считать, что ишемическое воздействие «безопасно», если оно длится не больше 25 мин [14].
Существуют сторонники более жесткой позиции по отношению к проблеме допустимой продолжительности тепловой ишемии. Так, например, A. R. Patel et al. (2011), R. H. Thompson et al. (2010, 2012) подчеркивают, что на отдаленные функциональные результаты резекции почки оказывает влияние каждая минута остановки кровоснабжения оперируемой почки [15-17]. Следует отметить, что ткань почки не вся и не синхронно участвует в мочеобразовании, поэтому указанный выше авторами довод весьма спорный.
В настоящее время механизмы гипоксической альтерации клеток изучены весьма подробно. Установлена тождественность их причинно-следственных цепочек для клеток различного вида и происхождения. Показана зависимость появления новых расстройств внутриклеточного гомеостаза от времени гипоксии. Так, например, экспериментально доказано, что в пределах первых 5 мин кислородной депривации наблюдается снижение в 2-4 раза уровня внутриклеточного АТФ. В течение последующих 10 мин в цитоплазме и митохондриях накапливаются ионы кальция, выступающие в роли активаторов мембранных фосфолипаз. Далее от 15-й до 30-й мин гипоксии начинается ассоциированный с деятельностью активных мембранных фосфолипаз распад фосфолипидов мембран митохондрий с повышением их проницаемости, торможением процессов аккумулирования ионов кальция, а также разобщением окислительного фосфорилирования и снижением показателей работы митохондрий - коэффициентов окислительного фосфорилирования и дыхательного контроля до 0 и 1 соответственно. В течение последующего получаса возможно транзиторное повышение интенсивности дыхания митохондрий. Затем через 60-90 мин от начала гипоксического воздействия повреждения митохондрий приобретают необратимый характер, что влечет за собой гибель клетки в целом [18-21].
Такой сценарий развития гипоксической альтерации на молекулярно-клеточном уровне - стандартный для всех клеток независимо от их тканевой и органной принадлежности - в целом полностью согласуется с выводами многих исследователей, согласно которым, во-первых, продолжительность тепловой ишемии служит ведущим фактором, усиливающим или уменьшающим губительное влияние кислородной депривации и способным предопределить послеоперационный уровень функциональной состоятельности мочеобразовательной системы [22], во-вторых, даже в случаях, когда продолжительность ТИП не превышает 25 мин, послеоперационное снижение почечной функции имеет место более чем у 20% пациентов [23].
В настоящее время высока актуальность научного поиска методов защиты ренальной ткани при выполнении операций, фрагментом которых является ТИП. Выделяют два направления. Первое из них ориентировано на уменьшение продолжительности ТИП и/или ее выраженности (методики «нулевой ишемии»; селективной паренхиматозной ишемии; суперселективной деваскуляризации опухоли; суперселективной эмболизации артерий, питающих опухоль; управляемой гипотонии; «холодовой ишемии» с перфузией охлажденных растворов через сосудистое русло почки или обкладывании ее льдом и др.) [24-26], второе связано с фармакологической поддержкой ренальной паренхимы во время тепловой ишемии почки [27]. С учетом механизмов повреждения эффекторных нефроцитов в условиях ТИП наиболее патогенетически оправданным и целесообразным представляется использование фармакологических препаратов с антигипоксическим действием и применение прекурсоров макроэргических связей.
Антигипоксические лекарственные средства применяются при различных формах патологии, имеющих в своей основе гипоксические повреждения. В таких ситуациях результатом воздействия антигипоксантов становится повышение энергетического статуса пострадавших клеток, устранение дисбаланса между потребностями в АТФ и уровнем его биосинтеза [28]. Современные препараты антигипоксического типа действия классифицируют на пять групп: 1) ингибиторы окисления жирных кислот (пергелексин, этомоксир, триметазидин, ранолазин, мельдоний); 2) средства сукцинатсодержащие (реамберин, цитофлавин, ремаксол, оксимиетилэтилпиридина сукцинат) и сукцинатобразующие (оксибутират натрия, полиоксифумарин, конфумин); 3) естественные компоненты дыхательной цепи (цитохром С, убихинон); 4) искусственные редокс-системы (олифен или гипоксен); 5) макроэргические соединения (фосфокреатин) [29].
Все перечисленные препараты широко и успешно используются в кардиологической и неврологической практике, у офтальмологических больных, в гинекологии и в других областях медицины [29]. Одновременно с этим обращает на себя внимание малочисленность и разрозненность публикаций, посвященных проблемам антигипоксической защиты почечной ткани, в том числе вопросам антигипоксической нефропротекции в условиях ТИП. Отмеченные обстоятельства послужили основанием для проведения настоящего исследования.
Цель исследования: сравнительное изучение нефропротекторной активности маннитола, фумарата натрия и фуросемида на экспериментальной модели 30- или 60-минутной ТИП.
Материалы и методы. Опыты проведены на 360 конвенциональных кроликах-самцах породы шиншилла со средней массой тела 2,6±0,3 кг. В работе с животными придерживались этических принципов, изложенных в Европейской конвенции о защите позвоночных животных, используемых в экспериментальных и других научных целях.
Для достижения цели исследования разработан способ моделирования интраоперационной тепловой ишемии ренальной ткани, который заключается в наложении микрососудистого зажима на почечную артерию после срединной лапаротомии и скелетирования почечной ножки. Пережатие сосуда длилось 30 или 60 мин. После взятия образцов паренхимы почки кровоток по почечной артерии восстанавливался. Оперативное вмешательство завершали контролем гемостаза и ушиванием раны передней брюшной стенки отдельными узловыми викриловыми швами. Во время операции животным обеспечивали анестезиологическое пособие (золетил — 25 мг/кг в/в; рометар 2%-ный — 1,0—1,5 мл в/м; галотан-кислородная смесь). Для профилактики микробного заражения интраоперационно внутримышечно вводили раствор бициллина-5 в дозе 1 500 тыс. ЕД/кг.
Перед началом опытов всех животных разделили на 10 групп (2 контрольные и 8 рабочих), в каждой из которых число животных равнялось 36. Контрольные группы 1 и 2 включали интактных кроликов (1) и кроликов, которым проводили «ложную» операцию без пережатия почечной артерии (2). Во всех рабочих группах при выполнении вмешательства каждому из подопытных животных создавали модель тепловой ишемии почки, продолжительность которой в группах 3, 5, 7 и 9 составляла 30 мин, в группах 4, 6, 8 и 10 — 60 мин.
В группах 3 и 4 вмешательство выполняли без применения средств фармакологической нефропротекции. Кроликам групп 4 и 5 за 24 и 2 ч до операции вводили внутривенно натриевую соль фумаровой кислоты (далее — фумарат натрия) в разовой дозе 1,5 мл/кг. В качестве препаратов сравнения использовали лазикс (группы 7 и 8) и маннитол (группы 9 и 10). Введение обоих препаратов осуществляли внутривенно за 10 мин до наложения микрососудистого зажима на почечную артерию: лазикса - в дозе 3 мг/кг, маннитола — в дозе 1 г/кг.
Изучали макро- и ультраструктурные особенности почечной ткани всех животных. Для оценки макроструктурных характеристик почки проводили визуальную оценку органа. Состояние ультраструктурных компонентов ренальной ткани анализировали методом трансмиссионной электронной микроскопии биоптатов почечной паренхимы в ФГБУ «НИИ гриппа» Минздрава России на просвечивающем электронном микроскопе JEOL JEM 1011 с разрешающей способностью по точкам 0,3 нм, по линиям 0,14 нм и возможностью увеличения рассматриваемых объектов в 100-1 млн раз. Контрастирование проводили в спиртовом растворе уранил-ацетата и водном растворе цитрата свинца. Цифровую электронную микрофотосъемку осуществляли с помощью камеры Morada.
У всех кроликов через 2, 12, 24 и 72 ч после экспериментального вмешательства, а также в конце 1, 2, 3, и 4-й недели послеоперационного периода в сыворотке крови и/ или в моче измеряли уровни NGAL, цистатина-С, L-FABP, KIM-I, а также креатинина.
Для обработки полученных данных применяли методы вариационной статистики, пакет прикладных программ STATISTICA 6, содержащихся в Microsoft Excel-2010. Различия считали статистически значимыми при р<0,05.
Результаты исследования. Продольный и поперечный размеры почки животных, перенесших ТИП, уменьшались примерно на 5% по сравнению с таковыми у кроликов контрольной группы 2. Отмечены снижение тургора, побледнение и похолодание поверхности почки.
По данным электронной микроскопии, после 30-минутной ТИП и 60-минутной реперфузии в проксимальных канальцах имели место увеличенное число лизосом и вакуолизация цитоплазмы эпителиоцитов, грушевидность конечных сегментов микроворсин, признаки слабого набухания и отека щеточной каймы (рис. 1). В просветах дистальных канальцев и собирательных трубочек определялось хлопьевидное содержимое. У животных, не получавших медикаментозной поддержки, данные явления встречались в подавляющем большинстве случаев. В группах, где применялись фумарат натрия, лазикс и маннитол, отмеченные ультраструктурные нарушения были выражены в меньшей степени. Лучшую нефропротекторную активность проявлял фумарат натрия.
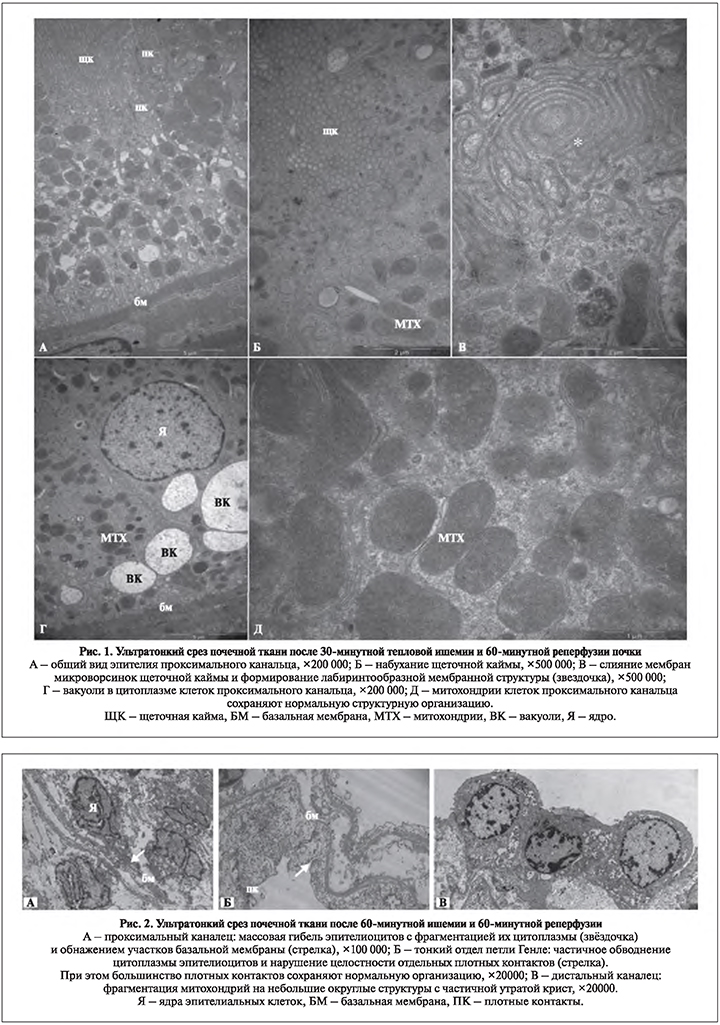
Все выявленные изменения ультраструктуры ишемизированной в течение 30 мин ренальной ткани имели место и после 60-минутной ТИП, но степень их выраженности была заметно выше (рис. 2). Кроме того, появились новые расстройства, отсутствовавшие после окклюзии почечной артерии меньшей продолжительности: агрегация и агглютинация форменных элементов в клубочковых и околоканальцевых капиллярах; изменения формы микроворсин проксимальных канальцев с заменой пальцевидной конфигурации на грушевидную или пузырьковидную; деструкция цитоскелета эпителиоцитов проксимальных канальцев в виде деполимеризации и фрагментации микротрубочек и миофиламентов; скопления рыхлой хлопьевидной субстанции с вкраплениями зернистого детрита не только в дистальных, но и в проксимальных канальцах; набухание и вакуолизация цитоплазмы эпителиоцитов дистальных канальцев и собирательных трубочек с утолщением их стенок и уменьшением диаметра просвета. После 60-минутной тепловой ишемии ренальной паренхимы без фармакокоррекции отмеченные ультраструктурные признаки гипоксической альтерации почечной ткани были выражены максимально. Применение лазикса и маннитола позволило несколько уменьшить степень расстройств.

Использование фумарата натрия сократило встречаемость таких нарушений до единичных случаев. После 30-минутной ТИП и введения этого препарата изменения ультраструктуры почки ограничивались редкими грушевидными расширениями концов микроворсин и немногочисленными скоплениями рыхлого хлопьевидного вещества в просветах дистальных канальцев и собирательных трубочек.
Как показано на рис. 3, после 60-минутного теплового обескровливания, выполненного на фоне действия фумарата натрия, в проксимальном отделе почечных канальцев для большинства эпителиоцитов характерно сохранение щеточной каймы в интактном виде (или, возможно, очень быстрая регенерация щеточной каймы); грушевидные и пузырьковидные расширения микроворсинок встречались в единичных случаях. В клетках эпителия проксимальных канальцев хорошо определялись базальные складки, ассоциированные с ориентированными по апикально-базальной оси многочисленными митохондриями, контакт клеток с базальной мембраной, практически полная сохранность системы изолирующих плотных контактов, определяющих целостность эпителиального пласта и его функциональную поляризацию. Лишь в отдельных случаях наблюдались повышение числа лизосом, фрагментация микротрубочек и миофиламентов цитоскелета в цитоплазме клеток эпителия проксимальных канальцев. Все эти признаки приближают ультраструктурную организацию проксимального канальца в условиях фумарат-опосредованной нефропротекции к нормальной и резко отличают ее от картины практически полной деструкции проксимального канальцевого эпителия после 60-минутной ТИП, выполненной без медикаментозной поддержки.
Несмотря на значительное снижение выраженности патоморфологических изменений в проксимальном канальце при использовании фумарата натрия, в некоторых случаях прослеживалась клеточная гибель канальцевых эпителиоцитов (рис. 3, А). Однако имел место исключительно некроз отдельных немногочисленных клеток, соседствовавших с нормальными эпителиоцитами в том же канальце. У животных, перенесших 60-минутное тепловое обескровливание почки и не получавших фумарата натрия, имела место картина массовой гибели эпителиоцитов.
Ультраструктура более дистальных сегментов нефрона (тонкий сегмент петли Генле, дистальный каналец, собирательная трубка) в условиях фумарат-опосредованной фармакологической нефропротекции при 60-минутной ТИП была сходной с таковой в контрольных условиях (рис. 3, В—Д). Отмечалась лучшая сохранность митохондрий дистального канальца, ассоциированных с базальными складками клеточной мембраны, по сравнению с их фрагментацией и деградацией крист после 60-минутного теплового обескровливания почки у животных, не получавших фумарата натрия, при ишемическом стрессе без нефропротекции (рис. 3, Г).
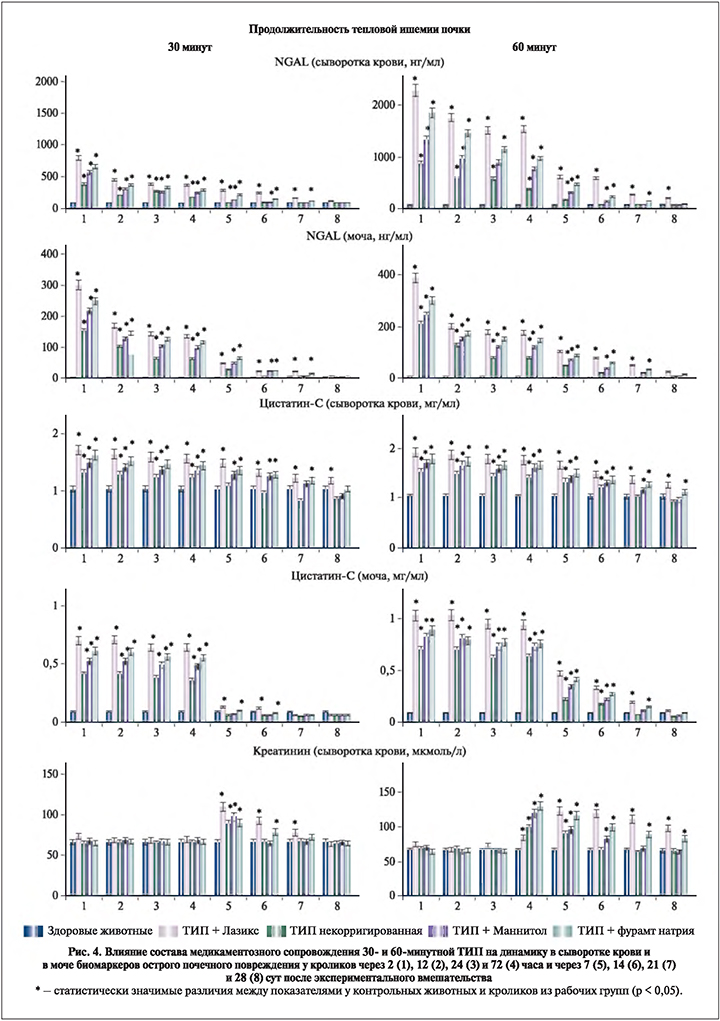
Изменения концентраций NGAL и цистатина-С в сыворотке крови и в моче, уровня креатинина в сыворотке крови после 30- или 60-минутной ТИП (некорригированной и выполненной на фоне действия фумарата натрия, лазикса и маннитола) отражены на рис. 4.
Сывороточная концентрация NGAL уже через 2 ч после экспериментальной операции с 30- или 60-минутной ТИП была резко (пикообразно) повышена: у животных с некорротированным обескровливанием — в 10 и 31 разе; на фоне действия фумарата натрия — в 5 и 11; лазикса — в 7 и 18; маннитола — в 9 и 25 разах. Далее следовало постепенное снижение показателя. Нормализация состоялась через 2 нед. у кроликов, защищенных фумаратом натрия независимо от времени ТИП; на 1 нед. позже в группах с применением лазикса и на 2 нед. позже у животных с некорригированной 30-минутной ишемией и у всех особей, получавших маннитол. При завершающих измерениях NGAL в крови оставался повышенным после 60-минутной некорригированной ТИП.
Уровень NGAL в моче, как и в сыворотке крови, был повышен уже через 2 ч после вмешательства: в 50 и 68 раз у животных, перенесших 30- или 60-минутную ТИП без лекарственной поддержки (р=0,039 и р=0,034 соответственно), в 23 и 37 в группах с применением фумарата натрия (р=0,02 и р=0,005 соответственно), в 40 и 42 у кроликов, получавших лазикс (р=0,039 и р=0,034 соответственно) и в 41 и 55 раз на фоне действия маннитола (р=0,010 и р=0,001 соответственно). Затем концентрации аналита поэтапно уменьшались. Различия с контрольным содержанием NGAL в моче утрачивались в конце периода наблюдения в группах с некорригированной 30- или 60-минутной ТИП и в группах, где использовался маннитол. После постановки опыта и введения лазикса нормализация наступала на 1 нед. раньше. У кроликов, защищенных фумаратом натрия, дооперационный уровень NGAL в моче был восстановлен через 1 нед. после 30-минутной ТИП, через 2 нед. после 60-минутного обескровливания.
Содержание в крови цистатина-С после 30- или 60-минутного пережатия почечной артерии без лекарственной поддержки увеличено в течение всего периода наблюдения с максимумом в первые 2 ч, превысившим значение в фоне на 64 и 85% соответственно. В условиях фумарат-опосредованной защиты через 2 ч после 30-минутной ТИП уровень аналита поднялся только на 27% и нормализовался уже на 7-й день. После введения лазикса значение показателя в первые 2 ч после 30- или 60-ишемии увеличилось на 42 и 65%, после введения маннитола на 56 и 72%. Далее показатель постепенно снижался. Нормализация имела место не ранее, чем на 28-е сутки. и только у животных с 30-минутной ТИП.
Уровень цистатина-С в моче кроликов групп 3 и 4 в первые 3 сут. после некорригированной тепловой ишемии почки, продолжавшейся 30 мин, повысился восьмикратно; после 60-минутной ТИП — двенадцатикратно. Нормализация показателя была отмечена в конце третьей и четвертой недель мониторинга соответственно.
На фоне действия фумарата натрия в первые 3 дня после ТИП, длившейся 30 мин, содержание цистатина-С в моче увеличилось в 5 раз, однако уже на 7-е сутки восстановилось до исходной величины. При увеличении продолжительности обескровливания до 60 мин уровень данного вещества в моче повышался восьмикратно с нормализацией не ранее конца 3-й недели от начала эксперимента.
В первые 72 ч после 30- или 60-минутной ТИП и введения лазикса концентрация в моче кроликов цистатина-С возрастала в 6 и 9 раз по сравнению с исходным значением (р=0,030 и р=0,006 соответственно). Снижение уровня цистатина-С в моче до первоначального наблюдалось на 7-е сутки, если время тепловой ишемии не превышало 30 мин и в конце третьей недели эксперимента после 60-минутного обескровливания.
У кроликов, получавших маннитол, в первые 72 ч после 30-минутного обескровливания ренальной ткани содержание цистатина-С в моче повысилось в 6—7 раз (р=0,025 и р=0,030 соответственно); после 60-минутной ТИП — в 8-10 (р=0,032 и р= 0,011 соответственно). Далее наблюдалось постепенное уменьшение показателя. Результаты измерений на 21-е и 28-е сутки статистически значимо не отличались от дооперационных значений.
Повышение уровня креатинина в сыворотке крови после моделирования ТИП отмечено только через 7 дней после 30-минутной ишемии и на 3-и сутки после 60-минутного обескровливания. При этом максимальные концентрации формировались в условиях некорригированной ТИП, менее высокие - на фоне действия маннитола, еще меньше - при использовании лазикса; самые низкие - у животных, получавших фумарат натрия.
Обсуждение. Согласно результатам проведенного исследования, фумарат натрия, вводимый внутривенно в разовой дозе 1,5 мл/кг за 24 и 2 ч до экспериментальной операции с моделированием ТИП различной продолжительности (30 или 60 мин), в значительной степени ограничивает выраженность острого ишемического повреждения почечной ткани, главным звеном патогенеза которого является ассоциированное с кислородной депривацией снижение энергетического статуса эпителиоцитов проксимальных почечных канальцев.
Экспериментально это подтверждается, во-первых, различиями ультраструктурных особенностей почечной ткани животных, перенесших 30- или 60-минутную ТИП на фоне действия фумарата натрия и без применения какой-либо медикаментозной поддержки, в пользу натриевой соли фумаровой кислоты; во-вторых, статистически значимыми различиями между особенностями послеоперационной динамики NGAL и цистатина-С в сыворотке крови и в моче, креатинина в сыворотке крови также в пользу фумарата натрия.
Кроме того, в соответствии с данными, полученными при электронно-микроскопическом исследовании почечной ткани и лабораторном поэтапном анализе уровней содержания в крови и в моче биомаркеров ОПП, нефропротекторная активность фумарата натрия существенно превосходит таковую у лазикса и маннитола.
Применение янтарной, фумаровой кислот и их производных в фармакотерапии повреждений, связанных с гипоксией и дефицитом образования макроэргических соединений, основано на более позднем подавлении активности FAD-опосредованного сукцинатоксидазного фрагмента цитратного цикла в клетках, лишенных кислорода, по сравнению с NAD-зависимыми звеньями. Следовательно, даже при кислородной депривации существует возможность поддерживать энергообразующую функцию митохондрий в течение определенного времени. Условием для этого служит наличие в митохондриях необходимых субстратов, которыми могут быть экзогенные сукцинаты в составе, например, мексидола, цитофлавина или реамберина. Кроме того, пополнение пула митохондриальных сукцинатов может быть обеспечено введением извне сукцинатобразующих соединений, к которым относятся оксибутират натрия, фумарат натрия и полиоксифумарин.
После экзогенного введения во внутреннюю среду фумарата натрия и его электролитической диссоциации анионы фумаровой кислоты (фумараты) легко преодолевают общеклеточные и митохондриальные мембраны. В митохондриях в условиях гипоксии происходит трансформация фумаратов в сукцинаты, пополняющих митохондриальный пул субстратов FAD-зависимого сукцинатоксидазного звена цикла Кребса и увеличивающих за этот счет образование АТФ в течение определенного промежутка времени, например времени теплового обескровливания почки.
Достаточность энергетического статуса ишемизированных клеток в период ТИП, обеспечиваемая экзогенным введением фумарата натрия, становится, во-первых, фактором, не допускающим торможения АТФ-зависимого трансмембранного транспорта ионов, альтерации клеточных и внутриклеточных мембран, потерь ионов калия и накопления кальция в гиалоплазме с активацией мембранных фосфолипаз, роста интрацеллюлярного коллоидноосмотического давления и набухания клеток, высвобождения активных лизосомальных гидролаз, повреждения генетического аппарата клеток и запуска апоптической программы и других нарушений, ведущих к необратимой альтерации и гибели клетки; во-вторых, фактором, способствующим сохранению функционального потенциала ренальной паренхимы во время ТИП и состоятельности почечной функции в послеоперационном периоде.
Результаты проведенного исследования полностью согласуются с мнением многих исследователей о целесообразности и эффективности применения препаратов антигипоксического типа действия, в частности сукцинатобразующих соединений, для профилактики и коррекции ишемическигипоксических расстройств в клинической практике.
Выводы
1. Исследованные препараты оказали нефропротекторное действие в отношении тепловой ишемии почки кроликов: в наибольшей мере — при введении фумарата натрия, затем фуросемида и в меньшей — маннитола.
2. Применение фумарата натрия позволяет максимально эффективно защищать и стимулировать почечную ткань во время кислородной депривации.



