Введение. В настоящее время большинство опухолей почки диагностируется на ранних стадиях, когда, согласно рекомендациям Европейской и Американской ассоциаций урологов, пациентам могут быть выполнены органосохраняющие операции [1, 2]. Они имеют несомненные преимущества перед радикальной нефрэктомией, так как удаление наряду с опухолью достаточного количества нормально функционирующих нефронов приводит к развитию хронической болезни почек и сердечно-сосудистой коморбидности [3, 4]. За последние десятилетия активно внедрены лапароскопическая и робот-асисстированная ПН. Однако ПН этими доступами остается технически сложной операцией из-за крутой кривой обучения, необходимости опыта в интракорпоральном ушивании дефекта почки и развития различных интра- и послеоперационных осложнений, особенно при резекции почки со сложными образованиями [5–10]. Роботическая система представляет хирургам преимущества перед традиционной лапароскопией за счет исключения тремора рук, улучшенной 3D-визуализации и эргономики инструментов, что облегчает удаление опухолей почки, локализованных даже по ее задней поверхности или в верхнем полюсе. Наиболее важным этапом ПН является пережатие ПА, что снижает приток крови и минимизирует ее потерю, улучшает интраоперационную визуализацию. Однако даже при непродолжительном пережатии ПА происходит тепловая ишемия почки, что может приводить к нарушению ее функции. Поэтому с накоплением опыта в выполнении ПН предлагались различные способы снижения ВТИ: раннее снятие сосудистого зажима, селективная и зеро-ишемия [11–17]. Среди урологов еще нет окончательного консенсуса по поводу выбора наиболее оптимального метода ишемии при ПН. Методика ПН с зеро-ишемией на первый взгляд более подходящая, так как кровоснабжение почки сохраняется в течение всей операции. Однако при этом существует опасность выраженного кровотечения, особенно при резекции почки с эндофитными образованиями. Объем кровопотери также может увеличиваться при использовании этой методики при ПН сложных опухолей неопытными хирургами. Поэтому для сохранения функции почки и исключения полного пережатия ПА оптимальна селективная ишемия. Данная методика подразумевает предоперационное изучение анатомии ПА и ее ветвей с помощью КТ-ангиографии, которая позволяет уточнять их строение и определять одну или две небольшие артерии, непосредственно кровоснабжающие опухоль почки [11, 15–17]. В данном случае возможно пережатие ветви ПА 1-го порядка, но при этом увеличивается площадь ишемии (селективная) или выделение и пережатие небольшой артерии 2-го или 3-го порядка, которая идет непосредственно к опухоли (суперселективная). Также нет публикаций, изучавших влияние данного типа ишемии на послеоперационную функцию оперированной почки, за исключением нескольких работ с противоречивой информацией [16, 18, 19]. Целью настоящей работы стала оценка эффективности робот-ассистированной ПН (РАПН) с селективной ишемией почки.
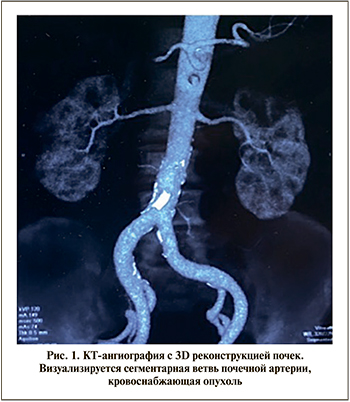
Материалы и методы. В исследование включены результаты РАПН у 42 больных с опухолью почки Т1а- (34) и Т1в- (8) стадий. Мужчин было 25 (59,5%), женщин – 17 (40,5%), средний возраст составил 56,0±7,5 лет. Размеры опухоли колебались от 2,5 до 6,8 см (средний – 3,6±1,5). Больные с единственной почкой и множественными образованиями, перенесшие ПН с пережатием ПА были исключены из исследования. Всем пациентам выполнены клинический и биохимический анализы крови, ультразвуковое исследование почек и КТ органов брюшной полости с внутривенным контрастированием. С помощью КТ-ангиографии и 3D-реконструкции определяли сегментарные ветви ПА, в том числе кровоснабжающие непосредственно опухоль (рис. 1). Сложность образований оценивалась с помощью нефрометрической шкалы RENAL. Сведения о пациентах приведены в табл. 1.

Ретроспективно были проанализированы демографические данные пациентов, среднее время операции и объем кровопотери, ВТИ, продолжительность пребывания в стационаре, пред- и послеоперационная функции почек и онкологические результаты. Предоперационный уровень креатинина и СКФ сравнивались с послеоперационными показателями. Все 30-дневные осложнения РАПН проспективно регистрировались и оценивались по классификации Клавьена–Диндо. Операцию считали успешной при выполнении ее под селективной ишемией. Для оценки достоверности сравниваемых параметров использовали критерий Стьюдента для параметрических и Манна–Уитни для непараметрических данных.
Хирургическая техника РАПН. Все операции нами выполнялись с помощью роботизированной хирургической системы da Vinci Si и трансперитонеальным доступом. В положении больного на боку при РАПН слева устанавливали пять портов, а справа при необходимости для ретракции печени использовали дополнительный 5-мм порт. Расположение троакаров представлено на рис. 2 и 3. Толстая кишка отводилась медиально, выделяли почку с опухолью, ПА и ее ветви. По данным предоперационной КТ-ангиографии определяли небольшую артерию, идущую непосредственно к опухолевому образованию. После ее пережатия резецировали монополярными ножницами опухоль почки, отходя от ее края 0,5 см. При наличии второй артерии ее также брали на держалку и пережимали при выраженном кровотечении. После иссечения образования производили ревизию его основания для исключения повреждения чашечно-лоханочной системы (ЧЛС) и при вскрытии чашки восстанавливали герметичность непрерывным швом. Далее проводилось ушивание дефекта паренхимы почки по методике скользящей клипсовой ренографии. Всем пациентам был установлен паранефральный дренаж, который удалялся через 2–3 дня после операции.
Результаты. РАПН с селективной ишемией была успешной для всех больных. Среднее время операции и ВТИ составили 130,0±35 и 14,0±3,2 мин соответственно. Время диссекции таргетных ветвей ПА в среднем было 16,0±8 мин. Объем кровопотери составил 185,0±80,0 мл, гематокрит после операции снизился на 4,2%, что было статистически значимым (р<0,05). Средние значения СКФ до и после РАПН составили 76,5 и 72,0 мл/мин/1,73 м2, снижение СКФ через 1 мес. после операции не было статистически значимым (р>0,05). Из 42 пациентов, которым была выполнена РАПН с селективной ишемией, 38 были успешно завершены, в то время как 4 пациентам потребовалось пережатие ПА из-за чрезмерного кровотечения. Поэтому в нашем исследовании успех методики составил 90,5% (38/42). Остальные 4 (9,5%) пациента имели T1b-стадию, эндофитное образование и RENAL-баллы>8. Повреждение почечной вены имело место у одного пациента с опухолью 5,8 см по задней поверхности верхнего полюса правой почки. Дефект вены был ушит непрерывным швом. Послеоперационные осложнения наблюдались у 5 (12,0%) больных: у 3 по Клавьену–Диндо 1–2-й, у 2 – по Клавьен–Диндо 3-й степеней. Среди них у одного больного наблюдался илеус, разрешившийся спонтанно, у двух – послеоперационное кровотечение, потребовавшее переливания крови, еще у двух больных – уринома, потребовавшая чрескожного дренирования. Результаты РАПН с селективной ишемией приведены в табл. 2. При патоморфологическом исследовании 42 резецированных опухолей выявлено 36 (85,7%) злокачественных образований, из них 28 установлена рТ1а- и 8 – рТ1в-стадии заболевания.

У остальных 6 (14,3%) из 42 больных выявлены доброкачественные образования. Положительный хирургический край был диагностирован у одного пациента, за период наблюдения 32 мес. рецидив опухоли не наблюдался.
Обсуждение. В настоящее время ПН является «золотым» стандартом хирургического лечения больных с опухолью почки Т1а- и при технической возможности Т1в-стадий. Функция почки после ПН может быть нарушена вследствие ишемического повреждения ее паренхимы. Для достижения отрицательного хирургического края наряду с опухолью необходима резекция небольшого участка нормальной почечной паренхимы. Однако тотальная или частичная ишемия остается значимым фактором, влияющим на послеоперационный почечный резерв. Поэтому основной целью при ПН должна быть минимизация тепловой ишемии. Полное пережатие ПА обеспечивает оптимальную интраоперационную визуализацию с бескровным операционным полем, но при этом увеличивается риск нарушения функции почки. По этой причине селективное пережатие питающих опухоль ветвей ПА привлекательно из-за ограничения ишемии только в зоне операции. Таким образом, можно избегать тотальной тепловой ишемии и эффективно защищать функцию почек. J. Furukawa et al. [18] сравнивали результаты ПН с тотальной и селективной ишемией и показали, что при последней наблюдалось меньшее снижение функции почки через 1 нед. после операции. Однако через 1 мес. функциональные результаты в обеих группах были одинаковыми. Р. Shao et al. [11] также продемонстрировали, что пациенты после РАПН с селективной ишемией имеют лучшее раннее восстановление функции почек по сравнению с пережатием ПА. В исследовании C. Basatac и H. Akpinar [19] время локальной тепловой ишемии составило 16 мин, среднее снижение послеоперационной функции не было статистически значимым в течение 1 мес. наблюдения.
В 2015 г. L. Zhou et al. [20] опубликовали систематический обзор 7 ретроспективных исследований, проведенных для сравнения селективной и тотальной ишемии при резекции почки. Различий между группами по среднему времени операции, количеству хирургических осложнений и продолжительности пребывания в стационаре не было. Хотя предполагаемая кровопотеря была значительно выше при селективной ишемии, по данным мета-анализа, не было отмечено существенной разницы в частоте гемотрансфузий между группами. В нашем исследовании было только одно повреждение почечной вены во время манипуляций в синусе, успешно ушитое. Хотя среднее снижение послеоперационного гематокрита было статистически значимым, только двум пациентам в послеоперационном периоде проводилось переливание крови. Осложнения ≥3-й степени по Клавьену–Диндо наблюдались у 2 (4,7%) пациентов, аналогичные тем, о которых сообщалось в литературе для селективной ишемии при РАПН в диапазоне 7–16% [14, 16, 20–22]. В современной литературе нет четких данных, согласно которым увеличение интраоперационной кровопотери оказывает какое-либо негативное влияние на онкологические результаты РАПН с селективной ишемией. В самых больших сериях РАПН частота положительного хирургического края колебалась от 0 до 10% [23–25].
В нашей серии данное осложнение было у 1 (2,4%) больного, у которого за период наблюдения рецидива не было.
В нашем исследовании успех РАПН с селективной ишемией составил 90,5% (38/42), и он был аналогичен результатам других ретроспективных исследований роботических и лапароскопических ПН с использованием метода селективной ишемии в диапазоне от 77 до 100% [11, 18, 19, 26]. Четверым (7,5%) из-за неконтролируемого кровотечения при резекции почки с опухолью пришлось пережимать ПА. У них были диагностированы крупные (Т1в) эндофитные образования и высокие баллы (>8) по RENAL-нефрометрической шкале. Такие сложные опухоли нередко кровоснабжаются несколькими сегментарными артериями, поэтому трудно контролировать их при ПН. При подобных ситуациях необходимо на предоперационном этапе обсудить с пациентом все интраоперационные сценарии и возможность конверсии в тотальную ишемию. Кроме того, изначальное полное пережатие ПА может быть наиболее подходящим для этих больных. Поэтому необходимо перед РАПН с селективной ишемией выполнять пациентам КТ-ангиографию с 3D-реконструкцией для изучения анатомии внутрипочечных сосудов. Результаты работы указывают на сложность сегментирования и вариабельность почечной васкуляризации. В использованной методике таргетной артерией для пережатия является питающая опухоль ветвь, которая перед входом в паренхиму отходит от последней бифуркации. Любое пережатие перед ней приводит к расширению зоны ишемии. В результате выделение и точное пережатие самой последней ветви, кровоснабжающей опухоль, обеспечивает минимальную зону ишемии и достаточный контроль кровотечения при резекции почки с образованием. Большие эндофитные опухоли могут кровоснабжаться двумя или более небольшими артериями, когда пережатие только одной из них не позволяет бескровно производить ПН. В этом случае приходится наложить сосудистый зажим на дополнительную ветвь или ПА. При этом зона ишемии значительно увеличивается вплоть до тотальной, что может приводить к снижению послеоперационной функции почки, на которую, по данным P. Shao et al. [11], достоверно влияют характеристики образования. При однофакторном анализе авторы установили, что размер опухоли, ее расположение и эндофитность значимо коррелировали со снижением СКФ, но при многофакторном анализе этой ассоциации не было. Эти показатели были независимо связаны с количеством пережатых ветвей, которое может быть предиктором послеоперационной функции почек и объема кровопотери. J. Qian et al. [17] изучали предикторы успешности лапароскопической ПН пережатием сегментарной артерии у 225 больных, которое было эффективным для 190 (84,4%) из них. Конверсия в тотальную ишемию была у 35 (15,6%) больных, у которых наблюдались длительное время операции, меньший объем кровопотери и значимое снижение СКФ в послеоперационном периоде. Однофакторный анализ показал, что на возможность селективной ишемии влияют пол больных, артериальная гипертензия, локализация и характер роста опухоли, количество таргетных артерий и RENAL-баллы. При многомерном анализе мужской пол и высокие RENAL-баллы были независимым фактором, снижавшим эффективность ПН селективной ишемией. Влияние пола больных на результаты операции сложно объяснить, но ассоциация высоких RENAL-баллов с успешностью ПН с пережатием сегментарной артерии вполне очевидна. Известно, что сложность резекции почки с опухолью зависит от размера самой опухоли, ее локализации и эндофитного роста, которые определяются по предоперационной КТ и используются при нефрометрической шкале RENAL. Поэтому, чем они больше, тем сложнее будет предстоящая резекция почки с опухолью, что и объясняет ассоциацию между показателями нефрометрической шкалы и результатами ПН.
Наше исследование имеет определенные ограничения. Во-первых, оно одноцентровое с недостаточным количеством включенных больных, что не позволяет делать окончательные заключения о результатах ПН с селективной ишемией почки. Во-вторых, в исследовании отсутствовала контрольная группа для сравнения результатов с РАПН с тотальной и зеро-ишемией. Тем не менее проведенное исследование позволило сделать вывод, согласно которому селективная ишемия является надежным хирургическим методом контроля кровотечения при РАПН.
Заключение. Пережатие сегментарной ветви ПА, непосредственно кровоснабжающей зону локализации опухоли, – безопасный и эффективный хирургический метод для минимизации ВТИ во время РАПН. Однако крупные эндофитные опухоли с высокими нефрометрическими баллами могут оказать негативное влияние на успех РАПН с селективной ишемией. Поэтому необходимо на предоперационном этапе с помощью КТ-ангиографии детально изучать строение почечных сосудов, устанавливать характеристики опухоли и определять кровоснабжающую ее небольшую ветвь почечной артерии.



