Введение. Мужское бесплодие – многофакторное и гетерогенное заболевание, которое затрагивает примерно 10–15% взрослого мужского населения во всем мире [1–5]. Широко признано, что многие факторы, в том числе и генетические, оказывают влияние на сперматогенез с последующим развитием бесплодия [6–8]. Приблизительно 30% мужского бесплодия связано с генетическими аномалиями, включая хромосомные аберрации, повреждение ДНК и одиночные генные мутации [8–10]. Генетические полиморфизмы могут повышать уровень индивидуальной восприимчивости к потенциальному неблагоприятному воздействию факторов окружающей среды (например, воздействие химических веществ, вредных привычек, ксенобиотиков и т.д.) и оказывать влияние на репродуктивную функцию человека [6, 10]. Эпидемиологические исследования показали, что повышенное воздействие вредных веществ окружающей среды напрямую связано со снижением качественных и количественных показателей эякулята [11].
Глутатион-S-трансферазы играют ключевую роль в биотрансформации и инактивации токсичных электрофилов, особенно тех, которые содержатся в табачном дыме, а также ингибируют апоптоз и усиливают пролиферацию клеток [12]. Связываясь непосредственно с токсичными продуктами метаболизма, глутатион-S-трансфераза нейтрализует их действие [4].
Анализ ассоциации генетических полиморфизмов генов метаболических и антиоксидантных систем – в настоящее время актуальное направление в изучении различных форм мужского бесплодия [9, 13, 14]. Поскольку полиморфизм глутатион-S-трансфераз определяет индивидуальную чувствительность организма к воздействию факторов внешней среды [14], различия в частотах распределения аллелей и генотипов гена GSTP1 могут отражать разные клинические проявления патоспермии в разных популяциях.
Целью данной работы стало изучение ассоциации полиморфизмов гена глутатион-S-трансферазы GSTP1(Ile/Val) (A313G; rs1695) с риском развития патоспермии у мужчин Московского региона.
Материалы и методы. Мы обследовали 138 мужчин Московского региона. Все пациенты были поделены на две группы:
- 1-я группа исследования – 70 бесплодных мужчин (по данным спермограммы) в возрасте 30±2 лет;
- 2-я группа исследования – 68 фертильных мужчин (имевших одного и более детей) в возрасте 29±4 лет.
Все пациенты проходили предварительное клиническое обследование: сбор жалоб, анамнеза, обследование объективного и урологического статуса, анализ спермограммы (ВОЗ-2010, морфологию сперматозоидов определяли по критериям Крюгера), исследование гормонального профиля, определение кариотипа и наличие делеций AZF-региона Y-хромосомы, мутации гена CFTR.
Критерии исключения: генетические аномалии (выявленные путем кариотипирования), лейкоспермия, инфекции, передающиеся половым путем, обструктивное бесплодие, варикоцеле, женский фактор бесплодия.
Для изучения ассоциации полиморфизмов гена глутатион S-трансферазы GSTP1 (Ile/Val) (A313G; rs1695) с риском патоспермии мы выделили геномную ДНК из лейкоцитов крови с использованием набора «ДНК-ЭКСТРАН-1-кровь» производства «Синтол» (Россия). Мы применяли методы полимеразной цепной реакции (ПЦР) в режиме реального времен (Real-Time-PCR). Для ПЦР использовали наборы для определения полиморфизмов (компания «Синтол»). ПЦР выполняли на амплификаторе СFX96 (Bio-Rad) с программным обеспечением CFX ManagerTM. Генотипирование полиморфизмов осуществлялось на основе метода Tag Man-зондов относительно флуоресценции (RFU) каждого зонда.
 Сравнение частот встречаемости аллелей исследуемых SNP в популяциях проводили с помощью критерия X2, 95% ДИ (доверительный интервал) и программы Statistica 6.0. Распределение генотипов в выборках на соответствие равновесию Харди–Вайнберга проводили с использованием точного критерия (Exact test) . Различия считали статистически значимыми при p<0,05.
Сравнение частот встречаемости аллелей исследуемых SNP в популяциях проводили с помощью критерия X2, 95% ДИ (доверительный интервал) и программы Statistica 6.0. Распределение генотипов в выборках на соответствие равновесию Харди–Вайнберга проводили с использованием точного критерия (Exact test) . Различия считали статистически значимыми при p<0,05.
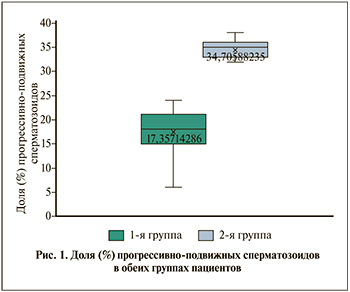
Результаты. По показателям спермограммы пациенты первой группы распределились следующим образом: у 26 (37,14%) мужчин была выявлена астенозооспермия (подвижных сперматозоидов – 26,3±3,7%), у 23 (32,85%) – тератозооспермия (патологические формы сперматозоидов – 97±2,3%), у 21(30,0%) – азооспермия. У пациентов второй группы показатели спермограммы находились в пределах референсных значений. Наиболее достоверные различия (p<0,001) между группами пациентов мы выявили при анализе доли прогрессивно подвижных сперматозоидов (рис. 1).
Микроскопия секрета простаты достоверных изменений между группами не выявила (р=0,34). Отклонений в гормональном профиле ни в первой, ни во второй группе мы не выявили.
Все пациенты имели нормальный кариотип. Мутаций в гене CFTR и микроделеций AZF локуса в Y-хромосоме выявлено не было. Таким образом, видимых причин патоспермии во второй группе пациентов мы не выявили. Этим пациентам был установлен предварительный диагноз: идиопатическое мужское бесплодие.
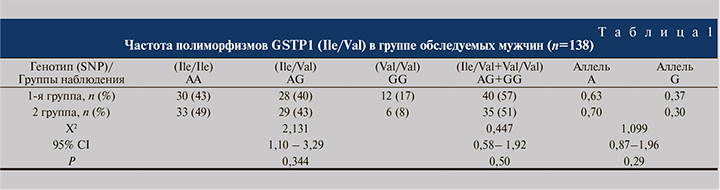
При анализе частот распределения полиморфизмов GSTP1(Ile/Val) (A>G rs1695) мы выявили преобладание генотипа АА у фертильных мужчин и преобладание генотипа GG (гомозиготный минорный аллель) у мужчин с патоспермией (табл. 1). Однако существенной разницы по этим показателям между сравниваемыми группами пациентов мы не выявили (р=0,344). Поэтому мы провели сравнительный анализ распределения частот генов и генотипов по изучаемым полиморфизмам гена GSTP1 в подгруппах мужчин с разными параметрами спермограммы, результаты которого приведены в табл. 2.
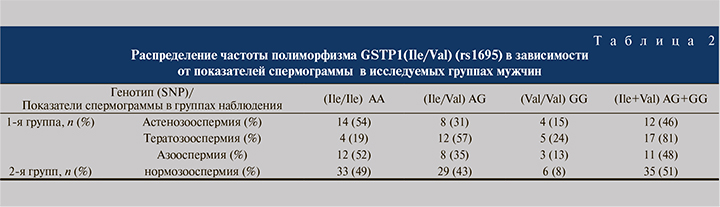
Для полиморфизма GSTP1 (Ile/Val) (A313G, rs1695) были выявлены достоверные различия распределения частот генотипов в подгруппе мужчин с тератозооспермией (χ2=7,00; р=0,03). Частота аллеля G в подгруппе мужчин с тератозооспермией статистически достоверно отличается от таковых аллелей в группе контроля: 52 против 30% (χ2=10,004; p=0,0015). В подгруппах мужчин с азоо- и астенозооспермией достоверных различий в распределении генотипов относительно полиморфизма GSTP1 (rs1695) не выявлено (р>0,05).
Обсуждение. Глутатион -S-трансферазы служат ксенобиотическими метаболическими ферментами, участвующими в детоксикации токсичных ариламинов, ароматических аминов, гидразинов и активных форм кислорода (ROS), которые образуются при окислительных и электрофильных стрессах [15]. Поэтому при развитии патоспермии наблюдается снижение содержания глутатиона и активности глутатионредуктазы на фоне повышения активности глутатион-S-трансферазы по сравнению со здоровыми мужчинами [16]. Следовательно, одним из звеньев патогенеза мужского бесплодия является дисбаланс антиоксидантных ферментов [16].
N.T. Trang et al. (2018) изучали связь однонуклеотидных полиморфизмов (SNP) GSTP1 (rs1695) с предрасположенностью к идиопатическому мужскому бесплодию (n=300) у вьетнамских мужчин [15]. Выявлена достоверная ассоциация GSTP1 Ile105Val (OR: 5.11; р<0,001) с риском развития патоспермии [14].
В работе N. Lakpur et al. (2013) выявлено незначительное влияние полиморфизма GSTP1 Ile/Val на параметры спермограммы, однако не установлена ассоциация данного полиморфизма с олиготератозооспермией [17].
X.K. Huang et al. провели мета-анализ ассоциации полиморфизма GSTP1 Ile105Val (n=3282) [4]. При анализе локальных генетических мутаций китайских и азиатских мужчин авторы не выявили достоверной разницы частот полиморфизмов. Исследователи зарегистрировали значимые ассоциации при доминантных (OR=1,23, 95% CI=1,04–1,46, I2=32,2%) и гетерозиготных (OR=1,29, 95% CI=1,08–1,53, I2=26,8%) полиморфизмах между бесплодными и фертильными мужчинами [4].
В европейской мужской популяции также была выявлена ассоциация полиморфизма глутатион трансферазы Т (GSTT) с нарушением параметров спермограммы у мужчин с бесплодием в Испании [18].
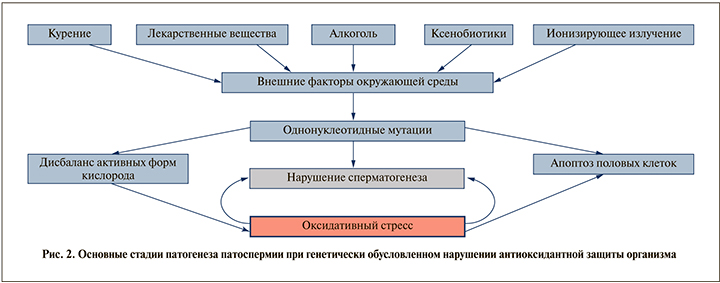
Наше исследование было посвящено изучению ассоциации полиморфизмов фермента глутатион-S-трансферазы GSTP1 (Ile/Val; rs1695) с риском развития патоспермии у мужчин, проживающих в Московском регионе. Результаты этого исследования показали, что распределение частот генотипа GSTP1 (rs1695) достоверно не отличается в группах фертильных и бесплодных мужчин (р>0,05). Однако мы зарегистрировали статистически достоверную ассоциацию полиморфизма GSTP1 (Ile/Val; rs1695) с риском развития тератозооспермии (χ2=6,55; p=0.037). Данное наблюдение раскрывает еще одну грань патогенеза идиопатического бесплодия. Известно, что морфологически аномальные сперматозоиды способны продуцировать АФК с повышенной скоростью из-за снижения антиоксидантной активности [6, 19], что суммируется в общую картину оксидативного стресса и развития мужского бесплодия (рис. 2).
Результаты наших исследований согласуются с выводами других авторов, согласно которым оксидативный стресс, вызванный уменьшением активности ферментов антиоксидантной системы вследствие полиморфизмов соответствующих генов, оказывает повреждающее действие на половые клетки и влияет на параметры спермограммы [14, 18, 20].
Выводы. Распределение полиморфизмов гена GSTP1 (A313G, rs1695) показали достоверные различия в распределении частот генотипов в подгруппе мужчин с преобладанием патологических форм сперматозоидов. Это исследование демонстрирует, что полиморфизм гена GSTP1 (A313G, rs1695) можно считать генетическим маркером восприимчивости к патоспермии у лиц мужского пола.



