Ежегодно в мире выявляют около 210 тыс. новых случаев первичного почечно-клеточного рака (ПКР), что составляет 2% в структуре онкологической заболеваемости.
В России регистрируют более 23 тыс. новых случаев рака почки в год. На долю ПКР приходится 90% всех злокачественных опухолей почки [1–3]. Для 95% больных ПКР представлен спорадическими карциномами, развивающимися в пожилом возрасте и имеющими одностороннюю локализацию. При наследственных опухолях, связанных с онкологическими синдромами, развитие новообразований почек обусловлено в первую очередь наследственными мутациями.
«Золотым» стандартом в лечении больных первичным ПКР является хирургическое лечение, с помощью которого можно добиться довольно высоких показателей безрецидивной выживаемости. Пятилетняя безрецидивная выживаемость больных первой и второй стадиями заболевания составляет 80–95 и 75% соответственно [4–6]. В настоящее время не существует убедительных доказательств целесообразности применения конвенциональной лучевой терапии (ЛТ) в отношении больных первичным ПКР. Это связано с радиорезистентностью опухоли к конвенциональной (стандартной) ЛТ. Для преодоления радиорезистентности опухолей, к каким относится ПКР, требуется подведение больших доз за фракцию. С радиобиологической точки зрения при опухолях, имеющих низкое значение коэффициента α/β, к которым относится и ПКР, также обосновано применение больших доз за фракцию [7].
Пред- и послеоперационная лучевая терапия
Применение предоперационной ЛТ в отношении больных ПКР неоднозначно. По мнению большинства исследователей, предоперационная ЛТ не дает преимуществ в выживаемости больных ПКР.
В рамках исследования из Нидерландов проведен проспективный анализ результатов лечения 126 больных ПКР с оценкой роли предоперационной ЛТ в режиме стандартного фракционирования разовой очаговой дозы (РОД) 2 Гр, суммарной очаговой дозы (СОД) 30 Гр. В проведенном сравнительном анализе не получено разницы в 5-летних показателях общей выживаемости больных ПКР в зависимости от метода лечения: нефрэктомия или предоперационная ЛТ+нефрэктомия [6].
Интенсификация режима предоперационной ЛТ с увеличением дозы за фракцию до 2,2 Гр и суммарной дозы до СОД 33 Гр в исследовании Н. Juusela et al. привела к снижению показателей общей выживаемости в связи с большим числом послеоперационных осложнений [8]. В данное рандомизированное исследование включены 88 пациентов ПКР. Пятидесяти больным проведена операция в объеме нефрэктомии, 38 – предоперационная ЛТ и нефрэктомия.
В исследовании продемонстрировано, что предоперационная ЛТ ухудшает отдаленные результаты лечения. Показатели 5-летней общей выживаемости больных с предоперационной ЛТ были ниже (47 %) по сравнению с больными, которым выполнялась только нефрэктомия (63%). В подгрупповом анализе пациентов с предоперационной ЛТ также не выявлено значимого улучшения показателей общей выживаемости больных в зависимости от прогностических факторов [8].
Роль послеоперационной ЛТ была оценена и в проспективных, и в ретроспективных исследованиях. М. Stein et al. [9] сравнили результаты лечения больных ПКР, получивших хирургическое лечение в самостоятельном варианте и в комбинации с послеоперационной ЛТ в стандартном режиме фракционирования РОД 2 Гр, СОД 46 Гр. Анализ результатов лечения больных в зависимости от распространенности процесса показал преимущество послеоперационной ЛТ только в отношении больных с T3N0M0-стадиями. Отмечено достоверное снижение частоты локальных рецидивов у больных, получавших послеоперационную ЛТ с 37 до 10%, по сравнению с пациентами, в отношении которых использовался только хирургический метод лечения. Однако различий в показателях общей выживаемости больных в зависимости от метода лечения вновь выявлено не было [9].
Другое проспективное исследование (Copenhagen Renal Cancer Study Group) продемонстрировало, что повышение РОД до 2,5 Гр и СОД до 55 Гр приводило к увеличению частоты осложнений до 44%, повышению риска смерти и ухудшению отдаленных результатов лечения. Показатели 5-летней общей выживаемости больных, перенесших нефрэктомию в комбинации с послеоперационной ЛТ, составили 38%, нефрэктомию – 63% [9].
С целью оценки эффективности послеоперационной ЛТ для больных ПКР М. А. Tunio et al. [10] проведен метаанализ, в который вошли данные 7 рандомизированных исследований, включивших 735 больных. Несмотря на то что послеоперационная ЛТ способствовала достоверному снижению частоты локальных и регионарных рецидивов (р<0,001), не достигнут выигрыш в выживаемости для этих больных (р=29) [10].
Большой интерес представляет работа А. Д. Каприна и соавт. по изучению последовательного применения ЛТ и иммунотерапии в послеоперационном периоде больным ПКР. Авторы сообщили о результатах лечения 85 пациентов ПКР Т3аN0M0-стадиями. Больным контрольной группы (52 человека) выполнили только хирургическое лечение в объеме нефрэктомии, 33 пациентам основной группы после нефрэктомии провели ЛТ в стандартном режиме фракционирования РОД 2 Гр, 5 фракций в неделю, СОД 46–50 Гр. Через 7–10 дней после завершения ЛТ больные получили курс иммунотерапии реофероном 3 млн МЕ в/м через день, 3 раза в неделю. Продолжительность курса иммунотерапии составила от 4 до 12 мес., в среднем 6 мес.Послеоперационная ЛТ в комбинации с иммунотерапией оперированных больных ПКР не только улучшила показатели локального контроля, но и достоверно снизила частоту отдаленных метастазов – с 44,3 до 21% – по сравнению с пациентами контрольной группы (р=0,004). Однако статистически достоверных различий в показателях общей и безрецидивной выживаемости больных отмечено не было. Показатели 3-летней общей выживаемости больных, перенесших комплексное лечение и нефрэктомию, составили 77 и 76% соответственно [11].
Таким образом, попытки выполнения предоперационной ЛТ в проведенных исследованиях не позволяют судить о преимуществе такого подхода к лечению. Послеоперационная ЛТ после радикального удаления опухоли при ПКР не оправданна и не должна включаться в стандарты лечения данных больных.
Самостоятельная лучевая терапия первичного неоперабельного почечно-клеточного рака
Конвенциональная ЛТ при ПКР не эффективна, что связано с уникальными биологическими характеристиками данной опухоли. Известно, что ПКР представляет собой не только морфологически, но и генетически гетерогенную группу опухолей, которая может быть представлена как наследственными, так и спорадическими случаями. Продукты генов с соматическими активирующими мутациями могут вызывать радиорезистентность ПКР. Проведенные экспериментальные исследования выявили взаимосвязь между радиорезистентностью ПКР и HIF-фактором (hipoxia-inducible factor), индуцируемым гипоксией, а также транскрипционным фактором STAT1 [12, 13].
В исследовании S. Ning et al. определено значение коэффициента α/β (маркер радиочувчивительности) для культуры клеток ПКР, равное 2,6 Гр. Авторы продемонстрировали, что гибель опухолевых клеток возрастала при увеличении дозы за фракцию [14].
Экспериментальное исследование, проведенное L. Walsh et al., также подтвердило теорию, согласно которой радиочувствительность ПКР возрастает при подведении к опухоли больших доз за фракцию. Было продемонстрировано, что облучение рака почки у экспериментальных животных (мышей) тремя фракциями СОД 48 Гр приводило к 30%-ному сокращению объема опухоли и исчезновению активных митозов в опухолевых клетках [15].
Однако подведение больших доз к мишени сопряжено с высоким риском лучевых повреждений смежных тканей и органов. Благодаря появлению новых технологий ЛТ, к которым относится стереотаксическая радиотерапия (СРТ), появилась возможность точной доставки доз ионизирующего излучения к опухоли без опасности повреждения соседних тканей и органов. Современные средства визуализации позволяют контролировать каждый сеанс облучения в реальном времени. Для этой цели используют компьютерные томографы с коническим пучком излучения, способные определять трехмерную конфигурацию и пространственное расположение опухоли с точностью до 1 мм [16].
Хотя операция остается «золотым» стандартом лечения больных первичным ПКР, существуют ситуации, когда СРТ может представлять альтернативное решение. СРТ может быть рекомендована больным с высоким риском выполнения оперативного вмешательства.
Результаты первого клинического исследования по СРТ больным ПКР были опубликованы G. Qian et al. в 2003 г.
В исследование вошли 20 пациентов с ПКР, которым проведен курс СРТ в режиме 8 Гр за 5 фракций. Достигнуты высокие показатели локального контроля (93%) [17, 18].
Подобная высокая частота локального контроля наблюдалась и в исследовании Р. Wersäll et al. К 8 пациентам, вошедшим в исследование, применили 3 режима СРТ: 8 Грх5 фракций, 10 Грх фракций и 15 Грх3 фракций. Срок наблюдения за больными составил 37 мес. Частота локального контроля была равна 90–98%. Пять пациентов живы без прогрессирования заболевания. Все режимы ЛТ показали приемлемый токсический профиль [14, 19, 20].
В 2004 г. J. Beitler et al. опубликовали результаты лечения 9 пациентов, к которым был применен тот же режим СРТ, как и в исследовании G. Qian et al. Медиана наблюдения за больными составила 26,7 мес. Четверо из 9 пациентов живы без прогрессирования заболевания [21, 22].
Первый системный обзор по СРТ первичного ПКР опубликован S. Siva et al в 2012 г. В обзор были включены 3 проспективных и 7 ретроспективных исследований, включивших 126 пациентов с первичным неоперабельным ПКР. В исследованиях применялся широкий диапазон разовых доз: от 4,5 до 15 Гр. В зависимости от числа подведенных фракций и разовых доз суммарные дозы варьировались от 32 до 72 Гр (см. таблицу). Авторами проведены расчеты биологически эффективной дозы облучения (БЭД), которые варьировались от 163,1 до 343,4 Гр (α/β=2,6Гр) [18, 21, 23].
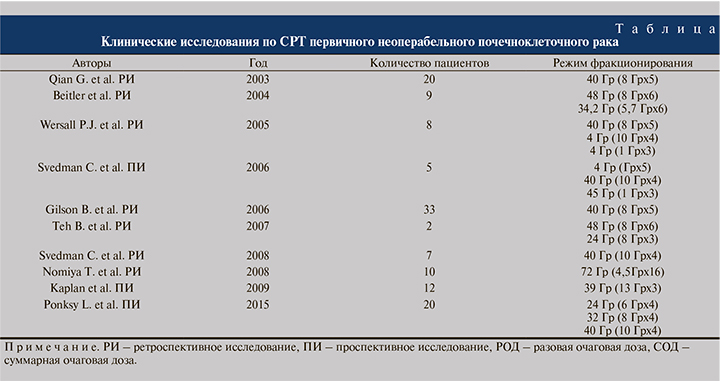
Медиана наблюдения за больными колебалась в пределах от 9 до 57,5 мес. Показана эффективность и безопасность СРТ для больных первичным ПКР. Показатели локального контроля колебались в пределах 84–100%. Взвешенная средняя величина 2-летнего локального контроля за больными составила 92,9%. Частота токсических эффектов 1–3-й степеней была равна 21,4%, 3-й степени – 3,8%. Наиболее частыми видами токсичности были тошнота, общая слабость, диарея и дерматиты. Ни у одного пациента не отмечено снижения средней скорости клубочковой фильтрации почек (сСКФ) [18].
В 2018 г. опубликован мета-анализ результатов проспективных и ретроспективных исследований по СРТ.
В мета-анализ включили 223 больных первичным ПКР. Из них к 118 больным применена единственная фракция и 105 пациентам выполнена стереотаксическая ЛТ в режиме гипофракционирования [21, 23]. Средний возраст больных составил 72 года. Среди больных преобладали мужчины (69,5%). Доза, подведенная к мишени за 1 фракцию, варьировалась от 14 до 26 Гр и в среднем была равна 25 Гр (БЭД=87,5 Гр). Средняя доза при гипофракционированной СРТ составила 40 Гр (БЭД=80 Гр). Диапазон суммарных доз колебался в пределах 24–70 Гр, подведенных за 2–10 фракций. В представленных клинических исследованиях наиболее часто применялись следующие режимы СРТ: 24 Гр (8 Грх3) и 40 Гр (8 Грх5). Частота локального контроля, раковоспецифическая выживаемость и выживаемость до прогрессирования за 2 года составили 97,8, 95,7 и 77,4%, за 4 года – 97,8, 91,9 и 65,4% соответственно. Не было выявлено различий в локальном контроле над опухолью у больных, получивших однофракционный и гипофракционированный режимы СРТ (p=0,60). Интересное наблюдение: пациенты, получавшие однофракционный режим СРТ, менее склонны к отдаленному прогрессированию и смерти от ПКР. На основании проведенного многофакторного анализа выявлен значимый неблагоприятный фактор прогноза, влияющий на безрецидивную выживаемость: размер опухоли более 8 см. Острая токсичность (CTCAE, версия 4) отмечена у 83 (37,3%) больных. Частота поздних лучевых повреждений 1–2-й степеней выявлена у 35,6% пациентов и 3–4-й – у 1,3%. Отмечено снижение сСКФ почек с 59,9±21,9 мл/мин/мл до 5,5±13,3 мл/мин (p<0,01). Проведен сравнительный анализ переносимости и токсичности в зависимости от режима СРТ. Негематологическая токсичность в виде тошноты чаще наблюдалась при подведении 1 фракции и составила 17% против 6,8 при увеличении числа фракций (р=0,005). Остальные параметры профиля токсичности не различались в зависимости от режима СРТ. Сравнительный анализ функционального состояния почек больных в зависимости от режима СРТ не выявил достоверных различий в концентрации креатинина в сыворотке крови и сСКФ почек. Таким образом, на основании мета-анализа сделаны следующие выводы: СРТ является эффективным методом лечения больных первичным ПКР с минимальными значениями острой и поздней токсичности.
Возможность применения СРТ в отношении пациентов с ПКР единственной почки привлекло внимание S. Siva et al., опубликовавшие свое исследование в 2019 г.
Двухлетние показатели выживаемости без прогрессирования, раково-специфической выживаемости и общей выживаемости составили 98,0, 77,5, 98,2 и 81,5% соответственно. Показатель сСКФ снизился на 9% по сравнению с первоначальными показателями, однако ни одному пациенту не потребовался гемодиализ, что говорит о безопасности применения СРТ больным первичным ПКР единственной почки [24].
Более крупное исследование, посвященное изучению СРТ, опубликовано S. Siva et al. в 2020 г. В него были включены 95 пациентов с первичным нерезектабельным ПКР с T1b-стадими из 9 онкологических центров Германии, Австралии, США, Канады и Японии. Средний возраст больных составил 76 лет. У 70% больных до лечения отмечено умеренное снижение сСКФ (57,2 мл/мин), у 30% – выраженное снижение сСКФ (<45 мл/мин). После СРТ отмечено снижение сСКФ на 7,9 мл/мин. Трем пациентам (3,2%) потребовалось проведение гемодиализа. Острая токсичность 1–2-й степеней диагностирована у 38 пациентов (40%). Об острой токсичности 3–5-й степеней в данном исследовании не сообщалось. СРТ проводилась в однофракционном и гипофракционированном режимах. Средняя суммарная доза составила 26 Гр (диапазон доз: 14–48 Гр), что было эквивалентно медиане БЭД, равной 87,5 Гр (диапазон доз: 33,6–124,8 Гр). После СРТ показатели 2-и 4-летней раковоспецифической выживаемости, общей выживаемости и выживаемости без прогрессирования заболевания составили 96,1, 83,7% и 81,0 и 91,4%, 69,2, 64,9% соответственно. Это исследование показало высокую эффективность, низкую частоту локальных неудач (2,9%), сопоставимое снижение сСКФ с хирургическим лечением в объеме резекции почки [25].
Десятилетнее ретроспективное исследование Т. Yamamoto et al., включившее 29 пациентов с ПКР, также показало хорошие результаты СРТ. Дозы СРТ в данном исследовании составили 70, 60 и 50 Гр за 10 фракций. Средняя доза на планируемый объем опухолевого образования (Planning Target Volume, PTV) достигла 72,9 Гр (диапазон: 47,9–80,6), а на опухолевый объем (Gross Tumor volume, GTV) 73,8 Гр (диапазон: 48,5–91,8 Гр). По результатам исследования пятилетние показатели локального контроля, локорегионального контроля и безрецидивной выживаемости составили 94, 88 и 50% соответственно. После СРТ отмечено снижение медианы сСКФ на 5,4 мл/мин/1,73 м2. Токсичность 3-й степени и выше не выявлена ни у одного больного. Рецидивы в облученной почке диагностированы лишь у 2 пациентов: у одного с рецидивом в ложе опухоли и у одного с рецидивом за пределами PTV+2 см [26].
В 2016 г. инициировано проведение первого многоцентрового рандомизированного исследования (15.03 FASTRACK II). В исследование планируется включить 70 больных первичным неоперабельным ПРК. В зависимости от размера опухоли будет применено два режима СРТ. Первый режим СРТ заключается в подведении 1 фракции, равной 26 Гр, при опухолях диаметром ≤4 см. Если диаметр опухоли >4 см, планируется проведение СРТ в гипофракционированном режиме 3 фракциями до СОД 42 Гр. Первичная конечная точка исследования – оценка эффективности СРТ. Конечная точка – оценка толерантности, общей, раковоспецифической, безметастатической выживаемости, токсичности, функции почек и стоимости лечения. Авторами проведены расчеты биологической эквивалентной дозы для 2 режимов СРТ (α/β=6,9 Гр). Биологическая эквивалентная доза равна 127 Гр за 1 фракцию и 123 Гр за 3. Расчеты доз показывают, что используемые режимы эффективны для потенциальных эффектов опухоли [14]. Результаты данного исследования пока не опубликованы. Датой окончания исследования будет считаться дата последнего сбора данных, когда последний участник завершит 5-летний контрольный визит.
На симпозиуме Американского общества клинической онкологии по опухолям мочеполовой системы (ASCO GU) 2020 г. S. Siva представил серию результатов, посвященных изучению СРТ больных первичным ПКР. S. Siva подчеркнул, что все исследования продемонстрировали высокую эффективность и безопасность данного метода лечения.
Доктор S. Siva был ведущим автором проспективного клинического исследования FASTRACK, опубликованного в 2017 г. В исследование были включены 37 неоперабельных пациентов с Т1–2-стадиями ПКР. Пациенты получали либо одну фракцию по 26 Гр (при размере опухоли <5 см), либо три фракции по 14 Гр (при размере опухоли >5 см). Это исследование продемонстрировало высокую эффективность СРТ. При среднем периоде наблюдения 24 мес. 2-летняя частота локального контроля над опухолью составила 100%, безрецидивная выживаемость – 89%. Не было зарегистрировано токсичности 4–5-й степеней [27].
S. Siva подчеркнул, что радиотерапевты ожидают результатов многоцентрового исследования фазы II FASTRACK, целью которого стала проверка эффективности СРТ первичного ПКР в зависимости от размеров опухолевого образования и режима СРТ. По методологии данное исследование аналогично экспериментальному исследованию FASTRACK.
S. Siva остановился на решении, принятом Международным консорциумом по СРТ почек (IROCK): планируемый объем мишени (PTV) должен иметь отступ от клинического объема мишени 3–10 мм, количество используемых фракций должно составлять от 1 до 12 до общей дозы 25 Гр–80 Гр [28].
Доктор S. Siva завершил этот доклад, подчеркнув об ограничениях использования СРТ для первичного ПКР: опухоли >10 см; наличии тесного контакта опухоли со стенкой кишки, а также о наличии у больных ПКР в трансплантате почки. Нижняя граница СКФ=30 мл/мин также считается ограничением для применения СРТ.
Поскольку почки являются подвижным органом, многими радиотерапевтами рекомендовано проводить СРТ с использованием системы активного контроля дыхания. Sonier et al. оценил смещение опухоли между фазами дыхательного цикла. Результаты показали, что сдвиг опухоли во время дыхания в проксимальном и каудальном направлениях составляет 8,10±4,33 мм, в латеральном и медиальном – 1,51±1,00 мм, в дорсальном и вентральном направлениях – 3,08±2,11 мм [29].
Ежегодно в мире выявляют около 210 тыс. новых случаев ПКР, что составляет около 2% в структуре онкологической заболеваемости. В структуре злокачественных новообразований ПКР в России составляет 4,6% у мужчин и 3,2% у женщин. По темпам прироста онкологической заболеваемости с 2005 по 2015 г. ПКР устойчиво занимает одно из ведущих мест (28,61%).
Основной метод лечения больных первичным ПКР – хирургический. После радикального хирургического лечения вне зависимости от стадии заболевания адъювантная лекарственная и / или ЛТ не проводятся, поскольку не способствуют улучшению общей выживаемости больных.
Хотя операция остается «золотым» стандартом лечения больных первичным ПКР, ЛТ может быть рекомендована больным с высоким риском выполнения оперативного вмешательства. По данным многих клинических исследований ЛТ в стандартном режиме фракционирования не позволяет достигать удовлетворительных результатов лечения больных первичным ПКР. Стали проводиться исследования для выявления причин радиорезистентности ПКР к конвенциональной (стандартной) ЛТ. Проведенные экспериментальные исследования выявили взаимосвязь между радиорезистентностью ПКР и HIF-фактором (hipoxia-inducible factor), индуцируемым гипоксией, а также транскрипционным фактором STAT1. В исследовании S. Ning et al. определено значение коэффициента α/β (маркер радиочувчивительности) для культуры клеток ПКР, равное 2,6 Гр. Авторы продемонстрировали, что гибель опухолевых клеток возрастала при увеличении дозы за фракцию. Однако подведение больших доз к мишени сопряжено с высоким риском лучевых повреждений смежных тканей и органов. Благодаря появлению новых технологийЛТ, к которым относится СРТ, возникла возможность точной доставки доз ионизирующего излучения к опухоли без опасности повреждения соседних тканей и органов.
Проведенные клинические исследования продемонстрировали высокую эффективность и низкую токсичность СРТ. В исследованиях представлено разнообразие параметров фракционирования дозы. Статистически значимых различий в локальном контроле, показателях общей выживаемости, острой и поздней токсичности в зависимости от режима фракционирования выявлено не было. Также не отмечено разницы в снижении сСКФ почек в зависимости от примененного режима фракционирования. В исследованиях продемонстрировано, что рак в единственной почке не является противопоказанием к выполнению СРТ.
В ближайшее время будут представлены результаты многоцентрового исследования фазы II FASTRACK, целью которого стала проверка эффективности СРТ первичного ПКР в зависимости от размеров опухолевого образования и режима СРТ.
Однако СРТ имеет ограничения по применению. К ним относятся размеры опухоли более 10 см, наличие тесного контакта опухоли со стенкой кишки, наличие у больных ПКР в трансплантате почки, предел нижней границы сСКФ=30 мл/мин.
Таким образом, в настоящее время накоплен большой опыт проведения СРТ больным первичным ПКР. Исследования показали, что СРТ является эффективным и безопасным методом лечения больных первичным ПКР. Данный метод лечения может быть рекомендован неоперабельным больным, а также больным, отказавшимся от хирургического лечения.



